循环水养殖模式下养殖密度对青石斑鱼生长及生理指标的影响
2012-09-19张曦文吴垠贺茹靖苏延明刘琦
张曦文,吴垠,贺茹靖,苏延明,刘琦
(大连海洋大学辽宁省水生生物学重点实验室,辽宁大连116023)
工厂化循环水养殖中,一般通过增加养殖密度来提高单位水体的产量,以实现更高的经济效益[1-2]。但养殖密度过高可能会引起鱼类应激反应,改变鱼类内在生理状况,使养殖群体的生长率和存活率下降,使个体间生长差异增大[3]。Suresh等[4]研究表明,鱼类的生长率、存活率和食物利用率等均随着养殖密度的增大而降低。李爱华[5]研究表明,草鱼Ctenopharyngodon idellus拥挤胁迫10 d后,肝脏的脏器系数变化不显著,而脾脏的脏器系数却显著降低。Montero等[6]研究表明,高养殖密度组金头鲷Sparus aurata的血红蛋白含量、红细胞数量、血糖含量、血浆蛋白含量均显著低于低密度组。因此,研究鱼类在不同密度环境下的生理反应机制,将有助于在生产实践中掌握适当的养殖密度,提高养殖效益。
青石斑鱼Epinephelus awoara属鲈形目、鮨科、石斑鱼属,为沿海暖水性中下层鱼类。青石斑鱼肉质细嫩,味道鲜美,营养丰富[7-8],生长速度快,为近年来兴起的优良养殖种类之一。目前,关于青石斑鱼在循环水养殖条件下适宜的养殖密度方面的研究尚未见报道。本研究中,作者探讨了不同养殖密度对青石斑鱼生长及生理指标的影响,旨在为进一步探索青石斑鱼在密度胁迫环境下的适应机制提供参考,并为工厂化循环水养殖青石斑鱼提供一定的参考依据。
1 材料与方法
1.1 材料
试验用青石斑鱼取自大连汇新钛公司设施渔业工程中心养殖基地。
试验用配合饲料由北欧马公司提供,其主要营养成分含量 (均为质量分数)为粗蛋白47%、粗脂肪15%、粗灰分13%、水分11%。
试验在闭合循环水养殖系统中进行,闭合式循环养殖系统由养殖容器(70 cm×40 cm×40 cm)、热泵系统、生物滤器和紫外消毒机组成。
1.2 方法
1.2.1 试验设计与管理 试验前将青石斑鱼暂养10 d使其适应试验环境。适应期结束后挑选大小均匀的健康个体进行分组试验。试验于2011年7月—9月进行,为期 50 d。试验设 10、20、30 kg/m33个养殖密度组,每组设3个重复,每个密度条件由独立的循环系统组成。试验期间,每天8:00和17:00投喂两次配合饲料,投喂量为试验鱼体质量的1%,每次投饵30 min后将容器内的粪便和残饵用虹吸法吸出。水温控制在 (26±0.5)℃,盐度为 (29±1),pH为7.5±0.3,24 h连续充气,溶氧保持在5 mg/L以上。每3 d检测一次亚硝酸盐和氨氮的浓度,保持亚硝酸盐浓度低于4.109 μmol/L,氨氮质量浓度低于0.078 mg/L。
1.2.2 生长指标的测定 饲养试验结束后,对各组鱼逐一进行称重、量体长,并按下式计算增重率(WG)、特定生长率 (SGR)和饲料系数 (FCR):

式中:W0、Wt分别为试验初始和终末时的平均鱼体质量 (湿重,g);WF为饲料总摄入量 (湿重,g);t为试验天数 (d);n为试验个体数量。
1.2.3 鱼组织谷丙转氨酶 (GPT)和谷草转氨酶(GOT)的测定 试验结束后,从每个容器中随机取3尾鱼,立即在冰盘上取其肝脏和鳃组织,剔除脂肪,称重。以10倍去离子水匀浆各组织,将组织悬液在4℃下以3 000 r/min离心20 min,上清液即为酶粗提取液。采用赖氏法测定酶提取液中GPT和GOT活性。
1.2.4 血液指标的测定 试验结束后,从每个容器中随机取3尾鱼,自尾部血管采血,其中一部分血液用于测定血细胞 (红细胞、白细胞)数量和血红蛋白含量;另一部分血液静置30 min后,以4 000 r/min离心15 min,吸取上层血清放入低温冰箱中备用。
采用稀释法计数鱼类单位容积血液中的红细胞和白细胞数,采用酸化血红蛋白稀释法测定血液中的血红蛋白含量,使用罗氏MODULAR EVO仪器检测血清中的GPT和GOT活性,使用日立Elecsys 2010血液免疫分析仪测定血清中的皮质醇含量。
1.2.5 鱼体组成成分的测定 饲养试验结束后,将鱼饥饿24 h,从每个容器中随机取3尾鱼,在冰盘内解剖,取鱼体两侧头盖骨后至尾鳍前的全部肌肉,剪碎,混匀后用于测定。采用烘干法 (105℃)测定鱼体肌肉水分含量,采用凯氏定氮法测定粗蛋白含量,采用索氏抽提法测定粗脂肪含量,采用高温灼烧法测定粗灰分含量。
1.3 数据处理
试验数据采用平均数±标准差表示,用SPSS 13.0进行单因素方差分析,如有显著性差异,用Duncan氏法进行多重比较,差异显著性水平设为0.05。
2 结果
2.1 养殖密度对青石斑鱼生长的影响
从表1可见:试验结束时,10 kg/m3密度组青石斑鱼的体质量均高于其他两组,但仅与30 kg/m3密度组有显著性差异 (P<0.05);30 kg/m3密度组鱼的增重率和特定生长率最低,且明显低于其他两组 (P<0.05),而其他两组间无显著性差异 (P>0.05);各组饲料系数的变化趋势为30 kg/m3组>20 kg/m3组>10 kg/m3组,且组间存在显著性差异 (P<0.05)。
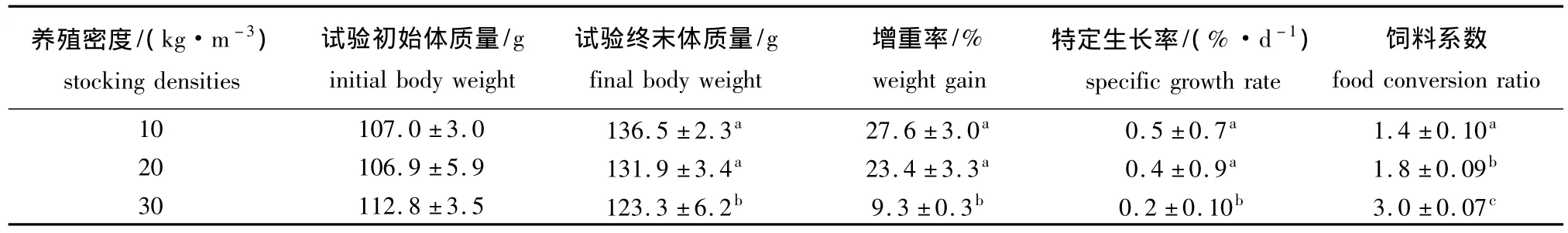
表1 不同养殖密度对青石斑鱼生长及摄食的影响Tab.1 The growth and feed intake in grouper Epinephelus awoara at various stocking densities
2.2 养殖密度对青石斑鱼肝脏、鳃及血清酶活性的影响
从表2可见:在试验设定的养殖密度范围内,青石斑鱼肝脏、鳃中的GPT活性均随着养殖密度的增大明显增大,且各组间有极显著性差异 (P<0.01);不同养殖密度组鱼肝脏中的GOT活性均无显著性差异 (P>0.05),30 kg/m3密度组鱼鳃中的GOT活性最高,且与其它两组有显著性差异(P<0.05),但20 kg/m3密度组与10 kg/m3密度组鱼鳃中的GOT活性间无显著性差异 (P>0.05);血清中GPT和GOT活性均随养殖密度的增加而增大,且各组间均有极显著性差异 (P<0.01)。

表2 不同养殖密度下青石斑鱼肝脏、鳃及血清的酶活性Tab.2 Enzyme activities in liver,gill and serum in grouper Epinephelus awoara at various stocking densities
2.3 养殖密度对青石斑鱼血细胞及皮质醇含量的影响
从表3可见:青石斑鱼的红细胞数量随养殖密度的增加而递减,即30 kg/m3组<20 kg/m3组<10 kg/m3组,且各组间有极显著性差异 (P<0.01);各组鱼的白细胞数量无显著性差异 (P>0.05);血红蛋白含量的变化趋势显示,10 kg/m3密度组与20 kg/m3密度组间无显著性差异 (P>0.05),但均与30 kg/m3密度组有显著性差异 (P<0.05);30 kg/m3密度组青石斑鱼血清中皮质醇含量最高,10 kg/m3密度组最低,且各组间有极显著性差异 (P<0.01)。

表3 不同养殖密度对青石斑鱼血液指标的影响Tab.3 Blood physiological indices in grouper Epinephelus awoara at various stocking densities
2.4 养殖密度对青石斑鱼肌肉营养组成的影响
从表4可见:青石斑鱼在3种养殖密度下饲养50 d后,其肌肉的水分、粗蛋白、粗脂肪、灰分含量虽有不同,但组间均无显著性差异 (P>0.05)。
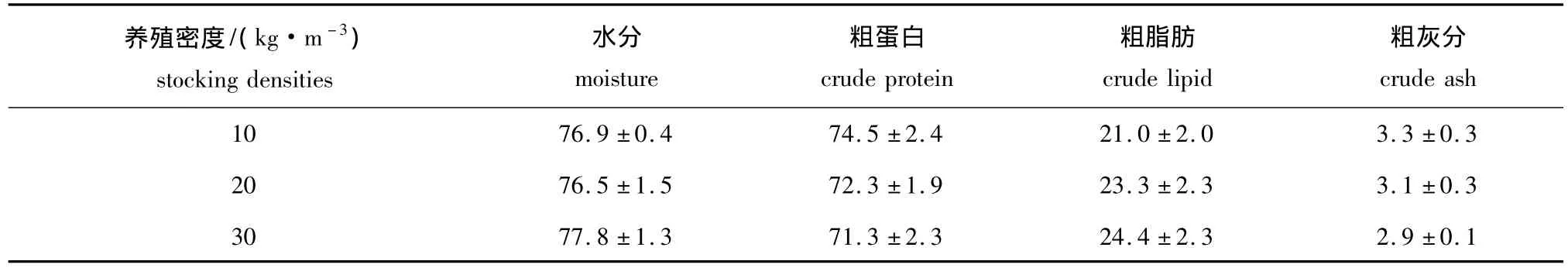
表4 不同养殖密度对青石斑鱼肌肉营养的影响Tab.4 Musclular approximate composition in grouper Epinephelus awoara at various stocking densities w/%
3 讨论
3.1 不同养殖密度对青石斑鱼生长的影响
鱼生活在高养殖密度环境中,被普遍认为是处于一系列复杂的相互作用的因素中,这些因素或单独或叠加地影响鱼的生长,所以鱼群密度对其生长的影响机制较为复杂。养殖密度的增加会胁迫鱼群产生一系列生理生化的变化来适应高密度环境[9]。生理功能的调节需消耗大量能量,因而影响鱼的生长。庄平等[10]研究认为,史氏鲟Amur sturgeon经过28 d的饲养后,各组的生长表现出显著差异,生长效率、特定生长率和日增重都随养殖密度的增大而降低。黄宁宇等[3]研究发现,瓦氏黄颡鱼Pelteobagrus vachelli幼鱼的最终体质量、增重率和特定生长率都随养殖密度的增大而显著性降低。江仁堂[11]认为,虹鳟Oncorhynchus mykiss稚鱼在不同的养殖密度条件下,个体的最终体质量、特定生长率和日增重均随放养密度的增大而降低,饵料转化率也降低。Poston等[12]认为,通过提高水中溶氧水平可减少养殖密度对大西洋鲑Atlantic salmon的影响。但在本试验中,即使各密度组的溶氧水平处于基本一致的良好试验条件下,其生长还是表现出了显著性的差异。30 kg/m3密度组青石斑鱼的增重率、特定生长率均明显低于20 kg/m3和10 kg/m3密度组 (P<0.05),而20 kg/m3密度组的增重率和特定生长率虽比10 kg/m3密度组低,但不存在显著性差异 (P>0.05),表明高密度养殖对青石斑鱼的生长产生了负面影响,这与Procarione等[13]对虹鳟的研究结果一致。
本试验中,在相同饲养管理条件下,闭合循环养殖50 d后,10 kg/m3密度组青石斑鱼增加的体质量为263.4 g/m3,增重率为27.6%,这与洪惠馨等[14]的研究结果 (25.38%)接近。而20 kg/m3密度组增加的体质量为446.4 g/m3,30 kg/m3密度组增加的体质量为272.3 g/m3。虽然10 kg/m3的增重率和特定生长率均高于20 kg/m3密度组,但从总的增重量来看,20 kg/m3密度组远大于10 kg/m3密度组,这也就意味着带来的经济效益会好于10 kg/m3密度组。而3种养殖密度下鱼的肌肉营养组成 (如粗蛋白、粗脂肪等)并没有显著性差异。
3.2 不同养殖密度对青石斑鱼肝脏、鳃及血清酶活性的影响
GOT和GPT是氨基酸代谢过程中两个重要的氨基转移酶[15]。在胁迫环境下,氨基酸是鱼类进行糖异生作用的优先替代物,鱼类会消耗蛋白质和脂肪等来满足能量的需求,同时相关酶活性也显著升高[16]。本试验中,3个养殖密度组鱼的肝脏和腮中GPT活性均存在显著性差异,且随养殖密度的增加而增大,可能是由于高密度组青石斑鱼受到胁迫作用后,应激作用加强,导致氨基酸代谢增强以抵抗不利环境。
正常情况下,动物体内的GPT和GOT主要存在于各组织的细胞中 (以肝细胞中含量最多),血清中这两种酶活力很低[17]。但是当组织细胞受到一定损伤时,可能有GOT和GPT从细胞内逸出进入血液循环,使血清中的这两种转氨酶活性升高,因此,通常根据血清中这两种转氨酶活性的变化判断肝脏等组织器官的功能状况[18]。30 kg/m3密度组鱼血清中的GPT和GOT的活性明显高于10 kg/m3密度组和20 kg/m3密度组 (P<0.01),表明可能该组青石斑鱼的肝脏受到一定损伤,青石斑鱼体内的物质代谢亦受到了影响,这与逯尚尉等[1]的研究结果一致。
3.3 不同养殖密度对青石斑鱼血液指标及皮质醇含量的影响
鱼类血液与机体的代谢、营养状况及疾病有着密切的关系,当鱼体受到外界因子的影响而发生生理或病理变化时,必定会在血液指标中反映出来。因此,血液成分的变化被广泛地用来评价鱼类的健康状况、营养状况以及对环境的适应状况,也是重要的生理、病理和毒理学指标[16]。
很多学者在对养殖密度胁迫的研究中,将血液中的皮质醇水平作为一项反映应激状态下鱼体内分泌活动的重要指标。王文博等[19]的试验也表明,拥挤胁迫3 d后,试验组鲫Crucian carp血液中的皮质醇水平迅速上升,且密度越高上升幅度越大,说明高养殖密度引起了鱼体的应激反应。Rotllant等[20]指出,赤鲷Pagrus pagrus在经过23 d拥挤胁迫后,血浆中的皮质醇水平显著升高。Tejpal等[21]研究发现,高养殖密度组印鲮Cirrhinus mrigala幼鱼血液中的皮质醇含量明显高于低养殖密度组。本试验中,随着养殖密度的增大青石斑鱼血液中的皮质醇含量显著增高,说明在受到密度胁迫时,青石斑鱼表现出一定的应激反应现象。
从本试验结果可以看出,虽然10 kg/m3密度组青石斑鱼各项指标均优于其它组,但从经济效益角度出发,20 kg/m3为最佳饲养密度。
[1]逯尚尉,刘兆普,余燕.密度胁迫对点带石斑鱼幼鱼生长、代谢的影响[J].中国水产科学,2011,18(2):322-328.
[2]张永泉,尹家胜,王丙乾,等.养殖密度对白点鲑幼鱼生长、存活以及行为的影响[J].大连水产学院学报,2009,24(6):520-524.
[3]黄宁宇,夏连军,么宗利,等.养殖密度和温度对瓦氏黄颡鱼幼鱼生长影响实验研究[J].浙江海洋学院学报,2005(3):208-212.
[4]Suresh A V,Lin C K.Effect of stocking density on water quality and production of red tilapia in a recirculated water system[J].Aquac Engineering,1992(11):1-22.
[5]李爱华.拥挤胁迫对草鱼血浆皮质醇、血糖及肝脏中抗坏血酸含量的影响[J].水生生物学报,1997,21(4):384-386.
[6]Montero D,Tort L,Lzquierdo M S,et al.Hematological recovery in Sparus aurata after bleeding[J].Rev Esp Fis,1995,51:219-226.
[7]陈波,罗海忠,付荣兵.青石斑鱼生物学特性及其人工繁育技术[J].河北渔业,2006(2):29-31.
[8]王秋荣,毕建功,林利民,等.青石斑鱼骨骼发育异常的形态特征[J].大连海洋大学学报,2012,27(5):417-421.
[9]邵邻相,谢炜,叶菲菲.养殖密度对地图鱼幼鱼生长发育的影响[J].水产科学,2005,24(4):7-9.
[10]庄平,李大鹏,王明学,等.养殖密度对史氏鲟稚鱼生长的影响[J].应用生态学报,2002(6):735-738.
[11]江仁堂.放养密度对虹鳟稚鱼生长的影响[J].水产学杂志,2009,22(4):32-33.
[12]Poston H A,Williams R C.Interrelations of oxygen concentration,fish density,and performance of Atlantic salmon in an ozonated water reuse system[J].Prog Fish Cult,1988,50:69-76.
[13]Procarione L S,Barry T P,Malison J A.Effects of high rearing densities and loading rates on the growth and stress responses of juvenile rainbow trout[J].North American Journal of Aquaculture,1999,61:91-96.
[14]洪惠馨,林利民,陈学豪,等.配合饵料饲养青石斑鱼的研究[J].厦门水产学院学报,1996,18(1):16-20.
[15]Zhou S W,Zou S X,Jiang Y M,et al.Animal biochemistry[M].3th ed.Beijing:China Agriculture Press,2003:156-175.
[16]周玉,郭文扬,杨振国,等.鱼类血液指标研究进展[J].上海水产大学学报,2001,10(2):163-165.
[17]桂远明.水产动物机能学实验[M].北京:中国农业出版社,2004:140.
[18]陈晨,黄峰,舒秋艳,等.共轭亚油酸对草鱼生长、肌肉成分、谷草转氨酶及谷丙转氨酶活性的影响[J].水生生物学报,2010,34(3):647-651.
[19]王文博,李爱华.环境胁迫对鱼类免疫系统影响的研究概况[J].水产学报,2002,26(4):368-374.
[20]Rotllant J,Tort L.Cortisol and glucose responses after acute stress by net handling in the sparid red porgy previously subjected to crowding stress[J].J Fish Biol,1997,51:21-28.
[21]Tejpal C S,Pal A K,Sahu N P.Dietary supplementation of L-tryptophan mitigates crowding stress and augments the growth in Cirrhinus mrigala fingerlings[J].Aquaculture,2009,293:272-277.
