油茶SOD基因片段克隆及序列分析
2012-09-18郭春兰张露
郭春兰,张露
(江西农业大学园林与艺术学院,江西南昌330045)
油茶SOD基因片段克隆及序列分析
郭春兰,张露
(江西农业大学园林与艺术学院,江西南昌330045)
根据已报道的多种植物Cu/Zn-SOD和Mn/Fe-SOD基因的氨基酸序列的保守区域分别设计简并引物,以油茶(Camelliaoleifera)叶片总RNA为模板,通过RT-PCR分别扩增得到一个375bp的Cu/Zn-SOD基因片段和一个429bp的Mn/Fe-SOD基因片段。将片段序列在NCBI网站上进行同源性比对,表明本研究克隆的结果均与多种植物的Cu/Zn-SOD和Mn/Fe-SOD基因存在亲缘关系,因而认为所克隆的基因片段就是油茶SOD基因;并运用DNAStar5.0软件分别进行序列分析,推导的氨基酸序列分别为125个残基和143个残基;具有所有植物SOD基因共有的保守区域;与多种植物Cu/Zn-SOD基因的核苷酸和氨基酸序列的同源性均分别在80%和84%以上,与其他植物的Mn/Fe-SOD基因的核苷酸和氨基酸序列的同源性都在84%和86%以上。
油茶;SOD;基因克隆;序列分析
超氧化物歧化酶(Superoxide Dismutase,SOD)是一个金属酶家族,具有清除生物体代谢所产生的超氧自由基的特异性,能够有效防止生物分子被氧化。SOD广泛存在于各种生物体内,是生物执行体防御机能最重要的酶之一[1]。SOD根据其酶活性中心辅基结合金属离子的不同,分为Cu/Zn-SOD和Mn/Fe-SOD。自20世纪80年代从玉米(Zea mays)[2]中克隆了首个植物SOD基因至今,国内外学者已从莲(Nelumbonucifera)[3]、丹参(Salvia miltiorrhiza)[4]、甘薯(Caricapapaya)[5]、莴苣(Lactucadolichophylla)[6]等多种植物中克隆出SOD基因。
油茶(Camelliaoleifera)是山茶科山茶属植物,为我国特有的食用油料树种,其综合利用价值极高,具有良好的生态、经济和社会效益,在我国林业,尤其是江西省林业中占有十分重要的地位[7-8]。由于油茶病虫害种类繁多,主要有炭疽病、软腐病、烟煤病、油茶叶蜂、油茶蛀茎虫等,传统防治方法效果不佳[9-10]。而近年来,油茶基因工程研究主要集中在与油脂合成有关的关键酶基因方面[11-13],与油茶抗逆分子研究的相关报道较少。因此,从分子水平对油茶的抗逆性进行研究具有重要的现实意义。本研究以油茶为材料,以克隆SOD基因的核心序列为目标,克隆其全长序列,研究该基因时空特异性表达,为探索其调控途径奠定基础。
1 材料与方法
1.1 材料 于2011年3月,从江西省林业科学院油茶种质资源圃采集油茶优良品种——赣无1号的幼嫩叶片,用液氮速冻后,放入-80℃的超低温冰箱中备用。
克隆载体pEASY-T1购自北京全式金生物公司,受体大肠杆菌(Escherichiacoli)菌株为JM109,限制性内切酶、Taq DNA聚合酶等购自大连宝生物公司,PCR产物纯化试剂盒购自Clontech公司,dNTPs、氨苄青霉素、DNA marker等购自上海生工生物工程有限公司。
1.2 方法
1.2.1 总RNA提取 使用改良异硫氰酸胍法提取油茶叶片总RNA。
1)对试验所用的金属、玻璃和塑料制品进行去RNA酶(RNase)处理:用0.1%DEPC水浸泡枪头和离心管12h以上,之后,高温高压灭菌,烘干后备用;金属和玻璃器具直接放入170℃烘箱内连续烘烤12h以上。提取RNA所用药品均为RNA专用;2)取0.5g叶片,加液氮于研钵中研磨成粉末,将其转入已预冷的10mL离心管中,加入异硫氰酸胍提取缓冲液3mL、β-巯基乙醇200μL、4%可溶性PVP(W/W),剧烈摇匀;3)按顺序依次加入2 mol·L-1醋酸钠0.5mL,水饱和酚3mL,氯仿/异戊醇(24∶1)1mL,剧烈摇匀,在冰上放置20min;4)4℃,10 000r·min-1,离心20min,转上清液至一新10mL离心管中;5)加入等体积氯仿/异戊醇(24∶1),摇匀;6)转上清液至一新管,加入等体积异丙醇,-20℃下放置1h;7)4℃,10 000r·min-1离心20min,去上清,加入1.5mL异硫氰酸胍提取缓冲液和等体积异丙醇,混匀,-20℃下放置1h;8)4℃,10 000r·min-1,离心20min,去上清,用70%乙醇洗2次沉淀;9)把离心管置超净工作台上适当晾干,加适量DEPC处理水溶解沉淀;10)电泳、紫外分光光度计检测,分装,于-70℃冰箱中保存。
1.2.2 简并引物设计 参照GenBank所报道的番木瓜(Caricapapaya)[14]、杨树(Populustremula)[15]、柠檬、棉花(Gossypiumspp.)[16]等植物的Cu/Zn-SOD基因氨基酸的保守序列,设计一对简并引物。正向引物YCZ1序列:5′-GGWCCNACMACTGTDACTGGA-3′,反向引物序列YCZ2:5′-AARTCCAAYAARACCACAAGC-3′。
参照GenBank所报道的山茶、烟草[17]、洋橄榄[18]、拟南芥等植物的Mn/Fe-SOD基因氨基酸的保守序列,设计一对简并引物。正向引物YMF1序列:5′-CAGAARCAYCAYCARACNTAYGT-3′,反向引物序列YMF2:5′-RTARTANGCRTGYTCCCA-3′。所设计引物由Invitrogen公司合成。
1.2.3 总RNA反转录成cDNA 参照Invitrogen公司的M-MLV逆转录试剂盒说明书,合成第一链cDNA。
1.2.4 油茶Cu/Zn-SOD和Mn/Fe-SOD基因片段克隆 Cu/Zn-SOD和Mn/Fe-SOD基因片段克隆PCR反应体系均为50μL,包括10×Reaction buffer 5μL、Mg2+3.75μL、dNTPs(2.5mmol·L-1)4.5μL、正向引物(10μmol·L-1)1μL、反向引物(10μmol·L-1)1μL、cDNA 7.5μL、TaqDNA聚合酶(5U·μL-1)0.75μL、ddH2O 26.5μL。Cu/Zn-SOD基因克隆的PCR反应程序为:94℃5 min,94℃1min,45℃1min,72℃1min,扩增35个循环后,72℃10min,4℃保存扩增产物;Mn/Fe-SOD基因克隆的PCR反应程序为:94℃5 min,94℃1min,40℃1min,72℃1min,扩增35个循环后,72℃10min,4℃保存扩增产物。上述PCR产物经1.5%的琼脂糖电泳后,切下目的片段,经回收纯化后与T载体连接,转化到JM109大肠杆菌中,在LB/Amp/IPTG/X-gal平板上进行蓝白斑筛选,然后随机挑选经EcoRⅠ和HindⅢ酶切确认的重组质粒,送上海生工生物工程公司测序。将测序结果在NCBI网站上通过Blast n和Blast p进行序列的相似性分析,用DAMBE生物软件进行序列的比较分析。
2 结果
2.1 总RNA完整性检测 用紫外分光光度法测定油茶叶片总RNA的OD260/OD280和OD260/OD230比值,其中OD260/OD280=1.92,OD260/OD230= 2.05,电泳检测结果显示,28srRNA的亮度约为18srRNA的2倍(图1),说明提取的总RNA纯度高而且完整性好。
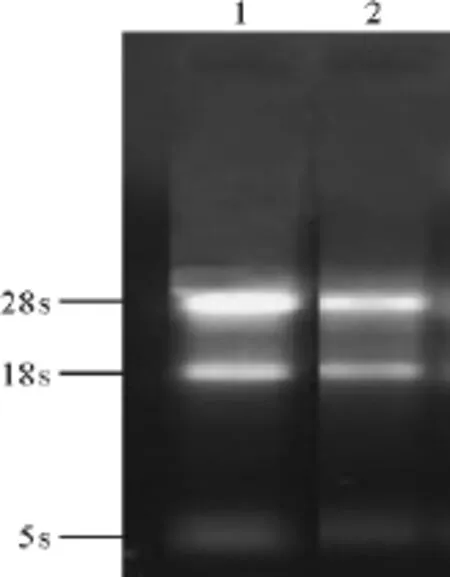
图1 油茶叶片总RNA琼脂糖凝胶电泳检测图Fig.1 The electrophoretic result of total RNAextraction inCamelliaoleifera’s leaf
2.2 PCR产物的分析 以cDNA为模板和已报道的多种植物的Cu/Zn-SOD、Mn/Fe-SOD基因序列设计的简并引物,经PCR扩增后,分别得到一条375和429bp的特异性条带(图2),命名为YCZ和YMF,经过双酶切鉴定后,证明YCZ和YMF均为所要克隆的目的基因片段(图3)。
2.3 序列分析和同源性比较
2.3.1 测序结果分析 序列分析结果表明,片段YCZ的cDNA序列长度为3 7 5bp,编码1 2 5个氨基酸;片段YMF的cDNA序列长度为429bp,编码143个氨基酸。克隆所得序列均已成功提交Gen-Bank,登录号分别为JN616272和JN616273。
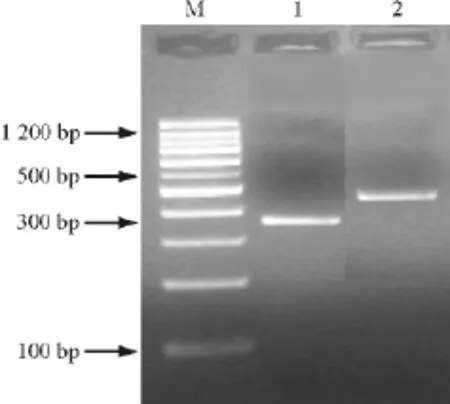
图2 油茶Cu/Zn-SOD和Mn/Fe-SOD基因片段的PCR产物电泳结果Fig.2 PCR products of Cu/Zn-SOD and Mn/Fe-SOD gene fragments inCamelliaoleifera
2.3.2 序列同源性分析 序列同源性分析结果(表1)表明,油茶Cu/Zn-SOD基因的核苷酸序列与其他多种植物的Cu/Zn-SOD基因核苷酸序列同源性较高,如与山茶、柠檬、陆地棉、车前、橡胶、杨梅、大黄、油菜、五色梅和拟南芥的同源性分别为92.5%、86.7%、86.1%、85.9%、85.9%、85.3%、82.9%、81.9%、81.3%和80.8%,与山茶科山茶属植物山茶的同源性高达92.5%,说明本试验所得序列正是油茶Cu/Zn-SOD基因的部分序列。使用DAMBE生物统计软件把克隆所得的油茶Cu/Zn-SOD基因的氨基酸序列与上述植物相比较,同源性均大于84%。比较结果表明,山茶科植物的Cu/Zn-SOD基因核苷酸序列在进化过程中变异幅度非常小。

图3 重组质粒的酶切电泳检测结果Fig.3 Detection by EcoRⅠand PstⅠdigestion for recombinant plasmid

表1 试验所得序列与其他植物Cu/Zn-SOD基因的核苷酸序列同源性比较Table 1 Sequences of cloning identity to other species of Cu/Zn-SOD gene
序列同源性分析结果(表2)表明,油茶Mn/Fe-SOD基因的核苷酸序列与其他多种植物的Mn/Fe-SOD基因核苷酸序列同源性较高,如与山茶、龙眼、金柑、三叶胶、桃、洋橄榄、五色梅、飞龙枳、番薯和烟草的同源性分别为92.5%、88.1%、86.3%、86.2%、86.0%、85.8%、84.8%、84.5%、84.4%和84.1%,与山茶科山茶属植物山茶的同源性高达92.5%,说明本试验所得序列正是油茶Mn/Fe-SOD基因的部分序列。使用DAMBE生物统计软件把克隆所得的油茶Mn/Fe-SOD基因的氨基酸序列与上述多种植物相比较,同源性均大于86%。比较结果表明,Mn/Fe-SOD的保守程度较高。
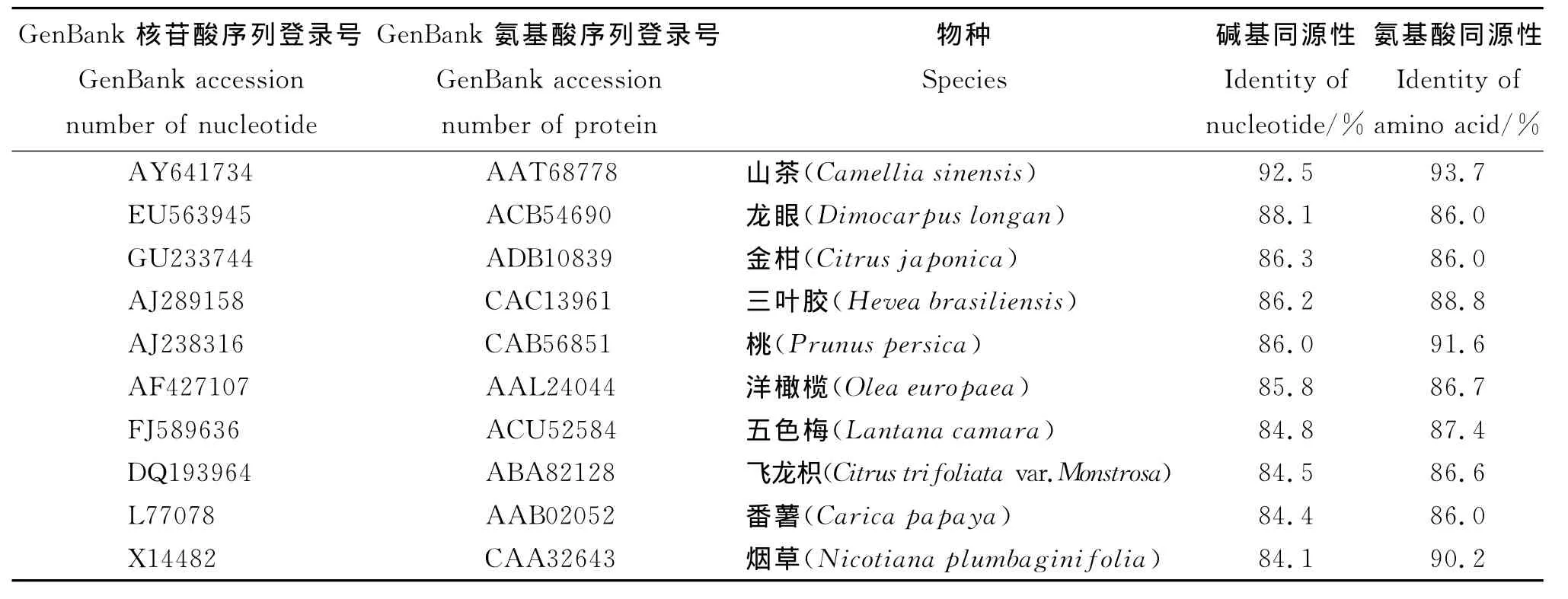
表2 试验所得序列与其他植物Mn/Fe-SOD基因的核苷酸序列同源性比较Table 2 Sequences of cloning identity to other species of Mn/Fe-SOD gene
3 讨论
SOD根据其酶活性中心辅基结合金属离子的不同,分为Cu/Zn-SOD、Mn/Fe-SOD和Fe-SOD。Cu/Zn-SOD基因与Mn/Fe-SOD基因、Fe-SOD基因分别来源于不同的祖先,而Mn-SOD基因和Fe-SOD基因来源于共同的祖先。陈淮杨和刘望夷[19]研究认为,Cu/Zn-SOD基因保守程度非常高,适合作为研究基因进化和物种分类的指标基因,但本研究克隆获得的油茶Mn/Fe-SOD基因片段与其他植物Mn/Fe-SOD基因核苷酸和氨基酸同源性在84.1%和86.0%以上,而油茶Cu/Zn-SOD基因片段与其他植物Cu/Zn-SOD基因核苷酸和氨基酸同源性在80.8%和81.6%以上,分析数据显示,油茶Mn/Fe-SOD基因较Cu/Zn-SOD基因更为保守。因此,是否可以用Mn/Fe-SOD基因替代Cu/Zn-SOD基因,作为研究油茶基因进化和品种分类指标基因,值得通过相关试验进一步验证。
植物细胞在正常代谢活动和逆境条件下均能产生活性氧,而SOD是清除植物体内活性氧的重要抗氧化酶之一。在逆境条件下,植物的抗性与植物体内能否维持较高的SOD活性水平密切相关。随着盐碱浓度的增大,紫花苜蓿(Medicagomativa)叶片SOD含量增加趋势显著[20];自然降温下,狗牙根(Cynodondactylon)SOD活性随着温度的降低,呈现出先增高后降低的趋势[21];在整个越冬期,高羊茅(Fesuca leata)SOD活性也呈现先增高后降低的趋势[22]。导致植物体内SOD活性高低的直接原因可能是SOD基因在植物体内的表达差异。因此,需要从基因水平研究SOD基因在油茶体内表达差异,从本质上阐明油茶抗逆性。
[1]Ma X J,Zhu D H.Functional roles of the plant superoxide dismutase[J].Hereditas,2003,25(2):225-231.
[2]Baum J A,Scandalios J G.Multiple genes controlling superoxide dismutase expression in maize[J].Journal of Heredity,1982,73(2):95-100.
[3]朱虹琳,董臣,刁英,等.莲铜锌超氧化物歧化酶cDNA的克隆和序列分析[J].武汉大学学报,2006,52(4):475-480.
[4]纪砚耘,化文平,王喆之.丹参铜锌超氧化物歧化酶(Cu/Zn-SOD)基因的克隆与生物信息学分析[J].陕西师范大学学报,2011,39(3):56-61.
[5]黄明.甘薯叶片超氧化物歧化酶基因克隆及测序[J].广西植物,1998,18(2):165-168.
[6]Ruiz-Lozano J M,Collados C,Barea J M,etal.Cloning of cDNAs encoding SODs from lettuce plants which show differential regulation by arbuscular mycorrhizal symbiosis and by drought stress[J].Journal of Experimental Botany,2001,52(364):2241-2242.
[7]庄瑞林.中国油茶[M].第二版.北京:中国林业出版社,2008.
[8]龙忠于,王玉娟,陈永忠,等.江西省油茶产业发展综述[J].湖南林业科技,2008,35(3):56-57.
[9]周国英,宋光桃,李河.油茶病虫害防治现状及应对措施[J].中南林业科技大学学报,2007,27(6):179-182.
[10]季冬明.油茶无公害栽培的有害生物防治技术[J].安徽农学通报,2006,12(5):20-24.
[11]张党权,谭晓风,谢禄山,等.油茶EST文库中不饱和脂肪酸合成关键酶基因的序列分析[J].经济林研究,2007,25(2):5-8.
[12]谭晓风,陈鸿鹏,张党权,等.油茶FAD2基因全长cDNA克隆及序列分析[J].林业科学,2008,44(3):16-21.
[13]张党权,谭晓风,陈鸿鹏.油茶油脂的生物合成及调控基因的特性[J].中南林业科技大学学报,2007,27(5):106-111.
[14]Lin M T,KuoT J,Lin C T.Molecular cloning of a cDNA encoding copper/zinc superoxide dismutase from papaya fruit and overexpression inEscherichiacoli[J].Journal of Agricultural and Food Chemistry,1998,46(1):344-348.
[15]Akkapeddi A S,Shin D I,Stanek M T,etal.cDNA and derived amino acid sequence of the chloroplastic copper/zinc-superoxide dismutase form aspen(Poplulustremuloides)[J].Plant Physiology,1994,106:1231-1232.
[16]Hu G H,Yu S X,Fan S L,etal.Cloning and expression of the chloroplast copper/zinc-superoxide dismutase gene in upland cotton(GossypiumhirsutumL.)[J].Journal of Plant Physiology and Molecular Biology,2007,33(3):197-204.
[17]高健,许晓风,陈学平.特异种质烟草HZNH的Fe-SOD基因的克隆与表达[J].中国生物化学与分子生物学报,2005,21(6):840-845.
[18]Francisco J C,Ana F O,Alfonso C,etal.The expression of different superoxide dismutase forms is celltype dependent in olive(OleaeuropaeaL.)leaves[J].Plant and Cell Physiology,2006,47(7):984-994.
[19]陈淮杨,刘望夷.从超氧化物歧化酶的分布和结构看其分子进化[J].生物化学与生物物理进展,1996,23(5):408-415.
[20]张永峰,殷波.混合盐胁迫对苗期紫花苜蓿抗氧化酶活性及丙二醛含量的影响[J].草业学报,2009,18(1):46-50.
[21]李秋丽,包满珠,王文恩.自然降温下4个狗牙根品种(系)的生理指标比较[J].草业科学,2011,28(3):404-409.
[22]潘冷,樊瑞萍,周琴,等.高羊茅越冬期叶片不同部位生理生化特性研究[J].草业科学,2010,27(7):5-9.
Cloning and sequence analysis of SOD gene of Camellia oleifera
GUO Chun-lan,ZHANG Lu
(College of Landscape and Art,Jiangxi Agricultural University,Nanchang 330045,China)
Two pairs of degenerate primers were designed based on the conservative regions in amino acids of Cu/Zn-SOD and Mn/Fe-SOD genes from other plants,respectively.Cu/Zn-SOD gene fragment and Mn/Fe-SOD gene fragment ofCamelliaoleiferawere cloned.Their sizes were 375bp and 429bp,respectively.By using the program of BLAST on NCBI GenBank database,two sequences presented a very high identity with Cu/Zn-SOD and Mn/Fe-SOD genes from other plants.The nucleotide sequences were analyzed by using program of DNAStar 5.0.125amino acids and 143amino acids were coded by the nucleotide sequences and the nucleotide sequences had the same conservative regions of Cu/Zn-SOD and Mn/Fe-SOD genes as many kinds of other plants.The homology comparison of nucleotide sequences of Cu/Zn-SOD gene and Mn/Fe-SOD gene showed the similarities of more than 80%and 84%to other plants,respectively.The similarities of amino acid sequences of Cu/Zn-SOD and Mn/Fe-SOD genes were more than 84%and 86%to other plants.
Camelliaoleifera;SOD;gene cloning;sequences analysis
ZHANG Lu E-mail:zhlu@163.com
S794.9;Q943.2
A
1001-0629(2012)03-0417-05
2011-10-16 接受日期:2011-12-02
国家科技部“十一五”科技支撑项目(2009BADB1B05-03)
郭春兰(1979-),女,江西泰和人,讲师,在读博士生,主要从事林木遗传育种研究。E-mail:lan151@126.com
张露 E-mail:zhlu@163.com
