扇贝糖原酶法提取及其硫酸化修饰条件
2012-09-18曹倩倩,朱蓓薇,杨静峰,宋叶涵,张元峰
曹 倩 倩,朱 蓓 薇,杨 静 峰,宋 叶 涵,张 元 峰
(1.大连工业大学 海洋食品教育部工程研究中心,辽宁 大连 116034;2.大连工业大学 农业部农产品加工技术研发贝类专业分中心,辽宁 大连 116034)
0 引言
硫酸酯多糖是一类糖羟基上带有硫酸根的多糖,与非硫酸酯多糖相比具有多方面的生物活性。硫酸酯化多糖除已证实具有抗凝血作用外,近年来不断发现还具有其他多种生物活性,如增强免疫功能、抗肿瘤、抗病毒等,因此,硫酸酯化多糖的研究也受到了极大的关注[1-2]。目前,各种植物多糖如香菇多糖、黄芪多糖、淫羊藿多糖等的硫酸化修饰的研究已经取得了一定的进展,对其硫酸化方法、硫酸酯的结构以及活性都进行了较深入的研究[3-5]。
然而,对动物多糖的硫酸化修饰方面的研究却未见报道。另外,目前的研究大都以结构复杂的多糖作为修饰物,在其构效关系方面的研究影响因素较多,不易阐明。因此,本文以扇贝糖原(scallop muscle glycogen,SMG)为研究对象,建立贝类动物糖原的硫酸化方法,糖原所具有的单纯结构为研究硫酸化修饰对多糖的多方面影响提供了有利的基础,也为贝类糖原的开发利用提供思路。通过对扇贝糖原硫酸化修饰条件的优化,以期得到最佳工艺条件,为研究其活性及其构效关系奠定基础。
1 材料与方法
1.1 材 料
新鲜虾夷扇贝,购于大连市春柳市场;胃蛋白酶,分析纯,上海生工生物工程有限公司;明胶,优级纯,上海生工生物工程有限公司;其他试剂均为国产分析纯。
1.2 主要仪器
Agilent 6890N 型气相色谱仪,Agilent公司;傅里叶变换红外光谱仪SPECTRUM ONE-B,Perkin Elmer公司;T6紫外可见分光光度计,北京普析通用仪器有限责任公司;LG-1.0真空冷冻干燥机,沈阳航天新阳速冻设备制造有限公司。
1.3 试验方法
1.3.1 扇贝糖原的制备
将新鲜的虾夷扇贝取贝柱洗净,冷冻干燥,粉碎。用胃蛋白酶酶解样品提取糖原,酶解条件为:料液比1∶30(g/mL),加酶量为底物质量的2.0%,pH 2.0,温度37 ℃,酶解时间为2h。酶解液经4 000r/min离心10min,取上清液加入3倍体积95% 乙醇,醇沉过夜。醇沉液离心(4 000r/min,10min)后,收集沉淀,加少量去离子水使其复溶、离心,上清液冻干得扇贝粗糖原。
采用木瓜蛋白酶结合Sevag法除蛋白,直到无游离蛋白出现为止,收集上清液。装入截留分子质量为7ku透析袋内,流动水透析24h,去离子水透析24h。反复冻融至离心无沉淀出现,冷冻干燥后得扇贝糖原,贮存备用。
1.3.2 扇贝糖原的单糖组成分析
依照文献[6]的方法对扇贝糖原进行水解和乙酰化,使用气相色谱进行单糖组成分析。
1.3.3 扇贝糖原的红外光谱分析
以m(样品)∶m(KBr)=1∶100的比例混合研细后,以KBr为本底,在4 000~400cm-1扫描红外吸收。
1.3.4 糖含量及硫酸根含量检测
糖含量检测:采用苯酚-硫酸法[7]进行检测。
硫酸根含量检测:采用氯化钡-明胶法[8]进行检测。硫酸取代度公式为

1.3.5 扇贝糖原的硫酸酯化方法
扇贝糖原的硫酸酯化采用氯磺酸-吡啶法[5]。将25mL无水吡啶加入三颈烧瓶置冰盐浴中,按设定的氯磺酸-吡啶体积比边搅拌边逐滴加入氯磺酸,于40 min 内加完。称取一定量的扇贝糖原,溶于20mL N,N-二甲基甲酰胺中,充分搅匀后,加入装有酯化试剂的三颈烧瓶中,按设定的水浴温度和反应时间搅拌反应。反应结束后中和至pH 7.0,醇沉,离心取沉淀。复溶于水,透析,冷冻干燥得扇贝糖原硫酸酯(sulfated scallop muscle glycogen,SSMG)。
1.3.6 酯化试剂对扇贝糖原硫酸化修饰的影响
称取200mg样品,按照“1.3.5”的方法,调节氯磺酸与吡啶的体积比为1∶4、1∶5、1∶6、1∶7、1∶8,将反应温度和反应时间分别固定在60 ℃和2h,测定DS和糖含量。
1.3.7 反应温度对扇贝糖原硫酸化修饰的影响
称取200mg样品,按照“1.3.5”的方法,调节反应温度为50、60、70、80、90℃,将氯磺酸与吡啶的体积比固定为1∶5,反应时间固定为2h,测定DS和糖含量。
1.3.8 反应时间对扇贝糖原硫酸化修饰的影响
称取200mg样品,按照“1.3.5”的方法,调节反应时间为1、2、3、4、5h,将氯磺酸与吡啶的体积比固定为1∶5,反应温度固定为70 ℃,测定DS和糖含量。
1.3.9 扇贝糖原硫酸化修饰条件的确定
在单因素试验的基础上,选出最佳试验条件,采用正交试验法确定扇贝糖原硫酸酯化的工艺条件。称取500mg 样品,按照氯磺酸与吡啶的体积比、反应温度和反应时间作三因素三水平L9(33)正交试验,结果见表1。

表1 正交试验因素水平表Tab.1 The factors and levels of orthogonal experiment
2 结果与讨论
2.1 扇贝糖原的提取及单糖组成
扇贝贝柱干粉经过胃蛋白酶提取及除蛋白步骤,扇贝糖原的得率为13.78%,其中糖质量分数为91.62%,蛋白质质量分数仅为1.4%。
扇贝糖原经酸水解后,其乙酰化衍生物的气相色谱分析结果见图1。图1 中只出现两个峰,与标准单糖的保留时间相比,除内标肌醇外,其中只含葡萄糖。由此可知其基本组成仅为葡萄糖,为典型的糖原单糖组成特征。

图1 扇贝糖原单糖组成的气相色谱图Fig.1 GC analysis of monosaccharide composition of SMG
2.2 扇贝糖原及其硫酸酯的红外光谱分析
对比扇贝糖原和扇贝糖原硫酸酯的红外光谱可知(图2),两者均表现出一些糖的特征性吸收峰:在3 444cm-1附近有一强且宽的吸收峰,表明有糖上的O—H 键伸缩振动;1 022cm-1附近有强吸收,表示有糖上的O—H 键变角振动。所不同之处在于糖原经过硫酸酯化修饰后SSMG 在1 228cm-1出现一个强的吸收峰,为 S==O 伸缩振动的特征吸收峰;在800~1 000cm-1附近有一组C—O—S伸缩振动吸收峰[7]。红外光谱分析表明扇贝糖原经过硫酸酯化修饰后其糖基已经被硫酸基所修饰表现出特有的硫酸基修饰信号峰。

图2 扇贝糖原及其硫酸酯的红外光谱图Fig.2 IR spectrum of SMG and SSMG
2.3 扇贝糖原硫酸酯化反应单因素的确定
2.3.1 酯化试剂对扇贝糖原硫酸化修饰的影响
由表2可以看出,当反应温度和反应时间确定的情况下,DS的大小随着氯磺酸与吡啶的体积比的增大有起伏变化,在体积比为1∶5时,DS最高;糖质量分数随着氯磺酸与吡啶的体积比的增大变化不是很大。主要是因为氯磺酸属于强酸性物质,随着体积比的增加对糖原糖链的降解作用增强。
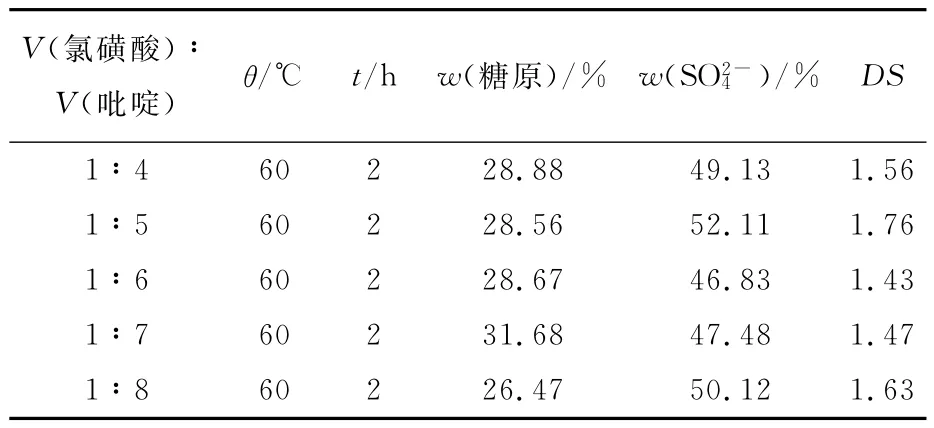
表2 酯化试剂比例对硫酸化修饰的影响Tab.2 Effects of reagent proportion on the sulfating modification
2.3.2 反应温度对扇贝糖原硫酸化修饰的影响
由表3可以看出,当酯化试剂体积比和反应时间确定的情况下,DS的大小随着反应温度的升高起伏较大,在70 ℃时DS最大。糖质量分数随着反应温度的增加,有所减小但相差不大。因为扇贝糖原在高温的酸性环境下容易降解,硫酸化程度高。

表3 反应温度对硫酸化修饰的影响Tab.3 Effects of reaction temperature on the sulfating modification
2.3.3 反应时间对扇贝糖原硫酸化修饰的影响
由表4可以看出,当酯化试剂体积比和反应温度确定的情况下,DS的大小随着反应时间的增加呈现明显的先增大后减小的趋势,在反应时间为3h时DS出现峰值为1.81;糖质量分数随着时间的增大,变化趋势不是很明显。可见反应时间对糖分解的影响不是很大。主要是随着反应时间的增加,酯化试剂与糖原的反应越完全,取代度越大。
2.4 扇贝糖原硫酸酯化工艺条件优化结果与分析
以单因素试验结果为依据进行三因素三水平的正交试验(表1)。正交试验所得的硫酸根取代度与糖质量分数结果及其极差分析(表5)。

表4 反应时间对硫酸化修饰的影响Tab.4 Effects of reaction time on the sulfating modification
从表5的极差分析可以看出,对于以取代度为指标来说,因素影响程度大小为B>A>C,反应温度因素的极差最大为0.63,即说明反应温度对硫酸化试验的影响最大,氯磺酸与吡啶的体积比次之为0.62,反应时间的影响最小为0.56。各因素的取代度极差分析表明,氯磺酸与吡啶的体积比的取代度极差最大为k2(1.59),反应温度的取代度极差最大为k1(1.64),反应时间的取代度极差最大为k2(1.61),所以扇贝糖原硫酸化反应条件的最佳组合为A2B1C2,即最佳试验条件为氯磺酸与吡啶的体积比为1∶5,反应温度为60 ℃,反应时间为3h。

表5 硫酸酯化工艺条件优化结果Tab.5 The result of optimization sulfated factor
3 结论
(1)采用胃蛋白酶提取扇贝糖原,其得率为13.78%,其中糖质量分数为91.62%,蛋白质质量分数为1.4%。
(2)红外光谱分析表明,硫酸基与扇贝糖原形成硫酸酯化合物,采取氯磺酸-吡啶法对扇贝糖原进行硫酸化效果较好。
(3)扇贝糖原硫酸化修饰的最佳条件为:氯磺酸与吡啶的体积比为1∶5,反应温度为60 ℃,反应时间为3h。
