文心兰原球茎生长和分化过程中酶活性和可溶性蛋白的变化
2012-09-18尤海波
尤海波
(黑龙江省农科院园艺分院,哈尔滨150069)
在离体培养过程中,自Galston等[9]1969年最早研究烟草髓部愈伤组织的分化与过氧化物同工酶的关系以来,人们在这一领域进行了许多研究,发现外植体的生长、脱分化、分化与过氧化物酶活性、可溶性蛋白含 量 及其 同 工 酶 等 的 变 化 有 关[5-6,8,12]。 但 是 这 些 研 究主要集中于器官发生途径和体胚发生途径。原球茎(Protocorm-like bodies,简称PLBs)作为兰科植物的一种特殊再生方式,在其形态发生过程中以上物质必然有其特定的代谢与变化规律。本试验研究了文心兰原球茎分化芽和根系过程中抗坏血酸过氧化物酶(APX)、愈创木酚过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和多酚氧化酶(PPO)活性以及可溶性蛋白含量的变化,为研究原球茎的生长或分化机理提供基础资料。
1 材料与方法
1.1 实验材料与处理
黑龙江省农科院园艺分院组织培养中心培养的文心兰(Dendrobium officinale)原球茎,经两次继代培养达到生长旺盛状态时,再挑选处于同一生长时期、没有分化的原球茎转入培养基1/2MS+BA5+NAA 0.3,每瓶均转入上述原球茎10g,每个处理各5瓶。培养基pH5.6~5.8,培养温度(25±1)℃,每日光照12 h,光照强度1600~2500lx,分别与接种后的0d、7d、14d、21d、28d取样,进行生理指标的测定(每个试验重复3次)。
1.2 实验方法
1.2.1 酶液制备及酶活性测定。分别准确称取不同生长时期的原球茎及不定芽新鲜材料0.3g,冰浴研磨,加入 PBS(pH7.8)缓冲液1.6mL,充分混匀,12000r/min离心30min,立即取上清液测定。可溶性蛋白质含量测定采用考马斯亮蓝G-250比色法[7];POD活性测定采用氧化愈创木酚法[2],以每分钟每单位质量吸光度值的变化表示(ΔOD·mg-1FW·min-1);CAT活性采用过氧化氢氧化法测定[2],以每分钟OD值减少0.01为一个酶活性单位(U·g-1FW·min-1);SOD活性测定采用 NBT光还原法[2],以抑制NBT光化还原50%的酶量为一个酶活性单位(U·g-1FW)。上述实验均重复3次。
1.2.2 可溶性糖含量测定。分别准确称取不同发生时期的原球茎及不定芽的新鲜材料0.3g,剪碎,放入20mL刻度试管中,加5mL去离子水,管口封膜,沸水浴10min,流水冷却,过滤至25mL容量瓶中,反复漂洗残渣及试管,蒸馏水定容至刻度。采用蒽酮比色法[2]测定可溶性糖含量。实验重复3次。
2 结果与分析
2.1 文心兰原球茎不同发育时期酶活性变化

图1 文心兰原球茎不同发育时期APX变化

图2 文心兰原球茎不同发育时期POD活性变化
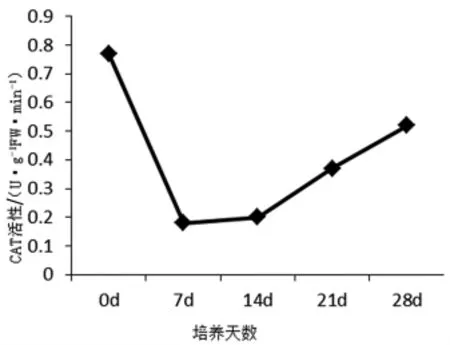
图3 文心兰原球茎不同发育时期CAT活性变化

图4 文心兰原球茎不同发育时期SOD活性变化
如图1~图4所示,在原球茎分化芽的过程中,APX、POD的活性均急剧下降,随着芽的继续生长,APX和POD的活性继续降低;根系一旦被诱导,又呈上升趋势,但活性均低于类原球茎期的水平;而CAT的活性在PLB分化芽后降到最低水平,随着芽的生长活性缓慢升高,在根分化完成后活性再略有升高,变化趋势与APX和POD大致相同。SOD与APX、POD、CAT的活性变化则呈现完全相反的变化趋势。在类原球茎时期处于相对较高的水平,芽的分化伴随SOD活性的增强,但随根的分化和生长,活性呈现接近直线降低的趋势,在根继续生长时,SOD的活性接近于0。
2.2 多酚氧化酶(PPO)活性的变化
如图5所示,在类原球茎分化芽的过程中,PPO的活性呈明显的下降趋势。在芽不断生长的过程中,活性继续降低,生根前降到最低,生根后活性回升,且随根系伸长,酶活性继续增强。

图5 文心兰原球茎不同生长时期PPO活性的变化
2.3 可溶性糖和可溶性蛋白质含量变化

图6 文心兰原球茎不同生长阶段可溶性糖含量的变化

图7 文心兰原球茎不同生长阶段可溶性蛋白含量的变化
图6显示,文心兰原球茎可溶性糖含量在其发生过程中总体呈现先升高后降低的变化趋势,并在根生成时达到最大值,文心兰原球茎可溶性糖在芽和根的分化时期累积较多,并在根生长期出现最大峰值,这为细胞连续分裂和发育提供了物质和能量基础,也为原球茎分化为幼苗提供物质和能量储备。
由图7可知,在文心兰原球茎发生过程中,其可溶性蛋白质含量芽分化期急剧增加,在根形成期达到最大值。芽生长期和根形成期的可溶性蛋白质含量差异不显著。从整个培养过程来看,芽和根形成期可溶性蛋白质含量急剧升高,这表明在原球茎分化初期,原球茎需要合成大量蛋白质来启动芽的发生;而根形成期可溶性蛋白质累积较多,这为苗的进一步发育提供了物质基础。
3 讨论
原球茎是许多兰科花卉最重要的离体无性繁殖的中间体,对其生长和分化的调控是兰花试管无性繁殖研究的重要内容。已有的大量研究均是围绕着外部因子,如培养基的成分和激素组合等开展,而对原球茎整个生长和分化过程中内在的生理生化变化的研究却未见有系统的报道。
本试验表明,原球茎分化芽的过程中,APX、POD、CAT和PPO的活性均呈急剧下降,在根发生后逐渐回升。刘玉艳等研究表明[3],POD和PPO活性下降直接或间接调控IAA的水平,促进根原基的发生;而根原基发生后POD和PPO的活性又有所提高,可能与生根辅助因子“IAA-酚酸复合物”的产生、H2O2参与细胞壁形成、木质素单体的聚合有关。由于POD和PPO的活性变化均早于根的形态发生,一方面说明根发生的生理生化变化先于形态发生,另一方面也证实了POD和PPO是诱导根原基产生的关键性酶,可以作为鉴定根形态发生与否及生根难易的重要的生理指标[7,11]。
从可溶性蛋白的含量变化过氧化物酶同工酶具有调节植物内源激素IAA合成的功能[9]。在苹果、猕猴桃等植物上的研究已表明,不定芽分化和根的发生与过氧化物酶(POD)活性及过氧化物酶同工酶的变化密切相关[4,10]。在本试验也证实了过氧化物酶同工酶在类原球茎分化芽和根的过程中存在明显的变化。表明有可能通过在培养基中有针对性地添加该类酶的促进或抑制剂来调控类原球茎的生长或分化,使石斛兰的试管繁殖的各个环节有序地展开。
[1] 侯大强,柴明良,庄晓英.春石解兰类原球茎分化过程中抗氧化酶活性和可溶性蛋白的变化[J].核农学报,2006,20(3):248-251.
[2] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[3] 刘玉艳,于凤鸣,于娟.IBA对含笑扦插生根影响初探[J].河北农业大学学报,2003,26(2):25-29.
[4] 马锋旺,李嘉瑞.苹果新梢离体不定根形成期间某些生理变化的研究[J].西北农业学报,1995,4(1):80-83.
[5] 田敏,韩凝,边红武,等.草莓愈伤组织再生能力与活性氧代谢水平相关性研究[J].园艺学报,2004,31(3):372-374.
[6] 庄东红,杜虹.大白菜子叶培养过程中POD同工酶和可溶性蛋白质含量的变化[J].汕头大学学报(自然科学版),2002,17(1):64-73.
[7] 张超,王广东.文心兰原球茎形态发生与可溶性物质及抗氧化酶的关系[J].西北植物学报,2009,29(8):1607-1613.
[8] Chandru H K,Kim E,Kuk Y,et al.Kinetics of wound-induced activation of antioxidative enzymes in-Oryza sativa:differential activationat different growth stages[J].Plant Sci,2003,164:935-941.
[9] Galston A W,Davies P J.Hormonal regulation in higher plants[J].Science,1969,163(873):1288-1297.
[10] Gasper T,Penel C,Castillo F J.A two step control of basic acidic peroxidases and its significance for growth and development[J].Physiol.Plant,1985,64:418-424.
[11] Hausman O B,Potter J R.Rooting of apple,Rhododendron,andmountainlaurelcutting from stockplants etiolated under two temperatures[J].Hortscience,1997,32(2):304-306.
[12] Rajguru S N,Banks S W,Gossett D R,et al.Antioxidant response to salt stress during fiber development in cotton ovules[J].The Journal of Cotton Science,1999,3:11-18.
[13] Tang W,HarrisL C,Outhavong V,et al.Antioxidants enhance in vitro plant regeneration by inhibitingthe accumulation of peroxidase inVirginia pine(Pinus virginianaMill)[J].Plant Cell Rep,2004,22:871-877.
