22株耐亚胺培南肠杆菌科细菌KPC酶及整合子分布
2012-09-18陶月宁明哲张葵张之烽
陶月 宁明哲 张葵 张之烽
22株耐亚胺培南肠杆菌科细菌KPC酶及整合子分布
陶月 宁明哲 张葵 张之烽
目的了解耐亚胺培南的肠杆菌科细菌KPC酶(klebsiella pneumoniae carbapenemase)及整合子分布情况。方法收集南京市鼓楼医院22株耐亚胺培南的肠杆菌科细菌,进行改良Hodge试验,PCR扩增检测细菌KPC酶与整合子基因并行序列分析。结果22株肠杆菌科细菌中,改良Hodge试验阳性15株(68.2%),KPC酶扩增阳性15株(68.2%),整合子PCR扩增阳性6株(27.3%)。结论KPC酶的流行需引起实验室及临床的关注。
肠杆菌科细菌KPC酶整合子
碳青霉烯类药物是临床治疗革兰阴性杆菌感染的最有效药物之一,它可用于治疗产超广谱β-内酰胺酶(ESBLs)及AmpC酶等多重耐药菌引起的感染,包括亚胺培南、美罗培南和厄他培南等。但随着其广泛使用,耐药菌株也随之出现。先是在鲍曼不动杆菌、铜绿假单胞菌等非发酵菌中出现对碳青霉烯类药物耐药的细菌,而产KPC酶的肺炎克雷伯菌于2001年在美国北卡罗来纳州首次被发现,之后数年间,产KPC酶菌株已在美国各州蔓延,且在多种肠杆菌科细菌中均有报道[1]。2010年4月,笔者医院首次检出出现耐亚胺培南的肺炎克雷伯菌,至2011年6月共出现22株耐亚胺培南的肠杆菌科细菌。现对该22株菌进行改良Hodge实验、KPC酶及整合子基因检测。
材料与方法
1.菌株来源:收集南京市鼓楼医院2010年4月~2011年4月临床分离的耐亚胺培南的肠杆菌科细菌共22株。
2.鉴定方法:全部菌株均使用法国生物-梅里埃公司ATB鉴定系统进行鉴定。质控菌株为大肠杆菌ATCC25922,金黄色葡萄球菌ATCC25923,铜绿假单胞菌ATCC27853。
3.药敏试验:细菌采用纸片扩散(K-B)法,结果按CLSI2010年版标准判定。药敏纸片均购自英国Oxiod公司。质控菌的试验结果均在CLSI规定范围内。
4.试剂:PCR引物由上海英骏生物技术有限公司合成,Taq酶购自日本Takara公司,凝胶成像系统(美国Bio-Rad公司),普通DNA产物纯化试剂盒(北京天根生化科技有限公司)。
5.改良Hodge试验:将0.5麦氏浊度单位的大肠杆菌ATCC25922菌液均匀涂布在MH平板上,中间贴美罗培南(10μg)纸片,将实验菌株以美罗培南纸片为起点,用无菌接种环自纸片外缘向平板边缘以离心方向划线,以肺炎克雷伯菌ATCC1705为阳性对照,肺炎克雷伯菌ATCC1706为阴性对照,35℃培养16~18h后观察结果,美罗培南抑菌圈内出现待检菌矢状生长者为阳性。阳性表明产KPC酶,见图1。

图1 改良Hodge实验结果
6.耐药基因检测:(1)模板和引物:加热煮沸法制备DNA模板,参考文献合成KPC酶基因引物,引物F:5'-GCTACACCTAGCTCCACCTTC-3';引物R:5'-ACAGTGGTTGGTAATCCATGC-3'。根据文献设计可同时检测Ⅰ类、Ⅱ类和Ⅲ类整合子的整合酶基因(intI1、intI2和intI3)的简并引物,引物1:5'-TGCGGGTYAARGATBTKGATTT-3';引物2:5'-CARCACATGCGTRTA RAT-3'[2~4]。(2)耐药基因PCR:KPC酶50μl反应体系含10×PCR Buffer 5μl,Mg2+4μl,dNTP (2.5mmol/L)4μl,TaqDNA聚合酶0.5μl,引物各1μl (10μmol/L),DNA模板2μl,灭菌双蒸水补足体积。反应条件:94℃预变性5min;94℃45s、55℃40s、72℃70s,共35个循环;72℃延伸5min。目的条带920bp。整合酶25μl反应体系含10×PCR Buffer 2.5μl,Mg2+2.5μl,dNTP(2.5mmol/L)2μl,TaqDNA聚合酶0.5μl,引物各1μl(10μmol/L),DNA模板2μl,灭菌双蒸水补足体积。反应条件:95℃预变性5min;94℃30s、50℃40s、72℃40s,共35个循环;72℃延伸10min。目的条带491bp。PCR扩增产物经1.5%琼脂糖凝胶电泳120V 20min,凝胶成像系统成像,观察记录结果。阳性产物经纯化后用HITACHI 3130测序仪测序,所得DNA序列用BLAST程序与GenBank中的NR数据库进行在线比对。
结果
1.菌株构成:收集的22株待检菌中,有肺炎克雷伯菌14株(63.6%),大肠杆菌5株(22.8%),产酸克雷伯菌、阴沟肠杆菌、产气肠杆菌各1株(各占4.5%)。
2.实验结果:22株待检菌中,改良Hodge实验阳性菌有15例(68.2%),KPC基因检测阳性有15例(68.2%),整合子检测阳性有6例(27.3%)。KPC扩增产物进行测序比对,均为KPC-2型(图2)。15株肺炎克雷伯菌中,改良Hodge实验与KPC基因检测阳性菌有12例(80.0%),整合子检测阳性有4例(26.7%)。其他7株肠杆菌科细菌中,改良Hodge实验与KPC基因检测阳性有3例(20.0%),整合子检测阳性有2例(28.6%,图3~图4及表1~表3)。

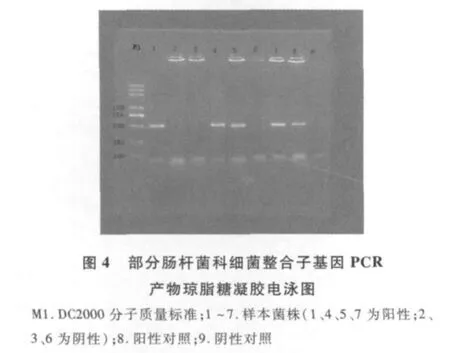

表1 22株待检菌检测结果

表2 15株肺炎克雷伯菌改良Hodge实验、KPC酶、整合子检测结果分类
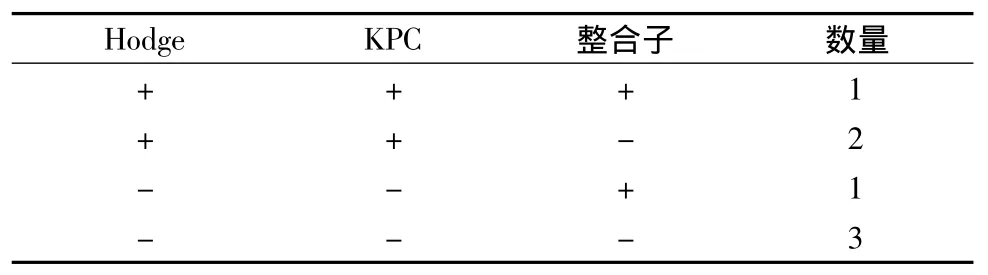
表3 其他7株肠杆菌科细菌改良Hodge实验、KPC酶、整合子检测结果分类
经卡方检验,22株待检菌中,KPC与整合子基因检测有明显差异(χ2=7.37,P<0.01),改良Hodge实验和KPC酶基因检测符合率为100%。而在15株肺炎克雷伯菌中KPC阳性12例(80.0%),7株其他肠杆菌科细菌中KPC阳性3株(42.9%),KPC阳性率在肺炎克雷伯菌与其他肠杆菌科细菌中没有明显差异(χ2=1.56,P>0.05)。
讨论
肠杆菌科细菌对碳青霉烯类抗生素耐药最主要的机制是产生碳氢酶烯酶,以KPC酶为主。此酶可水解青霉素类、头孢菌素类、单酰胺类和碳氢酶烯类抗生素。这种活性可被克拉维酸和他唑巴坦所抑制,但对EDTA不敏感。目前已发现的KPC型酶已有11种,分别从KPC-1型至KPC-11型酶[3]。据相关文献报道,中国地区均以KPC-2型检出率较高,国内先后分离到产KPC-2型肺炎克雷伯菌,大肠杆菌,黏质沙雷菌[4~6]。本研究中,共检测到15株菌产KPC酶,经测序亦均为KPC-2型。
2009年CLSI提出用改良Hodge实验作为检测碳氢酶烯酶的筛选实验。本实验中,改良Hodge实验与KPC-PCR检测结果完全吻合,未出现假阳性和假阴性。这次检测的22株细菌均为对亚胺培南耐药的肠杆菌科细菌,未出现中介,使得改良Hodge实验准确度提高[7]。整合子是抗生素耐药基因的重要存储库,在细菌多重耐药机制中发挥重要作用[8]。本实验中,整合子检出率较低,可见整合子在耐碳青霉烯过程中并非其主要作用。本实验耐碳青霉稀类的肠杆菌科细菌中,KPC酶检测仍有7株为阴性,其中2株为整合子检测阳性,余下5株可能与其他耐药机制相关:①外膜蛋白丢失合并AmpC等酶高产[9];②药物作用靶位的改变;③产生其他碳青霉烯酶,如IMP等。KPC酶的出现给肠杆菌科细菌感染的治疗带来不小的困难。如何防止其流行,加强对其监测,是临床和实验室共同关注的目标。
1Yigit H,Queenan AM,Anderson GJ,et al.Novel carbapenem-hydrolyzing beta-lactamase,KPC-1,from a carbapenem-resistant strain of Klebsiella pneumoniae[J].Antimicrob Agents Chemother,2001,45 (4):1151-1161
2Bell JM,Turnidge JD,Wiedemann B.Role of pencillin-binding proteins in the initiation of the AmpC β-lactamase-producing Enterobacter cloacae in the Asia-Pacific region:results from the STNTRY Antimicrobial Surveillance Program,1998 to 2001[J].Antimicrob A-gents Chemother,2003,47:3989-3993
3胡付品,朱德妹.KPC型碳氢酶烯酶研究进展[J].中国感染与化疗杂志,2011,11(1):76-80
4张幸国,杜小幸,张嵘,等.发现一株产KPC-2型碳青霉稀酶肺炎克雷伯菌[J].中华检验医学杂志,2006,29(9):824-826
5WeiZQ,Du XX,Yu YS,et al.Plasmid-mediated KPC-2 in a klebsiella pneumoniae isolate from China[J].Antimicrob Agents Chemother,2007,51(2):763-765
6Cai JC,Zhou HW,Zhang R,et al.Emergence of Serratia marcescens,klebsiella pneumoniae,and escherichia coli isolates possessing the plasmid-mediated carbapenem-hydrolyzing beta-lactamase KPC-2 in intensive care units of a Chinese hospital[J]Antimicrob Agents Chemother,2008 Jun,52(6):2014-2018
7施德仕,邵海枫,王卫萍,等.用改良Hodge实验筛查低产碳氢酶烯酶肠杆菌科细菌[J].临床检验杂志,2010,28(11):455-457
8Labbate M,Case RJ,Stokes HW.The integron gene cassette system: an active player in bacterial adaptation[J].2009,532(2):103-125
9李轶,张嵘,周宏伟,等.亚胺培南耐药大肠埃希菌的耐药机制研究[J].中华检验医学杂志,2008,31(10):1167-1169
(收稿:2011-11-26)
(修回:2011-12-16)
Distribution of KPC and Integrons in 22 Imipenem-resistant Enterobacteriaceae.
Tao Yue,Ning Mingzhe,Zhang Kui,Zhang Zhifeng.Department of Clinical Laboratory,Drum Tower Hospital of Nanjing,Jiangsu 210008,China
ObjectiveTo investigate the distribution of KPC and integrons in imipenem-resistant Enterobacteriaceae.Methods We modified Hodge test and PCR amplification for 22 imipenem-resistant Enterobacteriaceae from Nanjing Drum Tower Hospital,detected KPC and integron of bacterial and did sequence analysis.ResultsIn 22 Enterobacteriaceae,15 strains(68.2%)were positive in the modified Hodge,15 strains(68.2%)were positive in KPC amplification,6 strains(27.3%)were positive in PCR amplification of integron.ConclusionKPC Shold be paid attention as it may to cause the prevalence of laboratory and clinical attention.
Enterobacteriaceae;KPC;Integron
南京市卫生局资助项目(YKK09115)
210008南京市鼓楼医院检验科
张葵,电子信箱:zkangkui@yahoo.com.cn
