DPD为底物评价Fe3O4纳米粒子分解H2O2的催化活性
2012-09-17王宇
王 宇
(“光电带隙材料”省部共建教育部重点实验室,哈尔滨师范大学)
0 引言
过氧化氢在环境化学和生物医学中是很重要的一种活性中间体,其浓度的检测在化学分析、环境分析及生物分析等领域都有着重要的研究意义[1].目前,过氧化氢的检测方法有很多,例如,分光光度法[2-4]、荧光分析法[5]、电分析法[6]和化学发光法[7-8]等.
Bader于1988年提出了DPD法测量水中低浓度H2O2的研究结果[9].与其他分光光度法相比,DPD方法精度高、所需测量仪器简单、检出限低,一经提出就得到了广泛应用[10].基本原理是,如果溶液中有 H2O2存在,HRP催化氧化H2O2生成的产物会立即将DPD氧化成阳性离子基 DPD·+,DPD·+是一种粉红色的化合物,它有两个吸收峰,510 nm和551 nm处,通过测551 nm处的吸光度值,可计算溶液中H2O2浓度.
上述提到的DPD法是要依靠于HRP(过氧化物酶—辣根)的催化反应.但作为天然酶,HRP价格昂贵,不易长期保存,且容易失活.因此,寻找人工合成的类过氧化物酶引起了研究者的关注.
Fe3O4纳米粒子因特殊的理化性质,已在化学物质检测[11]、环境治理[12]、电传感器[13]等领域有着重要的应用价值.2007年,阎锡蕴课题组首次发现Fe3O4磁性纳米粒子具有类过氧化物酶的催化活性[14].与HRP相比,Fe3O4磁性纳米粒子稳定性更具优势.因此,该文以 Fe3O4磁性纳米粒子替代 HRP,采用 DPD为底物,评价H2O2的分解程度,并检测过氧化氢的浓度.
1 实验部分
1.1 试剂与仪器
氯化亚铁(FeCl2·4H2O)、三氯化铁(FeCl3·6H2O)、氢氧化钠(NaOH)、过氧化氢(30%)、pH=6磷酸盐缓冲液和pH=4.5醋酸盐缓冲液(天津市科密欧化学试剂开发中心),N,N-二乙基对苯二胺(DPD,上海源叶生物科技有限公司),过氧化物酶—辣根(HRP,上海源叶生物科技有限公司).
紫外可见分光光度计(Lambda 45,美国Perkin Elmer公司);粉末X射线衍射仪(D8 Advance,德国布鲁克光谱仪器公司).
1.2 Fe3O4纳米粒子的制备
采用化学共沉淀法制备Fe3O4纳米粒子,制备温度分别为室温(RT)、60℃、100℃、140℃,经过高速离心、筛分[15],标记为 CP-Fe3O4,将CP-Fe3O4粒子分散在蒸馏水中,并在140℃进行回流处理,得到 Fe3O4磁流体,标记为 FFFe3O4.
1.3 晶相结构分析
采用X射线衍射仪分析样品的晶相结构,测试条件:CuKα靶,电压40 kV,电流40 mA,扫描范围 20°-90°,样品的平均粒径根据 Sherrer公式计算.
1.4 对底物DPD的酶促动力学表观参数测定
取0.1 g DPD,溶于0.05 mol/L N H2SO4中,密封、避 光,5℃下保存.
取 5 mL 醋酸钠缓冲液(pH=4.5),0.2 mL H2O2,加入10 mg Fe3O4纳米粒子,为得到线性回归方程,分别加入不同量 DPD(5 μL,10 μL,50 μL,0.1 mL,0.5 mL,1 mL),搅拌,充分反应5 min后,磁分,取上清液,测551 nm处的紫外可见吸光度值,10 s后再测一次.两次测量差值,由计算即得到不同DPD浓度下对应的反应速度v.然后以DPD浓度的倒数为横坐标,以反应速度v的倒数为纵坐标作Lineweaver-Burk双倒数图,直线与x轴的截距为1/Km的绝对值,y轴的截距是1/vmax值[16],Km米氏常数,属于酶的特征常数,此处代表Fe3O4纳米粒子与底物DPD亲和力的大小,Km值越小,表明Fe3O4纳米粒子与DPD的亲和力越高.
1.5 溶液中H2O2浓度的检测
取50 mL 蒸馏水,60 μL 30%H2O2,加入3 mL磷酸盐缓冲液(pH=6),搅拌均匀,加入50 μL DPD,10 mg Fe3O4纳米粒子,搅拌 2 min,再将Fe3O4纳米粒子磁分,取上清液,在450~600 nm范围内测紫外可见连续光谱.根据551 nm处吸光度通过公式[H2O2]=,计算各样品中HO的分解量.其22中,A551为溶液在最大吸收波长(551 nm)处的吸光度,ε=21.000M-1·cm-1,l为比色皿的口径宽度,Vsample和Vfinal分别是测试样品的体积与所有试剂都加入样品后的总体积.空白对照组中不加Fe3O4纳米粒子.
2 结果与讨论
2.1 晶相结构分析
图1是Fe3O4粒子的XRD谱图.与标准的JCPDS卡进行对比,发现所有样品在30.10°,35.40°,43.40°,53.60°,57.30°及 62.80°均出现衍射峰,分别对应于 Fe3O4相的(220),(311),(400),(422),(511)和(440)晶面,说明所得产物均为Fe3O4.随着制备温度的升高,衍射峰的强度逐渐增强,而且相同制备温度下,FF-Fe3O4粒子的衍射峰强于CP-Fe3O4粒子.

图1 CP-Fe3O4粒子
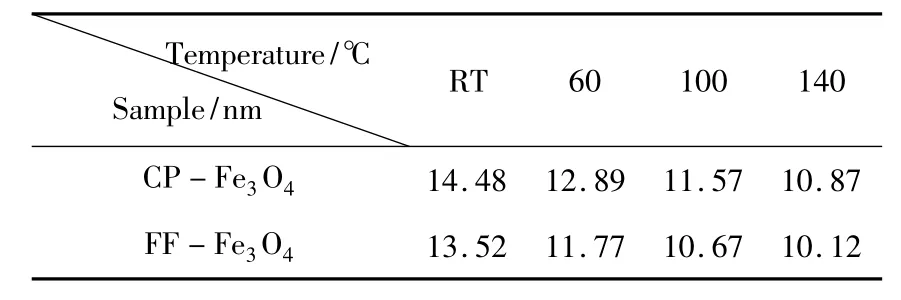
表1 Fe3O4纳米粒子的平均粒径
表1显示,粒子的平均粒径随着制备温度的升高而减小,这可能是因为制备温度高,粒子的成核速度快,晶核的生长速度受到抑制,所得Fe3O4粒子的平均粒径就偏小[17].相同制备温度下,FF-Fe3O4粒子的平均粒径小于CP-Fe3O4粒子,这说明 FF-Fe3O4粒子稳定性优于CPFe3O4粒子,不易团聚.
2.2 Fe3O4纳米粒子对底物DPD的酶促动力学表观参数
为比较Fe3O4粒子与HRP对检测H2O2所用底物DPD的亲和程度,测定了Fe3O4粒子对DPD的酶促动力学表观参数.图2是不同体系的Lineweaver-Burk双倒数图.
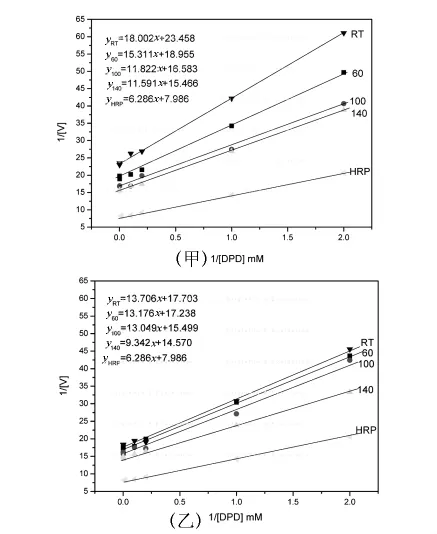
图2 不同温度下制备的CP-Fe3O4粒子
由Lineweaver-Burk双倒数作图得到的线性回归方程计算可知,在所有Fe3O4粒子中,只有室温、60℃下制备的CP-Fe3O4粒子与底物的亲和程度差于HRP,其余Fe3O4纳米粒子与检测H2O2浓度的底物都有很强的亲和力,而且相同制备温度下,FF-Fe3O4粒子与底物DPD的亲和力强于 CP-Fe3O4粒子.这表明,DPD适合作Fe3O4纳米粒子分解H2O2的分析底物,用于检测H2O2的浓度.
2.3 DPD为底物评价 Fe3O4纳米粒子分解H2O2的能力
图3是不同体系中的紫外可见吸光谱.各体系中H2O2分解量由551nm处吸光度值计算,见表2.
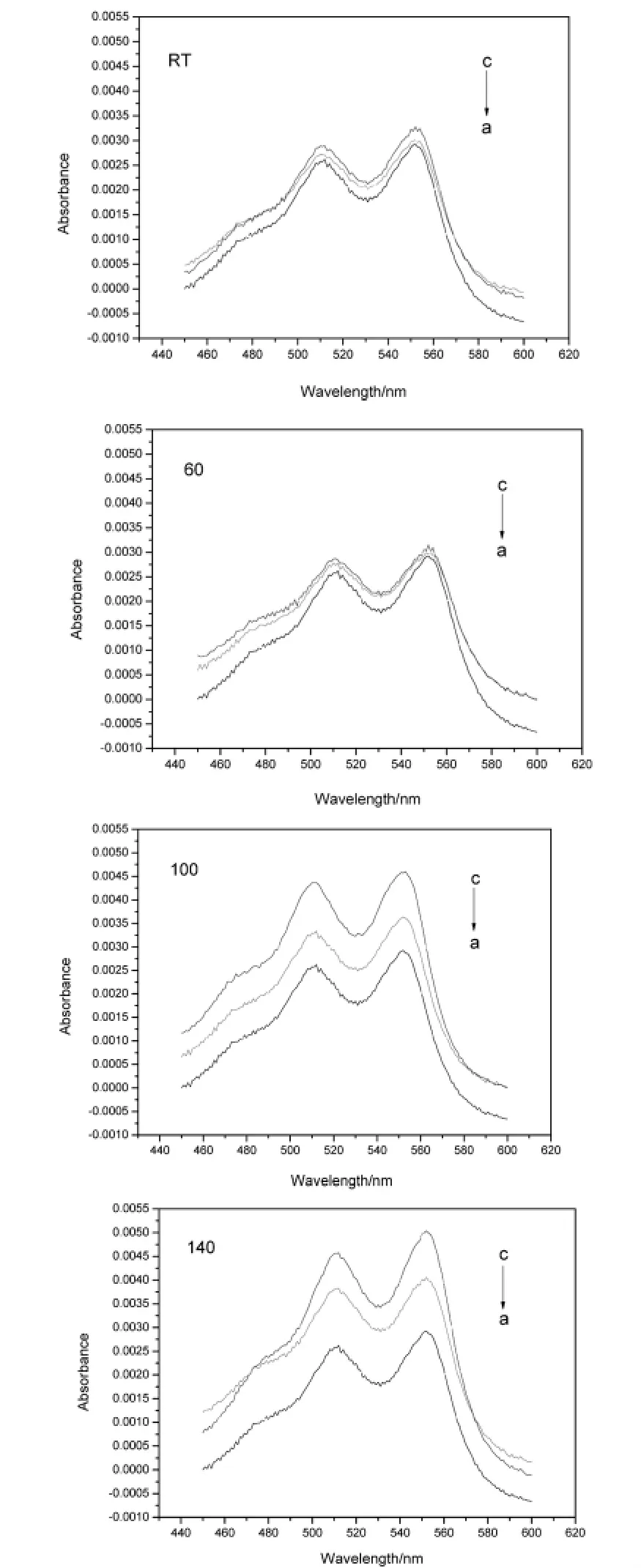
图3 DPD-H2O2体系中加入Fe3O4纳米粒子后的紫外可见连续光谱

表2 各样品中H2O2分解量 ×10-7mol/L
通过以上图表可得,体系中未加入Fe3O4纳米粒子时,H2O2与 DPD缓慢反应,生成少量DPD·+,曲线a的吸光度较低.当体系中加入CP-Fe3O4粒子和FF-Fe3O4粒子时,吸光度增大,且加入FF-Fe3O4粒子体系的吸光度大于加入CP-Fe3O4粒子的体系.这表明,Fe3O4纳米粒子能催化H2O2分解进而氧化DPD生成DPD·+,体系的吸光度增大.制备温度越高,Fe3O4纳米粒子催化分解H2O2的能力越强.对于相同制备温度下,FF-Fe3O4粒子催化分解H2O2的能力强于CP-Fe3O4粒子,这说明140℃蒸流水中的回流处理,促进了Fe3O4粒子分解H2O2的能力.这可能是由于经过140℃回流热处理后的Fe3O4表面羟基多,表面活性较强[18],分解H2O2的能力也较强.结果也表明,所制备的Fe3O4粒子能够检测10-7mol/L的H2O2.
3 结论
采用共沉淀法,在不同温度下制备出CPFe3O4粒子和FF-Fe3O4粒子,CP-Fe3O4粒子和FF-Fe3O4粒子对DPD的亲和程度都很高,可以用DPD为分析底物评价Fe3O4粒子对H2O2的分解能力.不同温度下制备出的CP-Fe3O4粒子和FF-Fe3O4粒子都具有类过氧化物酶活性,可以催化H2O2分解,制备温度越高,Fe3O4纳米粒子平均粒径越小,粒子催化分解H2O2的能力越强,并且在相同制备温度下FF-Fe3O4粒子催化分解H2O2的能力强于CP-Fe3O4粒子,可以检测1×10-7mol/L的H2O2.
[1] Luo Y,Sui Y,Wang X,et al.2-Chlorophenol induced hydroxyl radical production in mitochondria in carassius auratus and oxidative stress—an electron paramagnetic resonance study.Chemosphere,2008,71:1260-1266.
[2] Stefan Radl,Silvia Larisegger.Quantifying Absorption Effects during Hydrogen Peroxide Decontamination.Journal of Pharmaceutical Innovation,2011(4):202-216.
[3] Manzoori J,Amjadi M.Application of crude extract of kohlrabi(brassica oleracea gongylodes)as a rich source of peroxidase in the spectrofluorometric determination of hydrogen peroxide in honey samples.Anal Sci,2006,22:1201-1209.
[4] Tang B,Zhang L,Xu K.FIA– near-infrared spectrofluorimetric trace determination of hydrogen peroxide using tricarchlorobocyanine dye(Cy.7.Cl)and horseradish peroxidase(HRP).Talanta,2006,68:876-883.
[5] Wei H,Wang EK.Fe3O4magnetic nanoparticles as peroxidase mimetics and their applications in H2O2and glucosedetection.Anal Chem ,2008,80:2250-2256.
[6] Zhang Keying,Zhang Na.A novelnon-enzyme hydrogen peroxide sensor based on an electrode modified with carbon nanotube-wired CuO nanoflowers.Microchimica Acta,2012,176,137-142.
[7] Yuan J,Shiller A M.Determination of subnanomolar levels of hydrogen peroxide in seawater by reagent-injection chemiluminescence detection.Anal Chem,1999,71,1975-1981.
[8] Hanaoka S,Lin J,Yamada M.Chemiluminescent flow sensor for H2O2based on the decomposition of H2O2catalyzed by cobalt(Ⅱ)-ethanolamine complex immobilized on resin.A-nal Chim Acta,2001,426,57-63.
[9] Bader H,Sturzenegger V,Hoigne J.Photometric method for the determinarion of low concentrations of hydrogen peroxide by the peroxidase catalyzed oxidation of N,N-diethyl-pphenylenediamine(DPD).Water Res,1988,22:1109-1115.
[10]皮运正,王建龙.N,N-二乙基对苯二胺/辣根过氧化物酶法测定过氧化氢浓度时臭氧干扰的消除.Chinese Journal of Analytical Chemistry,2005,10(33):1516-1519.
[11] Ouyang Huixiang,Wang Lisheng.A Simple and Sensitive Nanocatalytic Fluorescence Method for the Determination of Folic Acid in Foods Using Fe3O4Nanoparticle-K2S2O8System.Food Analytical Methods.2013,6(1):76-81.
[12] Wang Nan,Zhu Lihua.Sono-assisted preparation of highly-efficient peroxidase-like Fe3O4magnetic nanoparticles for catalytic removal of organic pollutants with H2O2.Ultrasonics Sonochemistry,2010.17:526 –533.
[13] Zhan Xia,Zhang Hui.Sensitive electrochemical sensor for hydrogen peroxide using Fe3O4magnetic nanoparticles as a mimic for peroxidase.Microchim Acta ,2011,174:183 –189.
[14] Gao L,Zhuang J,Nie L,et al.Intrinsic peroxidase-like activity of ferromagnetic nanoparticles.Nat Nanotechnol,2007(2):577-582.
[15]王丽燕,王红霞,王爱杰,等.磁性SiO2载体的表面改性与纳米TiO2光催化剂的固载[J].催化学报,2009,30:939-944.
[16] Tay K S,Rahman N A.Chemical oxidation of N,N-diethyl-m-toluamide by sulfate radical-based oxidation:kinetics and mechanism of degradation.International Journal of Environmental.Science and Technology,2013,10:103-112.
[17] Geng B Y,Ma J Z,You J H.The Effect of Ionic Liquids on Protein Crystallization and X-ray Diffraction Resolution.Cryst Growth Des,2008,8(5):1443-1447.
[18] Chang Qing,Deng Kejian.Determination of hydrogen peroxide with the aid of peroxidase-like Fe3O4magnetic nanoparticles as the catalyst.Microchim Acta,2009,11:745-751.
