番茄早疫病拮抗放线菌的筛选
2012-09-15沈志红杨丽丽
袁 鹤,沈志红,杨丽丽,李 凯
(山西舜天农业微生物科学技术研究院,山西阳泉045000)
番茄早疫病又称轮纹病,是由茄链格孢菌(Alternaria solani)所导致的一种番茄重要病害之一,也是一种世界性病害。其在美国、澳大利亚、印度、希腊等地发病率都很高,严重时可使产量损失35%~78%[1]。番茄早疫病在我国河北、山西、黑龙江、湖北、江苏、浙江等大部分地区也普遍发生,为害日趋严重。目前,全国各地均有发生,已经成为露地、保护地番茄生产中的主要病害,对番茄产量影响很大,一般减产30%左右,严重时可达50%以上[2]。
目前,生产上通常使用百菌清、敌克松、多菌灵等化学药剂对番茄早疫病进行防治。化学防治是控制早疫病的有效方法,具有见效快、杀菌谱广、成本低、使用简便等优点[3],但化学杀菌剂的长期反复大量使用会引起其自身在土壤和作物上的残留,对土壤、地下水、大气造成污染,破坏生态平衡,尤其给子孙后代的生存、健康带来威胁。随着近年来人们对环境问题的日益关注和对绿色食品的需求,生物防治以其高效且无毒、无害、无污染、不产生抗药性的特点越来越受到研究者的重视。
放线菌是产生农用抗生素的重要生物资源,其在植物病害生物防治中具有很好的应用前景[4]。寻找和筛选拮抗番茄早疫病的生防菌是早疫病防治的重要工作。
本研究以番茄早疫病菌为靶标病原菌,从不同感病番茄的田间土壤中筛选拮抗作用强的放线菌,以期为番茄早疫病的生物防治提供具有生防效果的菌株。
1 材料和方法
1.1 材料
供试放线菌分离自番茄栽培地土壤(阳泉市平定县南坪村)。供试的番茄早疫病菌由河北省科学院提供。放线菌的分离和保存采用高氏一号培养基,拮抗放线菌株的筛选及病原菌株的培养均采用马铃薯培养基(PDA)。
1.2 方法
1.2.1 土壤中放线菌的分离与纯化 将采自番茄栽培地的土样自然风干,过0.25 mm筛[5],称取5 g烘干的土壤样品,置于盛有45 mL无菌水的三角瓶中,充分振荡,静置10 min,采用平板梯度稀释法分离放线菌。于高氏一号培养基上28℃培养5~7 d,根据菌落形态、色泽、气生菌丝的有无、产色素情况等特点,初步鉴定为放线菌[6-8],并对分离到的放线菌菌落进行编号。经纯化后的菌株于高氏一号斜面培养基上培养7~14 d后于4℃保存。
1.2.2 拮抗放线菌的初筛 从斜面刮取放线菌孢子配成浓度为106个/mL的孢子悬浮液,吸取10 mL接入装有100 mL发酵培养基的250 mL摇瓶中,于28℃,150 r/min培养4 d。从斜面刮取番茄早疫病菌接种于PDA平板,于26℃培养,待菌落长满平板备用。
筛选拮抗放线菌时,用直径7 mm的打孔器在长满番茄早疫病菌的PDA平板上打孔,将打下的菌饼接入待测的PDA平板中央;将放线菌发酵液过滤获得无菌滤液,用灭菌的滤纸片(直径7 mm)均匀地吸足发酵液后,以对角线的方式对称地放在菌饼四周[8],26℃培养7 d后观察抑菌效果,重复3次。以接种番茄早疫病菌但不放置放线菌发酵液纸片的平板为对照。
1.2.3 拮抗放线菌的复筛 将初筛得到的具有拮抗效果的放线菌,采用纸片扩散法进行复筛。在PDA平板中央接入番茄早疫病病菌菌饼,用灭菌的滤纸片(直径7 mm)均匀地吸足发酵液后,以对角线的方式对称地放在菌饼四周[9],放置时以3张滤纸片层叠,以保证吸有足够的放线菌发酵液来抑制病原菌,26℃培养7 d后观察抑菌效果,重复3次。以接种番茄早疫病菌但不放置放线菌发酵液纸片的平板为对照。
1.2.4 拮抗放线菌的形态观察 采用插片法[10]培养待鉴定的拮抗菌株,在显微镜下观察菌丝和孢子丝的形态。
2 结果与分析
2.1 放线菌的分离与纯化
从感染番茄早疫病的土壤样品中经过梯度稀释分离后,根据菌落形态、大小、色泽等对具有不同生长特征的菌落进行编号,从平板上挑取菌落,分离纯化后共得到放线菌32株。
2.2 拮抗放线菌的初筛和复筛
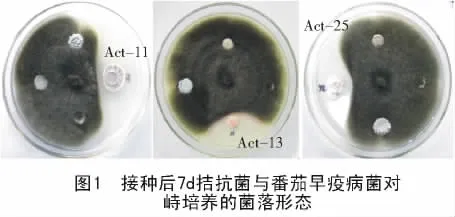
将番茄早疫病菌菌饼接入PDA平板中央,在其对角线等距离分别放入吸足32株放线菌发酵液的滤纸片。培养7 d后,初步筛出对番茄早疫病菌生长有拮抗效果的放线菌8株。将这8株放线菌,采用纸片扩散法进行复筛,最终筛选出对番茄早疫病菌具有明显拮抗效果的放线菌3株,编号分别为 Act-11,Act-13,Act-25。
从图1可以看出,将番茄早疫病菌与拮抗菌在PDA平板上对峙培养7 d后,拮抗菌对病原菌菌落生长产生明显的抑菌带,靠近拮抗菌边缘处的病原菌不能正常向外扩展,并且边缘菌丝变得弯曲。另外,对番茄早疫病菌没有拮抗效果的放线菌不影响病原菌菌丝的正常生长,菌丝可绕过滤纸片向外扩展生长。
2.3 拮抗放线菌的形态观察
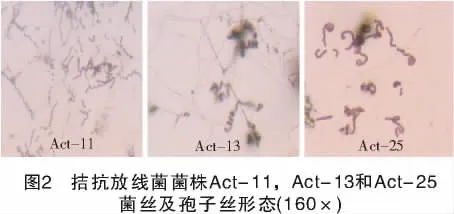
在高氏一号培养基上,菌株Act-11气生菌丝为浅粉红色,基内菌丝浅黄色,无可溶性色素产生;菌丝易断裂,孢子丝螺旋。菌株Act-13气生菌丝灰至灰褐色,基内菌丝褐灰色至褐色,无可溶性色素产生;菌丝生长良好,不断裂,孢子丝螺旋。菌株Act-25气生菌丝淡绿灰黄色至灰色,基内菌丝黄褐色,无可溶性色素产生;孢子丝直或波曲(图2)。
3 结论与讨论
本研究通过对感病番茄土壤中的放线菌进行分离筛选,获得3株对番茄早疫病菌具有较好抑制作用的拮抗放线菌,且3株放线菌都是通过发酵产物抑制病原菌的生长。
我国是一个农业大国,每年的病虫害发生面积达2.0亿~2.6亿hm2,农药的用量达数10万t,且我国的农药结构极不合理,基本上以化学农药占主导,其中,高毒、高残留、对环境影响大的农药用量占1/2以上[11],因此,开发新型生物农药是减少化学农药用量的有效途径之一,也符合发展绿色生态农业的要求。
我国已经开展关于番茄早疫病生物防治研究,但国内用以防治番茄早疫病菌的生防菌或生防制剂均还处于实验室研究阶段或小试阶段[12]。高芬等[13]从沤肥浸渍液中分离菌株来筛选对番茄早疫病菌有抑菌效果的拮抗菌,通过平皿对峙拮抗和液体培养筛选,结果筛选出6株抑菌效果较好的菌株。杨冬静等[14]采用杯碟法测定表明,枯草芽孢杆菌NJ-18菌株对番茄早疫病菌的菌丝生长有强烈拮抗作用;利用利福平抗性标记证明NJ-18能够在番茄根、茎、叶内定殖;NJ-18发酵液喷施处理盆栽番茄苗后接种,14 d后对番茄早疫病的防治效果达72.9%,显著高于50%异菌脲2 000倍液45.7%的防治效果。
本研究筛选出Act-11,Act-13和Act-25共3株放线菌对番茄早疫病有很强的抑菌活性,是较好的防治早疫病的有益微生物,从中开发出新型、高效、无毒的天然农用杀菌剂的潜力十分巨大,为番茄病害的生物防治提供可能,对实现番茄早疫病的安全、有效防治具有十分重要的意义。3株拮抗菌的获得不仅为开发出廉价、高效的生物农药奠定了菌种基础,而且为进一步研究番茄早疫病高效拮抗菌的拮抗机制提供了试验基础。
[1] Vloutoglou SN,Kalogerakis.Effect of inoculums concentration,wetness duration and plant age on development of early blight(Alternaria solani)and on sheddingof leaves in tomatoplant[J].Plant Pathology,2001,49(3):314-315.
[2]赵士敏,刘亦学,刘焕禄.保护地番茄早疫病研究初探[J].天津农业科学,1996,2(4):13-15.
[3]赵亚兰,朱圣杰,任素樱.番茄早疫病的综合防治[J].河套大学学报,2010,7(4):23-25,26.
[4]阮云飞,穆瑞霞,王吉庆,等.放线菌F24发酵液对灰霉菌拮抗作用初探[J].河南农业科学,2008(11):84-86,106.
[5]秦涵淳,杨腊英,李松伟,等.香蕉镰刀菌枯萎病拮抗放线菌的分离筛选及其抑制效果的初步评价 [J].中国生物防治,2010,26(2):174-180.
[6]中国科学院微生物研究所放线菌分类组.链霉菌鉴定手册[M].北京:科学出版社,1975:11-14.
[7]王兰英.生防放线菌的分离筛选及鉴定[D].呼和浩特:内蒙古农业大学,2006.
[8]郑雅楠,杨宇,吕国忠,等.土壤放线菌分离方法研究[J].安徽农业科学,2006,34(6):1167-1168,1170.
[9]李新,纪明山.土壤中拮抗放线菌的分离和筛选[J].河南农业科学,2008(1):58-60.
[10]周德庆.微生物学实验教程 [M].北京:高等教育出版社,2006:56-58.
[11]赵丽明,丁延芹,路晓萌,等.西瓜根际枯萎病拮抗放线菌的筛选及鉴定[J].生物技术通讯,2010(5):107-110.
[12]何建清,张格杰,岳海梅,等.番茄早疫病菌拮抗放线菌10-4的鉴定[J].植物保护学报,2010,37(4):308-312.
[13]高芬,马利平,乔雄梧.对番茄早疫病拮抗菌的筛选[J].山西农业科学,2001,29(3):64-66.
[14]杨冬静,王建新,周明国.Bacillus subtilis NJ-18菌株对番茄早疫病菌的颉颃作用研究 [J].微生物学通报,2009,36(8):1166-1169.
