腺苷A2a受体在红景天苷调节大鼠低氧性肺动脉高压中的作用*
2012-09-14黄晓颖蔡学定卢园园王良兴
黄晓颖, 樊 荣, 蔡学定, 张 协, 卢园园, 王良兴
(1温州医学院附属第一医院呼吸内科,浙江温州325003;2扬州市江都人民医院呼吸内科,江苏扬州225200)
腺苷是体内重要的内源性生理活性物质,是强大的血管舒张剂,是公认的强效肺动脉舒张剂[1]。腺苷的诸多作用通过其受体所介导。目前已经发现4种腺苷受体(adenosine receptor,AR)亚型,分别是A1AR、A2aAR、A2bAR和 A3AR。A2aAR由于其广泛的生理病理调节作用而受到人们的关注,在体循环其被腺苷及腺苷类似物活化后,具有舒张血管平滑肌、扩张冠状动脉和外周动脉的作用[2];以及抗炎和免疫抑制作用[3]。本实验拟观察A2aAR是否能抑制低氧诱导的肺动脉高压。红景天苷(salidroside)是景天科植物红景天的最主要药理成分,具有抗疲劳、抗缺氧、抗氧化、抗纤维化、清除氧自由基等作用[4]。我们的前期研究发现其具有抑制低氧性肺动脉高压的作用,本实验拟研究红景天苷对A2aAR表达的影响,为临床治疗提供实验依据。
材料和方法
1 动物模型的复制和分组
雄性SPF级 Sprague-Dawley(SD)大鼠60只(由温州医学院实验动物中心提供),体重(200±20)g,随机均匀分为6组,每组10只。A:正常对照组;B:低氧组;C:低氧+红景天苷低剂量组;D:低氧+红景天苷中剂量组;E:低氧+红景天苷高剂量组;F:低氧+A2aAR激动剂(CGS-21680)组。B~E组大鼠均置于常压低氧舱,氧浓度控制在8% ~11%,CO2浓度维持在1% ~3%,每天8 h(8:00~16:00),每周6 d,共4周。B组每次入舱前0.5 h腹腔注射4 mL/kg生理盐水。C~E组每次入舱前0.5 h腹腔注射红景天苷(购自南京泽朗医药科技有限公司,批号为201112,纯度98%,干粉),低、中、高剂量分别为2 mg/kg、8 mg/kg和32 mg/kg。F 组 CGS-21680(分子式:C23H29N7O6,分子量:535.99,每瓶 10 mg,批号为1063/10,Tocris产品,纯度≥98%)的剂量为0.2 mg/kg。
2 平均肺动脉压(mean pulmonary arterial pressure,mPAP)、平均颈动脉压(mean carotid arterial pressure,mCAP)和右心指数[right ventricle/(left ventricle+septum),RV/(LV+S)]的测定
造模4周后,5%水合氯醛(400 mg/kg)腹腔注射麻醉,仰卧固定,行颈正中切口,分离右颈外静脉和左颈总动脉,右心导管法测量大鼠肺动脉压力。将自制弯头的聚乙烯导管(外径1.1 mm,内径0.8 mm)从右颈外静脉进入右心室、肺动脉,通过YL-4型压力传感器和MedLab生物数据记录分析系统记录右心室压力波和肺动脉压力波,测定mPAP。左颈总动脉插管,YL-3型压力传感器和MedLab生物数据记录分析系统记录颈动脉压力波,测定mCAP。
放血处死动物后,分离心脏,PBS缓冲液洗去血液,弃除心房,沿室间隔把心脏剪开成右心室壁(right ventricle,RV)和左心室加室间隔(left ventricle+septum,LV+S)两部分,滤纸吸干液体后分别用电子天平称重,计算两者的比值RV/(LV+S)来反映右心室重量的变化。
3 光镜制作标本及观察
放血处死大鼠,取出大鼠肺组织,迅速置入4%多聚甲醛液中固定,固定24~48 h后取出肺组织,肺门水平横切,常规脱水、透明、石蜡包埋,连续切片,厚度约4 μm,脱蜡至水,HE染色,显微镜下观察,测量肺小动脉管壁面积(vessel wall area,WA)和管总面积(vessel total area,TA),并计算其比值WA/TA。
4 免疫组化法检测各组大鼠肺小动脉管壁A2aAR相对含量
兔抗大鼠多克隆抗体(I抗)购自Thermo,1∶100稀释,兔二步法检测试剂盒购自北京中杉金桥生物技术有限公司。肺组织石蜡切片,3%过氧化氢室温处理,加牛血清封闭,滴加I抗、Ⅱ抗,DAB显色,阳性结果呈棕黄色。每只大鼠选1张肺组织切片,每张切片随机选取直径50~200 μm的肺细小动脉5支,Image-Pro Plus 6.0图像分析软件检测A2aAR的平均吸光度,随机测定5个高倍视野后计算其平均值,作为该片的A2aAR值。
5 原位杂交法检测各组大鼠肺细小动脉管壁A2a AR mRNA相对含量
5.1 寡核苷酸探针 地高辛标记的多聚核苷酸探针购自武汉博士德生物工程有限公司。探针序列,A2aAR:(1)5’-AACAG TAACC TGCAC AACGT CACCA ACTTC TTTGT-3’;(2)5’-TGGAA CAACT GCAGT CAGAA AGACG GGAAC TCCAC-3’;(3)5’-AACTG TTTCA CCTTC TTCTG CTCCA CGTGC CGGCA-3’。
5.2 杂交过程 肺组织石蜡切片,脱蜡至水,3%过氧化氢去除内源性过氧化物酶,3%柠檬酸稀释的胃蛋白酶消化,地高辛标记的A2aAR寡核苷酸探针杂交,封闭,滴加兔抗地高辛,生物素化羊抗兔IgG,DAB显色,阳性结果呈棕黄色。每只大鼠取1张肺组织切片,随机选取5支直径约50~200 μm肺细小动脉为分析对象,用Image-Pro Plus 6.0图像分析软件检测A2aAR的平均吸光度值,随机测定5个高倍视野后计算其平均值,作为该片的A2aAR mRNA值。
6 大鼠肺组织匀浆A2aAR mRNA表达的检测
取大鼠右肺组织80~100 mg提取总RNA,逆转录为cDNA,行普通PCR先确认标本具有阳性表达后,再用real-time RT-PCR反应体系扩增,使用SYBR Green real-time RT-PCR相对定量的方法。比较各组管家基因GAPDH以及目的基因的Ct值,运用2-ΔΔCt方法,得出mRNA的相对表达量。最终结果由PCR仪配套软件自动计算,引物设计见表1。

表1 引物序列Table 1.Primer sequences
7 各组大鼠肺组织匀浆A2aAR蛋白的测定(Western blotting)
取大鼠右肺组织80~100 mg,加入400 μL组织裂解液在冰上研磨,冰浴,超声裂解,离心,取上清(即蛋白提取液)。用BCA蛋白浓度试剂盒测定蛋白浓度。常规SDS-PAGE电泳(每孔上样80 μg蛋白),三明治法恒压电转移至PVDF膜(300 mA,40 min),封闭液室温封闭。弃去封闭液,滴加A2aARⅠ抗(兔抗大鼠多克隆抗体,稀释浓度1∶1 000)4℃过夜。辣根过氧化物酶标记的兔Ⅱ抗(碧云天,1∶500)室温孵育2 h,洗膜后化学发光显影。将显影后的胶片扫描至电脑中,用Quantity One凝胶图像分析软件分析A2aAR吸光度。
8 统计学处理
采用SPSS 17.0统计软件分析。所有数据进行正态性检验,计数资料用均数±标准差(±s)表示。多组样本均数比较用方差检验,两两比较用LSD检验。以P<0.05为差异有统计学意义。
结 果
1 各组大鼠mPAP、mCAP和RV/(LV+S)的比较
低氧组mPAP显著高于正常组(P<0.01),红景天苷中、低剂量组mPAP虽然较低氧组有减低趋势,但无统计学意义(P>0.05),红景天苷高剂量组mPAP显著低于低氧组(P<0.01)。CGS-21680组mPAP显著低于低氧组(P<0.01),见表2。
各组mCAP无显著差异,见表2。
低氧组RV/(LV+S)显著高于正常组(P<0.01),红景天苷低剂量组虽然较低氧组有减低趋势,但无统计学意义(P>0.05),红景天苷中剂量组低于低氧组(P<0.05),红景天苷高剂量组显著低于低氧组(P<0.01),CGS-21680组显著低于低氧组(P <0.01),见表 2。
2 A2aAR和红景天苷对慢性低氧大鼠肺细小动脉显微结构的影响
光镜下,慢性低氧组大鼠肺细小动脉管腔明显狭窄,中膜平滑肌细胞显著增生,炎症细胞浸润;CGS-21680组和红景天苷组肺细小动脉管腔狭窄程度、中膜平滑肌细胞增生程度、炎症细胞浸润程度与低氧组相比明显减轻。WA/TA较对照组显著增高(P<0.01),CGS-21680组和红景天苷组均明显低于低氧组(P <0.01),见表2。
3 各组大鼠肺细小动脉管壁A2aAR mRNA及蛋白含量的比较
低氧组肺细小动脉管壁A2aAR mRNA及蛋白表达高于正常组(P<0.01),A2aAR激动剂组和红景天苷高剂量组A2aAR mRNA及蛋白表达较低氧组进一步升高(P <0.01),见图1、2 和表3。
表2 各组大鼠mPAP、mCAP、RV/(LV+S)和WA/TA的比较Table 2.Changes of mPAP,mCAP,RV/(LV+S)and WA/TA in different groups(±s.n=8)
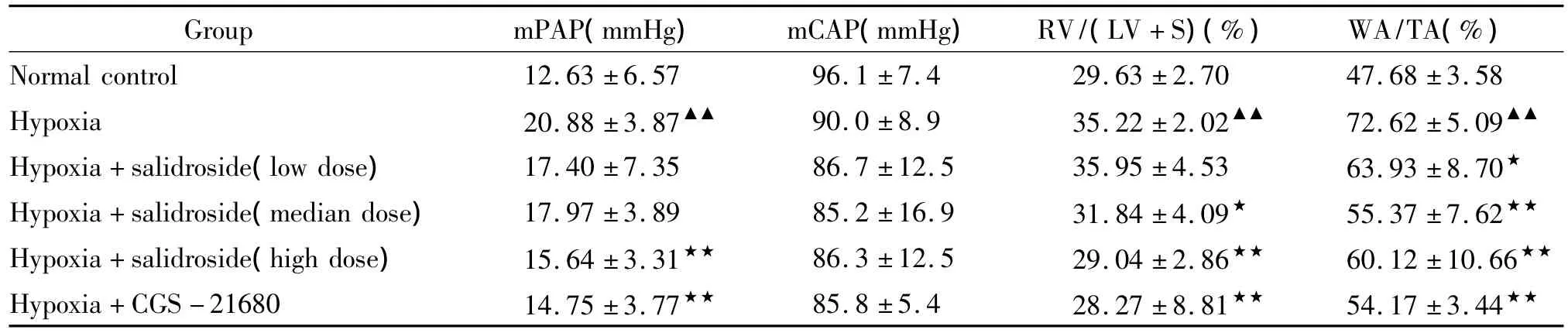
表2 各组大鼠mPAP、mCAP、RV/(LV+S)和WA/TA的比较Table 2.Changes of mPAP,mCAP,RV/(LV+S)and WA/TA in different groups(±s.n=8)
▲▲P <0.01 vs normal control group,★P <0.05,★★P <0.01 vs hypoxia group.
Group mPAP(mmHg) mCAP(mmHg) RV/(LV+S)(%) WA/TA(%)Normal control 12.63 ±6.57 96.1 ±7.4 29.63 ±2.70 47.68 ±3.58 Hypoxia 20.88 ±3.87▲▲ 90.0 ±8.9 35.22 ±2.02▲▲ 72.62 ±5.09▲▲Hypoxia+salidroside(low dose) 17.40 ±7.35 86.7 ±12.5 35.95 ±4.53 63.93 ±8.70★Hypoxia+salidroside(median dose) 17.97 ±3.89 85.2 ±16.9 31.84 ±4.09★ 55.37 ±7.62★★Hypoxia+salidroside(high dose) 15.64 ±3.31★★ 86.3 ±12.5 29.04 ±2.86★★ 60.12 ±10.66★★Hypoxia+CGS-21680 14.75 ±3.77★★ 85.8 ±5.4 28.27 ±8.81★★ 54.17 ±3.44★★

Figure 1.Expression of A2aAR mRNA in pulmonary arterioles in different groups(in situ hybridization,×200).A:normal control group;B:hypoxia group;C:hypoxia+salidroside(low dose)group;D:hypoxia+salidroside(median dose)group;E:hypoxia+salidroside(high dose)group;F:hypoxia+CGS-21680 group.图1 各组肺细小动脉A2aAR mRNA的检测
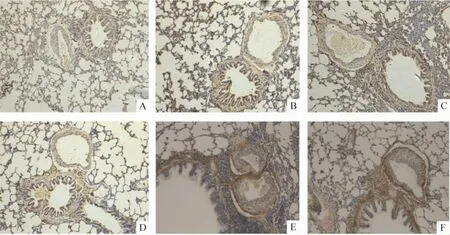
Figure 2.Expression of A2aAR protein in pulmonary arterioles in different groups(immunohistochemistry,×200).A:normal control group;B:hypoxia group;C:hypoxia+salidroside(low dose)group;D:hypoxia+salidroside(median dose)group;E:hypoxia+salidroside(high dose)group;F:hypoxia+CGS-21680 group.图2 各组肺细小动脉A2aAR蛋白的检测
表3 各组大鼠肺细小动脉管壁A2aAR mRNA及蛋白表达的比较Table 3.Expression of A2aAR mRNA and protein in pulmonary arterioles in rats of different groups(±s.n=8)
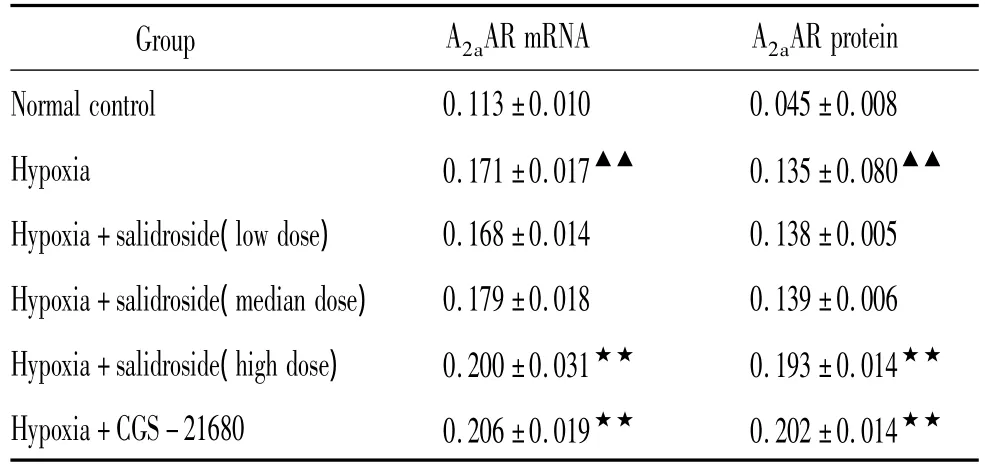
表3 各组大鼠肺细小动脉管壁A2aAR mRNA及蛋白表达的比较Table 3.Expression of A2aAR mRNA and protein in pulmonary arterioles in rats of different groups(±s.n=8)
▲▲P <0.01 vs normal control group;★★P <0.01 vs hypoxia group.
Group A2aAR mRNA A2a AR protein Normal control 0.113±0.010 0.045±0.008 Hypoxia 0.171±0.017▲▲ 0.135±0.080▲▲Hypoxia+salidroside(low dose) 0.168±0.014 0.138±0.005 Hypoxia+salidroside(median dose) 0.179±0.018 0.139±0.006 Hypoxia+salidroside(high dose) 0.200±0.031★★ 0.193±0.014★★Hypoxia+CGS-21680 0.206±0.019★★ 0.202±0.014★★
4 各组大鼠肺组织匀浆A2aAR mRNA和蛋白表达的比较
低氧组肺组织A2aAR mRNA和蛋白表达显著高于正常组(P<0.01),红景天苷高剂量组和A2aAR激动剂组肺组织A2aAR mRNA和蛋白进一步高于低氧组(P <0.01),见图3、表4。

Figure 3.A2aAR protein expression in lung homogenate in different groups.±s.n=4.A:normal control group;B:hypoxia group;C:hypoxia+salidroside(low dose)group;D:hypoxia+salidroside(median dose)group;E:hypoxia+salidroside(high dose)group;F:hypoxia+CGS-21680 group.▲▲P <0.01 vs normal control group;★★P <0.01 vs hypoxia group.图3 各组肺组织匀浆A2aAR蛋白的表达
讨 论
慢性低氧性肺动脉高压的发病机制十分复杂,尚未完全明了,目前认为低氧性肺血管收缩,低氧性肺血管重建是其形成的主要原因[5]。低氧时,肺部血管舒张因子(如一氧化氮、前列环素2等)和收缩因子(如内皮素、血栓素A2、前列腺素H2等)失衡;通过一系列信号传递引起血管平滑细胞细胞内Ca2+增多,引起血管平滑肌收缩。导致低氧性肺血管收缩[6]。肺血管重建是缺氧肺动脉高压的主要变化特征。近年来报道 JAK/STAT、PKC-MAPK、PI3K/PKB等多途径参与了低氧情况下肺动脉平滑肌细胞的增殖、迁移[7-8]。此病理过程中,肺动脉平滑肌细胞大量增殖,从中膜迁移于内膜,主要表现为<60 μm的无肌层肺小动脉出现明显的肌层,>60 μm的肺小动脉(如肌型动脉和前毛细血管动脉)中层增厚,内膜及外膜胶原及基质增生,使血管变硬,阻力增加[9]。我们的前期研究发现红景天苷对低氧肺动脉高压大鼠具有一定保护作用,可抑制低氧诱导的肺血管胶原增生。A2aAR在体循活化后,具有舒张血管平滑肌以及抗炎和免疫抑制作用。本文重点研究了A2aAR在红景天苷调节大鼠低氧肺动脉高压中的作用。
表4 各组大鼠肺组织匀浆A2aAR mRNA和蛋白表达的比较Table 4.Expression of A2aAR mRNA and protein in lung homogenate in rats of different groups(±s.n=8)

表4 各组大鼠肺组织匀浆A2aAR mRNA和蛋白表达的比较Table 4.Expression of A2aAR mRNA and protein in lung homogenate in rats of different groups(±s.n=8)
▲P < 0.05,▲▲ P < 0.01 vs normal control group;★ P <0.05,★★P <0.01 vs hypoxia group.
Group A2aAR mRNA A2a AR protein Normal control 1.0000±0.0000 0.041±0.008 Hypoxia 1.5917±0.4776▲ 0.127±0.011▲▲Hypoxia+salidroside(low dose) 1.5226±0.6095 0.128±0.007 Hypoxia+salidroside(median dose) 1.7501±0.6756 0.131±0.011 Hypoxia+salidroside(high dose) 2.1900±0.5835★ 0.171±0.021★★Hypoxia+CGS-21680 2.2933±0.7508★ 0.173±0.008★★
1 低氧肺动脉高压模型的复制
本研究结果显示,常压低氧大鼠平均肺动脉压明显高于正常对照组,表明4周的低氧环境已经使大鼠形成了肺动脉高压。光镜下,慢性低氧组大鼠炎症细胞浸润,肺细小动脉管壁增厚,WA/TA较正常对照组显著增加,表明肺血管重构已经形成。此外,慢性低氧组和正常对照组相比右心指数明显升高。这些数据表明慢性低氧性肺动脉高压、肺血管重构及右心室肥厚模型已经建立成功。
2 A2aAR对低氧肺动脉高压大鼠的保护作用
A2aAR在体内起着重要的扩血管、抗炎和修复的作用[10]。Thiel等[11]发现,低氧诱发 A2aAR 表达增多,抑制了急性呼吸窘迫综合症的发展。另外在心肌组织,低氧使A2aAR表达增加,抑制了一些炎症介质,如 IL-6、TNF-α 等的释放[12]。同样,在肝组织中,低氧上调A2aAR的表达,并抑制低氧诱发的肝细胞损伤[13]。这说明在低氧刺激下,A2aAR表达量增加,可能是机体减轻低氧诱发的应激损伤的重要机制。本实验通过免疫组化、原位杂交、real-time RT-PCR和Western blotting等方法定位和定量检测大鼠肺血管和肺组织匀浆均发现,在低氧条件下,A2aAR表达明显增多,这与以上研究均相符。Alchera等[14]认为低氧能够上调A2aAR,与本实验结果一致。我们推测,腺苷受体可能对低氧性肺动脉高压的发展起持续的调节作用,故采用选择性A2aAR激动剂CGS-21680。与低氧组相比,CGS-21680组大鼠A2aAR表达进一步上调的同时,肺动脉压明显下降,肺组织炎症细胞浸润减少,肺细小动脉管重构减轻,这说明A2aAR具有减轻低氧性肺动脉高压和肺血管重建的作用。
3 红景天苷对低氧肺动脉高压的保护作用及机制研究。
红景天苷是景天科植物大花红景天的干燥根及根茎,有高原参之美誉。它主要生长在高寒地带,具有抑制高原低氧肺动脉高压的作用[15]。研究大鼠外周骨骼肌细胞发现,红景天苷能够增加一磷酸腺苷(adenosine monophosphate,AMP)、二磷酸腺苷(adenosine diphosphate,ADP)和三磷酸腺苷(adenosine triphosphate,ATP)含量,并且随着剂量的增加有上升趋势[16]。在缺氧和炎症反应过程中,大量胞内和胞外的腺苷通过ATP分解产生[17]。因此我们推测红景天苷可能通过增加ATP来激活腺苷。
本实验通过常压低氧肺动脉高压模型,发现低、中剂量红景天苷有降低mPAP趋势,但无统计学差异,高剂量红景天苷能够显著降低mPAP。光镜下我们发现红景天苷各浓度组均能不同程度抑制慢性低氧引起的肺细小动脉管壁增厚,降低WA/TA,减少炎症细胞浸润,并且呈剂量依赖性。提示红景天苷具有减轻低氧诱发的肺动脉高压和肺血管重建的作用。
本研究通过免疫组化、原位杂交、real-time RT-PCR和Western blotting等方法发现低氧条件下,高剂量红景天苷可使肺细小动脉和肺组织A2aAR mRNA和蛋白质水平的表达进一步升高。如前所诉,A2aAR具有扩血管、抗炎的作用。因此推测,红景天苷可能通过增加A2aAR表达,提高机体代偿极限,从而减轻低氧所诱导的肺动脉高压和肺血管结构重构,对机体起保护作用。
[1] Erga KS,Seubert CN,Liang HX,et al.Role of A2A-adenosine receptor activation for ATP-mediated coronary vasodilation in guinea-pig isolated heart[J].Br J Pharmacol,2000,130(5):1065-1075.
[2] Bender SB,Tune JD,Borbouse L,et al.Altered mechanism of adenosine-induced coronary arteriolar dilation in early-stage metabolic syndrome[J].Exp Biol Med(Maywood),2009,234(6):683-692.
[3] Blackburn MR,Vance CO,Morschl E,et al.Adenosine receptors and inflammation[J].Handb Exp Pharmacol,2009,(193):215-269.
[4] 滕静如,熊佳鹏,肖 诚,等.红景天的现代药理学研究进展[J].中国中医基础医学杂志,2006,12(4):319-320.
[5] Voelkel NF,Gomez-Arroyo J,Mizuno S.COPD/emphysema:the vascular story[J].Pulm Circ,2011,1(3):320-326.
[6] Connolly MJ,Aaronson PI.Key role of the RhoA/Rho kinase system in pulmonary hypertension[J].Pulm Pharmacol Ther,2011,24(1):1-14.
[7] 姚香兰,薛全福,赵琪平.α1-肾上腺素受体在缺氧性肺动脉平滑肌细胞增殖中的作用[J].中国病理生理杂志,2011,27(6):1187-1192.
[8] 李春香,李福海,夏 伟,等.大鼠肺动脉平滑肌细胞Rho激酶对p-Smad1核迁移的作用及机制[J].中国病理生理杂志,2011,27(3):443-449.
[9] Xu MH,Gong YS,Su MS,et al.Absence of the adenosine A2Areceptor confers pulmonary arterial hypertension and increased pulmonary vascular remodeling in mice[J].J Vasc Res,2011,48(2):171-183.
[10] Ohta A,Sitkovsky M.Role of G-protein-coupled adenosine receptors in downregulation of inflammation and protection from tissue damage[J].Nature,2001,414(6866):916-920.
[11] Thiel M,Chouker A,Ohta A,et al.Oxygenation inhibits the physiological tissue-protecting mechanism and thereby exacerbates acute inflammatory lung injury[J].PLoS Biol,2005,3(6):e174.
[12] Tan JX,Huang YG,Huang DN,et al.Effect of adenosine on activity of transcription factor NF-kappa B and cytokines in myocardial tissue of experimental rats with pneumonia[J].Zhonghua Er Ke Za Zhi,2004,42(6):433-436.
[13] Choukèr A,Thiel M,Lukashev D,et al.Critical role of hypoxia and A2A adenosine receptors in liver tissue-protecting physiological anti-inflammatory pathway[J].Mol Med,2008,14(3-4):116-123.
[14] Alchera E,Tacchini L,Imarisio C,et al.Adenosinedependent activation of hypoxia-inducible factor-1 induces late preconditioning in liver cells[J].Hepatology,2008,48(1):230-239.
[15] 郭 燕.红景天对大鼠高原性肺动脉高压的干预作用——病理形态学研究[D].兰州:兰州大学,2010.
[16] 于洪伟,季宇彬,汲晨锋.高山红景天苷对外周性疲劳大鼠骨骼肌细胞内ATP、AMP以及Pi含量的影响[J].江西中医药,2009,40(11):59-60.
[17] Sitkovsky MV,Lukashev D,Apasov S,et al.Physiological control of immune response and inflammatory tissue damage by hypoxia-inducible factors and adenosine A2Areceptors[J].Annu Rev Immunol,2004,22:657-682.
