超声波辅助提取山竹果皮中的原花青素*
2012-09-12秦菲刘蕊王龙
秦菲,刘蕊,王龙
(北京联合大学应用文理学院食品科学系,北京,100191)
超声波辅助提取山竹果皮中的原花青素*
秦菲,刘蕊,王龙
(北京联合大学应用文理学院食品科学系,北京,100191)
文中研究了山竹果皮中原花青素的超声辅助提取工艺条件。通过单因素试验分析超声提取过程中超声功率、料液比、乙醇浓度、提取时间和温度等因素对原花青素提取率的影响,在此基础上,采用L9(34)正交试验优选出山竹果皮中原花青素提取的最佳条件。结果表明:各因素对原花青素提取率的影响大小顺序为乙醇浓度(B)>温度(C)>料液比(A)>时间(D);最佳工艺条件为料液比为1∶30,乙醇体积分数60%,提取温度50℃,提取时间45 min,此条件下山竹果皮中原花青素的提取率为15.61%。
山竹果皮,原花青素,超声波,提取
山竹(Garcinia mangostana)又称莽吉柿、凤果、倒稔子,属藤黄科藤黄属,是热带多年生常绿果树,山竹果实柔软多汁,甜而略带酸味,被誉为“果中皇后”。在亚洲和非洲亚热带地区广泛栽培,我国台湾、福建、广东和云南引种后逐渐规模化种植。山竹作为一种具有发展潜力的热带水果,已受到人们的重视。山竹果皮紫褐色,厚度为0.8~1.1 cm,占鲜果干重的52%~68%,是少数几种厚皮果实之一。山竹果皮可治疗痢疾、慢性腹泻、膀胱炎、慢性溃疡等[1]。近年来研究人员从山竹果皮提取出多种化合物如β-谷甾醇、芦丁、原花青素等[2-3]。原花青素是植物界中广泛存在的一大类多酚类化合物的总称,具有保护心血管系统、清除自由基、抗氧化、抗突变、抗癌、抗辐射等多方面生物学活性[4],且未发现有毒副作用,对80多种疾病具有直接或间接的预防、治疗作用,在医药、保健品和化妆品等领域有着广泛的用途。
超声波指频率高于20 kHz、人的听觉阈以外的声波。自1927年Richards等[5]发现超声场能强化传质速率后,超声场就开始得到大量研究并应用于各领域,如从天然物质中提取有效成分等。超声波辅助提取是利用超声波的机械效应、空化效应及热效应,增大介质分子的运动频率和速度,增大介质的穿透力,加速细胞壁的破裂和物料的转移,提高植物中活性成分的提取效率[6]。本文拟采用超声波辅助提取山竹果皮中的原花青素,在单因素试验的基础上,利用正交试验,探索最佳提取条件。
1 材料与方法
1.1 材料与仪器
市售山竹果皮。将山竹果皮用蒸馏水洗净后,自然晾干,置于恒温干燥箱中,50℃下干燥至恒重,过60目筛后放入干燥器中备用。原花青素标样(95%UV),天津尖峰天然产物研究开发有限公司;香草醛、盐酸、无水乙醇、甲醇,北京化工厂,均为分析纯。
760CRT双光束紫外可见分光光度计,上海精密仪器有限公司;超声波清洗仪XMT-152,昆山市超声仪器有限公司;高速万能粉碎机,天津市泰斯特仪器有限公司;电热恒温干燥箱,上海跃进医疗器械厂;电子天平,梅特勒-托利多集团。
1.2 实验方法
1.2.1 山竹果皮中原花青素的提取
山竹果皮→50℃恒温干燥→粉碎、过60目筛→超声提取→抽滤→定容→检测
1.2.2 单因素试验
1.2.2.1 超声功率的影响
准确称取1.00 g样品放入具塞三角瓶中,在料液比1∶30,温度50℃,提取溶剂为体积分数(下同)60%乙醇、提取时间30 min的相同提取条件下,分别在超声功率为80、120、160和200 W的条件下进行提取,抽滤后定容至50 mL,用盐酸香草醛法测定原花青素的含量。
1.2.2.2 料液比的影响
准确称取1.00 g样品放入具塞三角瓶中,以60%乙醇作提取剂,在温度50℃,超声功率200 W、提取时间30 min的相同提取条件下,分别以1∶10、1∶20、1∶30、1∶40、1∶50(g∶mL)的料液比进行提取,抽滤后定容至100 mL,用盐酸香草醛法测定原花青素的含量。
1.2.2.3 乙醇浓度的影响
准确称取1.00 g样品放入具塞三角瓶中,在料液比1∶30,温度50℃,超声功率200 W、提取时间30 min的相同提取条件下,分别用体积分数20%、30%、40%、50%、60%、70%的乙醇溶液进行提取,抽滤后定容至50 mL,用盐酸香草醛法测定原花青素的含量。
1.2.2.4 提取温度的影响
准确称取1.00 g样品放入具塞三角瓶中,以60%乙醇作提取剂,在料液比1∶30,超声功率200 W、提取时间30min的相同提取条件下,分别在30、40、50、60、70℃下进行提取,抽滤后定容至50 mL,用盐酸香草醛法测定原花青素的含量。
1.2.2.5 提取时间的影响
准确称取1.00 g样品放入具塞三角瓶中,以60%乙醇作提取剂,在料液比1∶30,超声功率200 W、提取温度50℃的相同提取条件下,分别提取15、30、45、60、75、90 min,抽滤后定容至50 mL,用盐酸香草醛法测定原花青素的含量。
1.2.3 正交试验
在单因素试验的基础上,确定影响原花青素提取率的较佳水平范围,采用4因素3水平正交试验,确定最佳提取条件。
1.2.4 原花青素的测定方法
采用香草醛-盐酸分光光度法测定溶液中原花青素的含量[7-8]。取样液1 mL放入20 mL用锡箔纸包裹严的比色管中,加入6 mL 4%的香草醛-甲醇溶液和3 mL浓HCl,立即混匀后在30℃水浴显色30 min,以甲醇代替样品溶液作空白对照,在500 nm处测吸光度,按下式计算原花青素提取率:

式中:c为样品所测原花青素的浓度(mg/mL),X为提取液稀释的倍数,V为提取液体积(mL),m为样品(山竹果皮)质量(g)。
2 结果与讨论
2.1 单因素试验
2.1.1 超声功率对原花青素提取率的影响
由图1可知,随着超声波功率提高,原花青素的提取率也随着增大,但功率为200 W时的提取率与160 W相比增加幅度不大。这是因为对于一定频率的超声波来说,功率增大,声强随着增大,单位时间内超声产生的空化事件增多,导致植物细胞破裂程度增大,促进了胞内原花青素的释放,扩散及溶解。由于试验所用超声波清洗仪的功率限制,调节范围仅为80~200 W,故在后面的单因素试验和正交试验时选择超声功率为200 W。
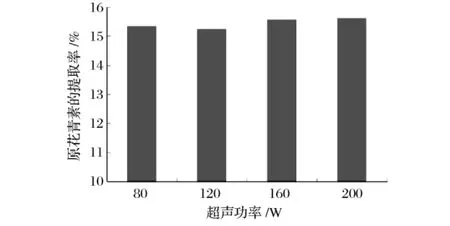
图1 超声波功率对原花青素提取率的影响
2.1.2 料液比对原花青素提取率的影响
由图2可以看出,原花青素的提取率随着料液比增加而增加,当料液比大于1∶30时,提取率增加趋于平缓。料液比是提取过程中的一个重要因素,料液比越小,原料和提取溶剂间的浓度差越小,传质推动力就越小,且提取剂量过少,也会造成提取体系渗透压过高,阻碍原花青素的进一步溶出。料液比的增大必然会在较大程度上提高传质推动力,加快整个溶媒的传质过程,提取率会明显提高[9]。但当提取率增加趋于平缓。再增大料液比,不但目标产物的提取率变化不大,还会溶出更多杂质,消耗大量的溶剂,增加溶剂回收成本,造成资源和能源的浪费。因此料液比因素的水平选取1∶20、1∶30、1∶40进行正交试验。
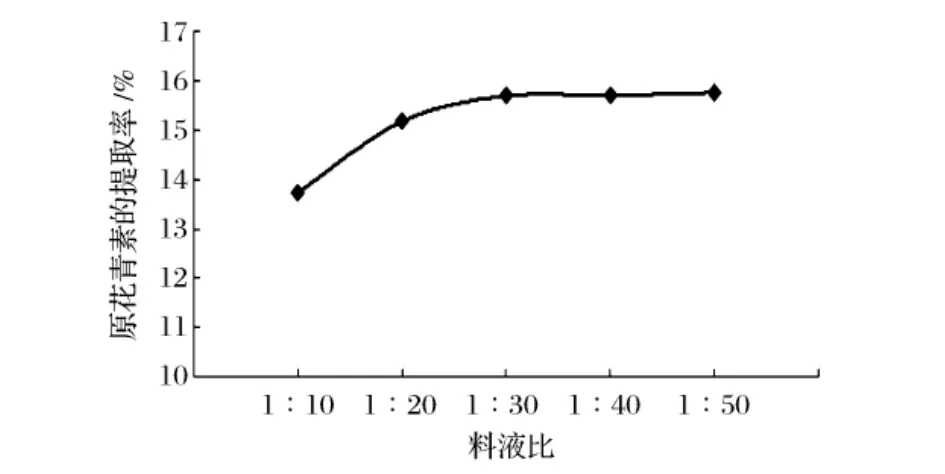
图2 料液比对原花青素提取率的影响
2.1.3 乙醇浓度对原花青素提取率的影响
由图3可知,随着乙醇浓度的增大,原花青素的提取率增大,但当乙醇体积分数大于60%时,提取率呈现下降趋势。在植物材料中,原花青素物质通常以结合态与蛋白质、纤维素结合在一起,原花青素分子间也是如此,一般不易提出,所以在原花青素提取时提取试剂不仅要求对原花青素有良好的溶解性,而且需具有氢键断裂的作用。采用乙醇水溶液作为提取溶剂,水在溶剂中起到穿透细胞壁的作用,提高通透性,在提取过程中有利于乙醇进入细胞组织内部将原花青素析出,但水有利于氢键的形成,而有机溶剂乙醇能促进氢键的断裂,氢键断裂,聚合物由大分子变成小分子,更易于游离到胞外,从而进入到提取剂体系中[10-11],但当乙醇浓度过大时,由于脂溶性、醇溶性杂质的溶出增加,与原花青素争夺提取剂,导致原花青素提取率降低。因此确定乙醇浓度正交试验水平为50%、60%和70%。
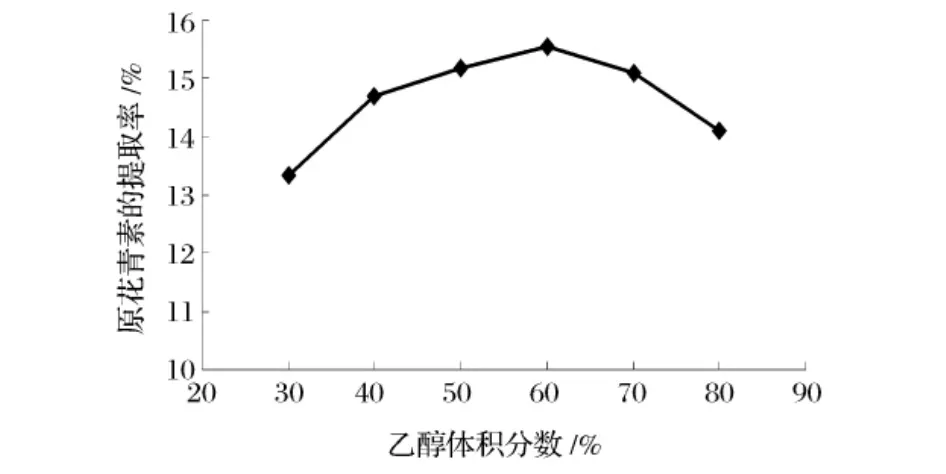
图3 乙醇浓度对原花青素提取率的影响
2.1.4 温度对原花青素提取率的影响
图4 表明原花青素的提取率随着温度的升高而增大,在温度为50℃时达到最大,然后随着温度升高而下降。
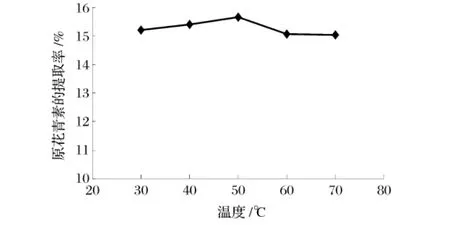
图4 提取温度对原花青素提取率的影响
温度主要影响分子的热运动,温度低时,分子运动缓慢,原花青素与蛋白质、纤维素等结合物的分离会较慢。温度升高时,分子运动速度加快,其渗透、扩散和溶解的速度也加快了,这样有利于有效成分从细胞中转移至溶剂中。温度超过50℃提取率下降是因为原花青素稳定性差,易氧化,温度过高,溶液的氧化速度过快,其结构会遭到破坏。另外温度高还容易导致杂质的溶出量增大。因此确定温度正交试验水平为40、50和60℃。
2.1.5 时间对原花青素提取率的影响
随着提取时间的增加,原花青素的提取率增大,但当提取时间达到30 min后,其提取率反而下降,这可能是由于在一定范围内,提取时间越长,提取液与被提取物质相互作用的时间越长,因而提取率就越高,但当两者达到平衡后,提取率将不再增加,且溶出的原花青素随着时间和光照增加而发生氧化降解,从而降低原花青素的含量[12]。
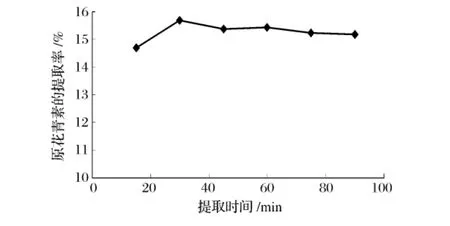
图5 提取时间对原花青素提取率的影响
2.2 正交试验结果
通过单因素试验,选择合理的因素水平进行正交试验以确定最佳提取条件,正交设计表见表1,正交试验结果见表2。

表1 正交设计表
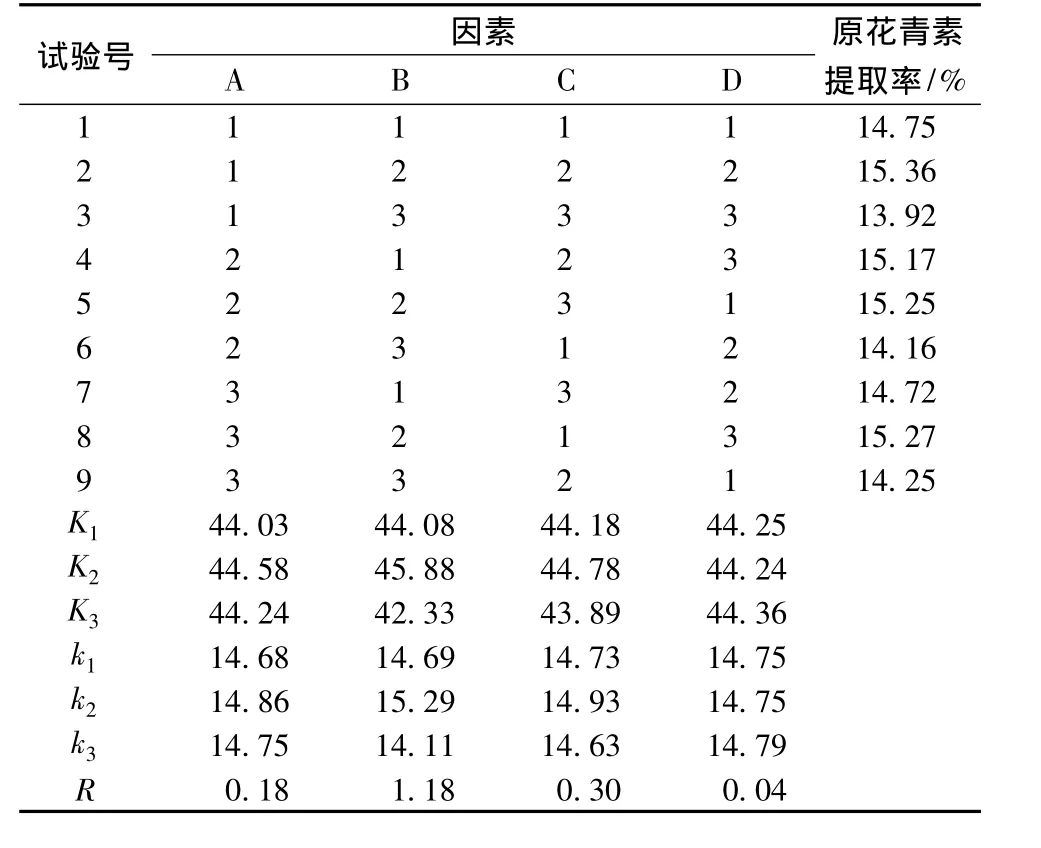
表2 L9(34)正交试验结果
由表2的极差分析可知,各因素对原花青素提取效果的影响大小顺序为:乙醇浓度(B)>温度(C)>料液比(A)>时间(D),且由正交试验可以得出原花青素超声提取的最佳工艺条件为:A2B2C2D3,即在料液比为1∶30,在50℃下用60%的乙醇超声提取45 min。
2.3 超声辅助与非超声辅助处理的对比试验
按正交设计试验选取的最佳试验条件,即60%乙醇,料液比为1∶30,在50℃恒温水浴中,一组试验超声处理45 min,另一组试验回流浸提45 min。各组试验重复3次,结果见表3。

表3 超声辅助与非超声辅助处理的对比实验结果
由表3可知,超声辅助处理比比常规的乙醇加热回流法所提取的原花青素要明显高很多。在最佳工艺条件下,山竹果皮中的原花青素提取率为15.61%,3次平行测定的相对标准偏差为0.92%,说明该条件下,提取率较稳定。
3 结论
通过单因素和正交试验,确定了超声辅助提取山竹果皮中原花青素的最佳工艺条件为:在料液比为1∶30,在50℃下用60%的乙醇超声提取45 min,此条件下山竹果皮中原花青素提取率可达15.61%。通过与传统加热回流试验的比较可知,采用超声辅助提取明显提高了山竹果皮中原花青素的提取效率。
[1]蒋侬辉,李春雨,戴宏芬,等.山竹的食用药用价值及综合应用研究进展[C].全国热带亚热带水果产业发展研讨会暨中国园艺学会热带南亚热带果树分会第三届学术年会,2010:571-576.
[2]赵岩,王春宇,李平亚.莽吉柿果皮化学成分的研究[J].特产研究,2007,3:39-42.
[3]于立梅;赵谋明;崔春,等.山竹壳花青素提取分级及抗氧化活性的研究[J].食品与机械,2007,23(4):60-64.
[4]步文磊,王茵.原花青素的生物活性及作用机制研究进展[J].国外医学卫生学分册,2007,34(5):311-315.
[5]Richard W T,Loomtis A L.The chemical effects of high frequency sound waves[J].J Am Chem Soc,1927,49(12):3086-3092.
[6]秦梅颂.超声技术在中药中的研究进展[J].安徽农业通报,2010,16(13):54-55,78.
[7]董瑞霞,李立祥,张桂敏,等.茶籽壳中原花青素提取工艺参数的研究[J].安徽农业大学学报,2008,35(2):243-245.
[8]王光亚主编.保健食品功效成分的检测方法[M].北京:中国轻工业出版社,2002.
[9]温志英,曹妍.响应面法优化花生红衣原花青素微波辅助提取工艺[J],中国粮油学报,2011,26(6):97-101.
[10]李瑞丽.葡萄籽中原花青素的提取工艺研究[D].北京:北京化工大学,2006.
[11]李莹,李才国.原花青素提取、分离纯化方法的研究进展[J].食品工程,2008(1):9-11.
[12]王祥飞,周文明,傅建熙,等.沙棘籽中原花青素提取工艺[J].西北农业学报,2006,15(3):204-207.
ABSTRACTTo study the extraction conditions for Proanthocyanidins assited by ultrasonic wave from Garcinia mangostana L peel.Effects of ultrasonic power,solid-liquid ratio,ethanol concentration,and extraction time and extraction temperature on the extraction rate were studied by single factor test.Then the optimum extraction condition was optimized by L9(34)orthogonal test.The influence order of these factors on the extraction rate of proanthocyanidins was:ethanol concentration(B)>extraction temperature(C)>solid-liquid ration(A)>extraction time(D).The optimal extraction condition was:solid-liquid ratio 1∶30(g∶mL),the concentration of ethanol 60%,the extraction time 30 minutes at 50℃.Under the optimum conditions,the yield of proanthocyanidins in Garcinia mangostana L peel was 15.61%.
Key wordsGarcinia mangostana L peel,proanthocyanidins,ultrasonic wave,extraction
Ultrasonic Wave-assisted Extraction of Proanthocyanidins from Garcinia mangostana L Peel
Qin Fei,Liu Rui,Wang Long
(Department of Food Sciences,College of Arts and Sciences of Beijing Union University,Beijing 100191,China)
博士,副教授(E-mail:qinfei@ygi.edu.cn)。
*北京市教委项目:山竹果壳中原花青素的提取及快速检测方法研究(KM200911417007)
2012-05-18,改回日期:2012-06-27
