豌豆抗性淀粉的酶法制备及其性质研究*
2012-09-12王琳武俊超高群玉
王琳,武俊超,高群玉
(华南理工大学轻工与食品学院,广东 广 州,510640)
豌豆抗性淀粉的酶法制备及其性质研究*
王琳,武俊超,高群玉
(华南理工大学轻工与食品学院,广东 广 州,510640)
以豌豆淀粉为原料,经糊化、普鲁兰酶脱支和凝沉处理,使其分子结构发生改变,制备出高含量的抗性淀粉,并研究了其理化性质。结果表明,在加酶量为300 ASPU/g,脱支时间12 h,凝沉时间24 h时,抗性淀粉含量达到最高52.66%;经糊化、脱支和凝沉处理后的样品结晶结构由C型变为B+V型;随着抗性淀粉含量的增加,其溶解度逐渐降低且均高于原淀粉,但膨胀度均低于原淀粉;消化产物随抗性淀粉含量的增加而降低。
豌豆淀粉,抗性淀粉,普鲁兰酶,消化性
抗性淀粉(resistant starch,RS)又称作抗酶解淀粉,是一种不能被人体消化吸收的淀粉。抗性淀粉在小肠中不能被酶解,在结肠中部分可以被肠道菌发酵而产生短链脂肪酸[1]。一般将抗性淀粉分为4类:RS1,物理包埋淀粉;RS2,抗性淀粉颗粒;RS3,回生淀粉;RS4,化学改性淀粉[2]。RS3是淀粉糊化后在冷却储藏过程中重结晶形成的抗性淀粉,是抗性淀粉的主要来源。
制备RS3常采用脱支法,常用的脱支法为普鲁兰酶脱支。普鲁兰酶作为淀粉加工过程中一种重要的脱支酶,能切断普鲁兰、支链淀粉和其他相关多聚糖的α-1,6糖苷键,产生更多游离的直链淀粉分子,经过静置、凝沉,被打乱的直链分子重新靠近、缠绕、延伸,形成双螺旋、折叠,从而形成新型结构[1,3]。Ratnayake等[4]在2001年通过研究不同产地的豌豆淀粉的组成、分子量以及物理化学性质,提出了豌豆淀粉的X-射线衍射图谱均呈C型晶体结构,但α-淀粉酶的水解敏感性和回生能力因产地不同而有差异,且无法通过冻融稳定性手段看出。武俊超等[5]2011年采用交联、湿热、脱支酶解3种不同方法处理豌豆淀粉来比较其抗性淀粉含量及其他性质的变化,实验表明脱支酶解能使豌豆抗性淀粉含量增加。国外学者对豌豆淀粉性质的研究较多,但对豌豆抗性淀粉的酶解制备及详细的理化性质分析并没有深入阐述,国内尚未见对豌豆抗性淀粉的酶法制备及性质研究有相关报道。
课题组采用Megazyme公司的抗性淀粉分析试剂盒,以普鲁兰酶对糊化豌豆淀粉进行脱支、凝沉处理制备抗性淀粉,考察普鲁兰酶添加量、脱支时间、凝沉时间对抗性淀粉形成过程的影响,并详细研究了制备出的不同抗性淀粉含量的豌豆淀粉的结晶性质、热力学性质、溶胀度和消化性能,以期为我国豌豆淀粉的深加工及其抗性淀粉研究开辟新思路。
1 材料与方法
1.1 实验材料和仪器
豌豆淀粉,烟台东方蛋白有限公司产品;普鲁兰酶(10000ASPU/g),广州裕立宝生物科技有限公司产品;抗性淀粉分析试剂盒,爱尔兰Megazyme公司产品;透析袋,上海精科实业有限公司产品;实验中所使用的其他试剂或药品均为分析纯。
差示扫描量热仪DSC8000,美国PE铂金埃尔默公司产品;X射线衍射仪(D/max2000vpc),日本Rigaka公司产品;漩涡混合器XW-80A,上海精科实业有限公司产品;光栅分光光度计722型,上海第三分析仪器厂产品。
1.2 抗性淀粉含量的测定方法
采用Megazyme公司的抗性淀粉分析试剂盒,根据AOAC2002.02[6]标准方法测定抗性淀粉含量。
1.3 抗性淀粉样品制备
1.3.1 普鲁兰酶添加量对抗性淀粉含量的影响
称取50 g(干基)豌豆淀粉,用pH5.2的0.2 mol/L醋酸-醋酸钠缓冲液配成8%的豌豆淀粉乳,于95℃糊化30 min后冷却至58℃,分别加入0、4、12、24、60、112、144、180、300 ASPU/g(基于淀粉干基重量)的普鲁兰酶进行脱支处理12 h,反应结束后立即升温至95℃灭酶30 min,终止反应。然后将其冷却至室温凝沉12h,用蒸馏水和95%(V/V)的乙醇洗涤至样品接近中性,置于40℃烘箱中10 h,粉碎、过筛即得样品,采用AOAC2002.02方法测定其抗性淀粉含量。
1.3.2 普鲁兰酶脱支时间对抗性淀粉含量的影响
将8%的豌豆淀粉乳糊化并冷却至58℃,添加300 ASPU/g的普鲁兰酶分别进行脱支0、4、12、24、48 h,其他处理条件同1.3.1,测定抗性淀粉含量。
1.3.3 凝沉时间对抗性淀粉含量的影响
将8%的豌豆淀粉乳糊化并冷却至58℃,添加300 ASPU/g的普鲁兰酶进行脱支12 h,分别于室温下凝沉0、6、12、24、48 h,其他处理条件同1.3.1,测定抗性淀粉含量。
试样4在两次疲劳区中间主要为钝化区(箭头),但是观察发现,在钝化区内出现了少量韧窝(箭头),韧窝与钝化区交杂在了一起;当受载为23kN时,试样裂纹尖端钝化已经饱和,并且在试样几乎整个截面均出现了少量韧窝,因此可判断该试样处于临界断裂状态,即试样4为临界试样。
1.4 淀粉颗粒热力学性质
称取一定量的淀粉样品于样品盘中,加入蒸馏水配置成质量浓度为30%淀粉乳,压紧样品盘并于室温放置12 h平衡水分,以10℃/min速率升温,在30℃保温1 min,从30℃升温到150℃。以空白样品池做参比,测定样品的热力学性质。
1.5 溶解度和膨胀度的测定
选择不同抗性淀粉含量的样品,配制质量分数为1%的淀粉乳50 mL,80℃下搅拌加热30 min,流水冷却后置于离心管中以4000 r/min离心20 min,将上层清液置于烘箱中蒸干,烘至恒重称量。计算溶解度S(%)和膨胀度P(g/g)[5,7]:
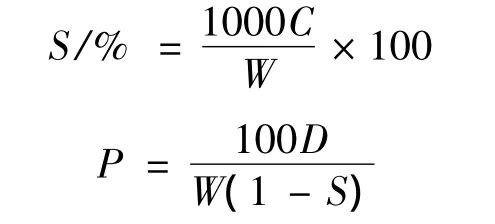
其中:C为被溶解的淀粉质量,mg;D为沉淀物质量,mg;W为淀粉干基质量,mg。
1.6 X射线衍射
将样品置于100%湿度条件下平衡水分24 h以消除水分对其结晶度的影响,取一定量平衡好的豌豆抗性淀粉均匀铺在玻璃片凹槽中置于X射线衍射仪进行测定。测试条件为:起始角4°,终止角35°,步长0.2,扫描速度5°/min,靶型Cu,电压44 kV,电流26 mA。
1.7 淀粉颗粒消化性[8-9]
用20 mL的pH5.2磷酸盐缓冲液溶解淀粉样品160 mg,混合均匀后加入透析袋,并加入10 mL酶活力260 U/mL的α-胰淀粉酶,夹紧透析袋口上下反复翻转。在烧杯中加入400 mL磷酸盐缓冲液,将透析袋放入,并置于恒温振荡水浴中,在37℃下以100 Hz的频率振荡,每隔30 min搅动溶液1次。分别在0.5、1、1.5、2、2.5、3、4和5 h时从烧杯中抽取0.5 mL渗析液,按一定比例稀释。移取2 mL稀释液到比色管中,加入5%苯酚溶液1 mL和5 mL浓H2SO4。以空白为参比,在490 nm波长下测定吸光度值,并按下式计算整个体系中的水解糖含量:

其中:M为水解糖含量,mg;A为标准曲线中查出的标准麦芽糖量,μg;L为渗析液稀释倍数;V为每次从体系中抽取的溶液体积,mL;430为在In-vitro模型整个体系的溶液体积,mL;0.001为微克换算成毫克的系数。
1.8 数据分析处理
2 结果与分析
2.1 普鲁兰酶添加量对抗性淀粉含量的影响
普鲁兰酶提高抗性淀粉含量的原理是普鲁兰酶水解淀粉分子的α-1,6糖苷键,切下支链淀粉的分支,得到更多的直链淀粉[10]。直链淀粉数量增多有利于无定形区直链淀粉分子靠近结合成牢固晶体,同时结晶区双螺旋结构使晶体排列更加有序[11],从而促进抗性淀粉的形成,提高抗性淀粉的含量。普鲁兰酶添加量对豌豆抗性淀粉含量的影响如图1所示。

图1 普鲁兰酶添加量对抗性淀粉含量的影响
由图1可以看出,豌豆抗性淀粉的含量随着普鲁兰酶添加量的增加而提高。反应初始阶段抗性淀粉含量快速提升,当普鲁兰酶添加量为144 ASPU/g时,抗性淀粉含量的增加速度有所减慢,在普鲁兰酶添加量为300 ASPU/g时,抗性淀粉含量达到最大值51.05%。其中当普鲁兰酶添加量大于144 ASPU/g时,随着酶浓度继续增加,抗性淀粉产率有增加但变化很小。其原因可能是,一方面底物的水解度取决于酶的浓度,酶浓度越高,每单位淀粉分子与酶接触的机会越多,体系所需脱支时间就越短,当酶浓度增加至300 ASPU/g,淀粉分子已充分脱支,即使加酶量继续增加,产量基本不发生变化;另一方面,由于抗性淀粉是由特定聚合度范围内的直链淀粉结合形成[10],当普鲁兰酶添加量增加,脱支酶虽然更多的切去了淀粉的支链,但游离的过短的直链淀粉无法形成抗性淀粉,从而使得抗性淀粉的含量增加趋于平缓。综合考虑添加效果及经济成本,酶浓度为300 ASPU/g时为最佳添加量。
2.2 普鲁兰酶脱支时间对抗性淀粉含量的影响
普鲁兰酶脱支时间对豌豆抗性淀粉含量的影响如图2所示。

图2 普鲁兰酶脱支时间对抗性淀粉含量的影响
从图2可以看出,在酶解脱支反应时间由0 h增加至12 h时,抗性淀粉含量逐渐升高,12 h时抗性淀粉含量达到最大值52.36%。之后继续脱支,抗性淀粉含量趋于平缓,无显著变化,这是由于随着普鲁兰酶作用时间的继续增加,淀粉分子充分脱支,产生大量过短的直链淀粉分子,不易形成有序牢固的晶体结构。Shi[12]等也认为合适的链长对于结晶和双螺旋的形成是有利的,过短的链分子则会起到抑制作用,不利于抗性淀粉的形成。因此继续延长普鲁兰酶脱支时间,抗性淀粉含量基本不发生变化,所以普鲁兰酶最佳脱支时间为12 h。
2.3 凝沉时间对抗性淀粉含量的影响
凝沉时间对豌豆抗性淀粉含量的影响如图3所示。由图3可知,淀粉凝沉时间为0 h时,抗性淀粉含量相对较低,随着凝沉时间延长,抗性淀粉含量有所增加,在凝沉24 h时含量达到最大为52.66%,之后抗性淀粉的含量随凝沉时间的延长逐渐降低。凝沉初期,对凝沉淀粉结晶起主要作用的是直链淀粉,其凝沉速度快,抗性淀粉含量快速增加。随后支链淀粉也相互缔合发生凝沉,但抗性淀粉含量并不是无限制增加的。一般来说,时间的延长应有利于结晶的形成,从而抗性淀粉的含量提高[13]。但实验结果表明,当凝沉时间增加至48 h时,抗性淀粉含量降到42.40%。抗性淀粉含量降低可能有两个因素:一是凝沉时间过长导致样品中的酸度发生改变,偏酸或者偏碱都不利于老化淀粉的形成,也由此衍生出不利的菌种出现[10];另一方面,当淀粉水分含量低于10%时淀粉不易凝沉[14],长时间的凝沉使样品的水分含量发生改变,不利于缔合凝沉,同时大量的支链淀粉也阻碍了直链淀粉的进一步靠近形成晶体。因此,豌豆抗性淀粉的最佳凝沉时间为24 h。

图3 凝沉时间对抗性淀粉含量的影响
从脱支酶解重结晶处理后的淀粉中选取一组不同抗性淀粉含量的样品进行性质测定,分别标记为R1(RS=34.51),R2(RS=38.96),R3(RS=45.78),R4(RS=47.38),R5(RS=52.66)。
2.4 淀粉颗粒热力学性质
不同豌豆抗性淀粉样品的热力学性质参数如表1所示。

表1 不同样品的热力学性质参数
从表1可以看出,随着抗性淀粉含量的增加,糊化起始温度To逐渐变高,说明抗性淀粉含量越高的样品越难糊化。和原淀粉相比,所有抗性淀粉样品的糊化起始温度To、峰值温度TP、终止温度TC和糊化焓ΔH均有明显增加,这是由于脱支酶解后抗性淀粉含量增加,淀粉的颗粒结构中直链淀粉部分增加,直链淀粉较支链淀粉更难以糊化,所以脱支酶解后糊化温度和糊化焓增加,糊化变得困难[5]。峰值温度TP和糊化焓ΔH随着抗性淀粉含量的升高,呈现先升高再降低的趋势。样品R3在所有样品中峰值温度(103.69℃)和糊化焓(17.55J/g)最高,此时样品的热稳定性最好。Tc-To反映着淀粉颗粒内结晶体的差异程度,Tc-To越大表明差异程度越大,反之亦然,这与Gao等[15]的研究结果一致。由表1可知,随着样品的抗性淀粉含量的增加,Tc-To测定值两边低中间高。这说明,经过普鲁兰酶脱支处理重结晶后,可能是由于形成部分不完美晶体,使结晶体的差异程度增加,Tc-To增大;但随着抗性淀粉含量的继续增加,形成过多的短直链淀粉重排形成的晶体结构紧密有序,大小和完善程度差异变小,故Tc-To反而出现减少趋势。
2.5 抗性淀粉溶解度和膨胀度
在淀粉加工应用过程中,吸水性是一个重要的性质指标,一般用溶解度和膨胀度衡量淀粉在水中发生溶胀现象时体积变化的大小。不同抗性淀粉含量样品的溶解度和膨胀度如图4和图5所示。

图4 不同抗性淀粉含量样品的溶解度
由图4可知,经普鲁兰酶脱支降解后的抗性淀粉样品,其溶解度大大高于原淀粉,这是因为脱支作用使得豌豆淀粉的支链淀粉被酶解,短直链含量增加,致使其溶解度增加。但随着抗性淀粉含量的升高,溶解度逐渐降低,可能是因为抗性淀粉的双螺旋结构紧密,持水能力差等特性,含量越高就越难溶于水。由图5可知,抗性淀粉样品的膨胀度均低于原淀粉,且随着抗性淀粉含量的增加,膨胀度逐渐降低。直链淀粉含量增加,支链淀粉减少是样品膨胀度降低的主要原因[5]。Kwang Yeon Lee等[16]研究了普鲁兰酶处理大米淀粉后的理化性质,其研究表明,随着普鲁兰酶添加量的增加其膨胀度逐渐降低,淀粉的膨胀度与支链淀粉的结构和直链淀粉含量有关。

图5 不同抗性淀粉含量样品的膨胀度
2.6 X-射线衍射
豌豆原淀粉和不同抗性淀粉样品的X射线衍射图见图6。

图6 豌豆原淀粉和样品的X-射线衍射图
由图6可知,豌豆原淀粉在15.1°、17.2°和23.0°处有较强的衍射峰出现,在5.6°、18.0°处有较弱的衍射峰出现,属于典型的C型结晶结构。普鲁兰酶脱支重结晶处理后,与原淀粉相比,X-射线衍射图谱显示出所有抗性淀粉样品的结晶结构变化在5.6°、14.8°、16.9°、19.3°、22.2°、23.9°处衍射峰强度明显增大,呈现出更密集和尖锐的峰,转变为B+V型结晶结构[17-18]。结晶结构由C型转变为B+V型,可能是酶解后低温凝沉易形成B型淀粉,脱支酶解过程中的短直链与淀粉本身的脂质形成了直链淀粉-脂质复合物,显示出V型结晶结构。Kwang Yeon Lee等[16]采用普鲁兰酶对大米淀粉进行处理,在较大普鲁兰酶的添加量时,低温凝沉(40℃)容易形成B型结晶结构,而高温凝沉(95℃)则更有利于A型结晶结构的形成。
2.7 淀粉颗粒消化性
不同豌豆抗性淀粉样品的消化产物量如图7所示。由图7可见,随着消化时间延长,所有样品的消化产物量均增加。随抗性淀粉含量增加,抗性淀粉样品的消化产物量不断降低且均低于原淀粉。在0~3 h内,所有样品消化产物量明显升高;3 h时消化产物量趋于稳定;此后延长消化时间,消化产物量的增加速度变慢。0~3 h属于反应前期,此时溶液中α-胰淀粉酶酶浓度最大,且由于α-胰淀粉酶为内切酶,可以无规则的水解淀粉分子中的α-1,4糖苷键,所以α-淀粉酶能与淀粉颗粒充分接触,消化产物量不断升高[13];反应3 h后,淀粉分子被水解成过小的分子链,淀粉分子和酶之间的结合位点减少,从而不利于消化的继续进行,使得其消化产物的量逐渐趋于平缓。由图7还可看出随抗性淀粉含量的增加其消化产物量逐渐降低,这与Pongjanta[19]等的研究成果一致。因此RS含量高的样品,体外消化性越低,抗酶解力也越强。

图7 不同豌豆抗性淀粉样品的消化产物量
3 结论
研究表明,在加酶量为300 ASPU/g,脱支时间12 h,凝沉时间24 h时,产生的抗性淀粉含量最高为52.66%。经过糊化、脱支和凝沉的豌豆抗性淀粉样品的X-射线衍射图谱,结晶结构由C型转变为B+V型;脱支降解后得到的抗性淀粉样品,其溶解度逐渐降低但其均高于原淀粉,膨胀度均低于原淀粉;消化产物随抗性淀粉含量的增加而降低。本课题组使用酶解法制备高含量的豌豆抗性淀粉,为豌豆抗性淀粉的深入研究提供了适宜的实验条件和理论基础,在提高豌豆资源的综合利用率方面具有重要的现实意义。
[1]蹇华丽,高群玉,梁世中.抗性淀粉的酶法研制[J].食品与发酵工业,2002,28(5):6-9.
[2]刘亚伟,张杰.抗性淀粉制备工艺研究[J].食品与机械,2003,(1):19-20.
[3]Lin J H,Chang Y H.Effects of type and concentration of polyols on the molecular structure of corn starch kneaded with pullulanase in a Farinograph[J].Food Hydrocolloids,2006,20(2-3):340-347.
[4]Ratnayake W S,Hoover R,Shahidi F,et al.Composition,molecular structure,and physicochemical properties of starches from four field pea(Pisum sativum L.)cultivars[J].Food Chemistry,2001,74(2):189-202.
[5]武俊超,高群玉,梁楚琴.采用不同方法制备豌豆抗性淀粉及其性质研究[J].食品与发酵工业,2011,37(9):119-123.
[6]AOAC 2002.02.Official methods of analysis ISI[S].
[7]Leach H W,McCowen L D,Schoch T J.Structure of the starch granule(I):swelling and solubility patterns of various starches[J].Cereal Chemistry,1959,36(4):534-544.
[8]高群玉,武俊超,李素玲.湿热处理对不同直链淀粉含量的玉米淀粉性质的影响[J].华南理工大学学报:自然科学版,2011,39(9):1-6.
[9]温其标,卢声宇.羟丙基淀粉消化性能的研究[J].华南理工大学:自然科学版,2002,30(11):134-137.
[10]史苗苗,高群玉.脱支蜡质玉米抗性淀粉的制备及性质[J].食品与发酵工业,2010,36(8):31-35.
[11]Perera C,Hoover R,Martin A M.The effect of hydroxypropylation on the structure and physicochemical properties of native,defatted and heat-moisture treated potato starches[J].Food Research International,1997,30(3-4):235-247.
[12]Shi M M,Gao Q Y.Physicochemical properties,structure and in vitro digestion of resistant starch from waxy rice starch[J].Carbohydrate Polymers,2011,84(3):1151-1157.
[13]史苗苗,高群玉.抗性淀粉直链淀粉含量测定及消化性研究[J].食品工业科技,2011,32(5):105-112.
[14]毛羽扬.淀粉类食物的老化及影响因素[J].粮食科技与经济,1999,24(5):34-36.
[15]Gao Q Y,Li S L,Jian H L,et al.Preparation and properties of resistant starch from corn starch with enzymes[J].African Journal of Biotechnology,2011,10(7):1186-1193.
[16]Lee K Y,Lee S,Lee H G.Effect of the degree of enzymatic hydrolysis on the physicochemical properties and in vitro digestibility of rice starch[J].Food Science and Biotechnology,2010,19(5):1333-1340.
[17]Song Y,Jane J.Characterization of barley starches of waxy,normal,and high amylase varieties[J].Carbohy-drate Polymers,2000,41(4):365-377.
[18]Leong Y H,Karim A A.Norziah M H.Effect of pullulanase debranching of sago(Metroxylon sagu)starch at subgelatinization temperature on the yield of resistant starch[J].Starch-Starke,2007,59(1):21-32.
[19]Pongjanta,J,Utaipattanaceep,A,Naivikul,O,et al.Debranching enzyme concentration effected on physicochemical properties and alpha-amylase hydrolysis rate of resistant starch type III from amylose rice starch[J].Carbohydrate Polymers,2009,78(1):5-9.
ABSTRACTThe pea starches were used as raw materials.With treatments of gelatinization,pullulanase debranching and retrogradation,the structure of pea starches began to change,and the much higher content of resistant starches was produced.Moreover,their physicochemical properties were studied.The results indicated that,after addition of 300ASPU/g of pullulanase,the maximum purity of RS reached 52.66%by debranching for 12 hours and retrogradating for 24 hours.At the same time,crystal structure of the sample changed from C to B+V by gelatinization,debranching and retrogradation.It was also found that the solubilities of samples,which were higher than that of native starch,decreased gradually with the increasing content of resistant starches,while the dilatations of samples were lower than that of native starch.The amount of digestion products decreased with the increasing content of resistant starches.
Key wordspea starch,resistant starch,pullulanase,digestibility
Preparation and Characterization of Pea Resistant Starches with Pullulanase
Wang Lin,Wu Jun-chao,Gao Qun-yu
(College of Light Industry and Food Science,South China University of Technology,Guangzhou 510640,China)
硕士研究生(高群玉教授为通讯作者,E-mail:qygao@scut.edu.cn)。
*广东省部产学研结合项目(2009B090300274);中小企业技术创新基金(10C26216305366)
2012-04-26,改回日期:2012-05-15
