高压脉冲电场作用下亚致死酵母的存在与检测*
2012-09-12顾艳洁赵伟杨瑞金闫文
顾艳洁,赵伟,杨瑞金,闫文
1(江南大学 食品学院,江苏 无 锡,214122)
2(江南大学食品科学与工程国家重点实验室,江苏无锡,214122)
高压脉冲电场作用下亚致死酵母的存在与检测*
顾艳洁1,赵伟2,杨瑞金2,闫文1
1(江南大学 食品学院,江苏 无 锡,214122)
2(江南大学食品科学与工程国家重点实验室,江苏无锡,214122)
为探究高压脉冲电场(PEF)对酿酒酵母的灭菌机理,研究了从亚细胞水平揭示PEF处理下的损伤亚致死酵母细胞的存在及产生规律。采用pH7.2的磷酸盐缓冲液(PBS)模拟体系,30 kV/cm电场强度下循环处理100~500 μs,通过选择性培养基与非选择性培养基菌落计数对PEF处理前后亚致死酵母细胞进行了研究。结果显示,亚致死酵母的临界渗透压为4%NaCl,PEF处理后,酿酒酵母的亚致死率可达到4.5个对数,亚致死细胞数量达到1.5个对数,且亚致死程度随处理时间的延长而加大。选择性培养基可用于PEF处理过程中亚致死细胞的定量检测。
高压脉冲电场(PEF),酿酒酵母,亚致死细胞,选择性培养基
高压脉冲电场杀菌(PEF)是一种很有工业化前景的非热杀菌技术,以其良好的杀菌效果和最大限度保持食品营养成分的特点而备受瞩目。PEF的杀菌机理是学者们的研究热点,目前人们就PEF对微生物的杀菌效果已有了较深入的研究,但只局限于PEF致死微生物。研究结果表明,PEF处理对微生物的营养体细胞均有较好的杀灭作用[1]。PEF的杀菌作用与其对微生物细胞膜的影响密切相关。当微生物被置于高压脉冲电场中时,细胞膜会被破坏,从而导致细胞内容物渗出,引起细胞死亡[2-3]。最近研究结果表明,PEF除杀死一部分微生物外,还会形成一定比例的损伤亚致死细胞[4-5],亚致死微生物可在适宜的环境下修复,恢复其繁殖能力,对食品安全及PEF处理食品的货架期造成很大影响。Christine证实了亚致死微生物的存在[6],Somolinos等人[7]研究了酿酒酵母经PEF处理后亚致死损伤细胞的修复等问题,证明PEF处理后酿酒酵母产生一定程度的亚致死损伤,其修复程度取决于处理介质的pH和储存介质的性质。
酿酒酵母(S.cerevisiae)是液体食品中的常见污染菌种,并会因为酒精发酵和CO2气体的产出而引起饮料的腐败,同时它也是基础生物学研究和食品工业中广泛存在的菌种,是良好的研究模型。本文应用PEF处理酿酒酵母细胞,通过选择性培养基与非选择性培养基菌落计数来验证亚致死细胞的存在,确定了亚致死酵母细胞的临界渗透压,并对亚致死细胞的数量进行了统计,分析PEF处理对亚致死酵母的产生规律。
1 材料与方法
1.1 实验材料与仪器
酿酒酵母菌,江南大学食品酶学实验室提供,菌种编号C-03。
OSU-4L型实验室规模PEF连续处理设备,俄亥俄州州立大学,美国;XSW-CJ-2A标准型净化工作台,吴江市绿叶空调净化有限公司;CT14D型台式高速离心机,上海天美生化仪器设备工程有限公司;DRP-9082型电热恒温培养箱,上海森信实验仪器有限公司;LDZX-50KBS型立式压力蒸汽灭菌锅,上海申安医疗器械厂;QYC2102-C型恒温培养摇床,上海新苗医疗器械有限公司。
1.2 实验方法
1.2.1 微生物培养与接种
本实验采用酿酒酵母作为目标菌种,由酵母浸出粉胨葡萄糖(YPD)琼脂斜面培养基移至YPD液体培养基,30℃下摇床200 r/min培养16 h至对数生长期,菌体浓度达到108~109CFU/mL。将上述培养液于8000 r/min离心6 min,然后用电导率约为2000 μs/cm,pH7.2的PBS缓冲液重悬,使菌体浓度达到106~107CFU/mL。
1.2.2 高压脉冲电场杀菌设备
采用实验室规模连续PEF处理设备(OSU-4L,美国俄亥俄州立大学)进行,脉冲电场为双极方形波脉冲电场,管路清洗采用4%NaOH、10%市售次氯酸消毒液和无菌水进行。
1.2.3 高压脉冲电场杀菌参数的选择
实验选择6个连续处理腔,选择电场强度为30 kV/cm,总处理时间为100、200、300、400、500 μs(处理时间采用循环方式),脉冲宽度2 μs,脉冲频率200 Hz;循环式冷却水浴的温度设定为15℃。
电场强度E和总处理时间t计算方法如下:
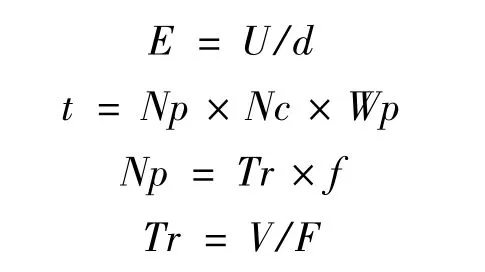
式中,U为电压,kV;d为电极间距,0.29 cm;Np为单个处理腔内接收的脉冲数;Nc为处理腔个数,6;Wp为脉冲宽度,s;Tr为停留时间,s;f为脉冲频率,Hz;V为单个腔体积,0.012 cm3;F为物料流速,mL/s。
1.2.4 PEF处理对酿酒酵母菌致死率的影响
根据GB/T4789.2-2003方法,对PEF处理前后的样品进行菌落平板计数。杀菌效果采用致死率来表示,致死率计算公式:
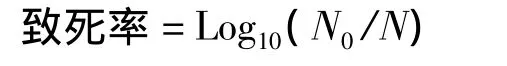
式中,N为PEF处理后的微生物数,CFU/mL;N0为PEF处理前的微生物数,CFU/mL。
培养基选用YPD固体培养基,NaCl的浓度为0%,即非选择性培养基,30℃下培养24 h后计数。
1.2.5 PEF处理对酿酒酵母菌亚致死率的影响
之前的研究中已经有通过非选择性和选择性琼脂培养基对非热杀菌处理后的微生物进行计数对微生物的损伤程度进行评估的实验[8]。Perni等[9]通过向培养基中加入2种不同浓度的NaCl对PEF作用下大肠杆菌和鼠伤寒杆菌分别进行培养,找到了两种菌的临界渗透压并对亚致死细胞数量进行了检测,Hyun-Gyun Yuk等[10]采用同样的方法研究了超高压CO2对于苹果酒中乳酸杆菌的亚致死损伤效果。向培养基中添加一定浓度的NaCl形成适当渗透压对非热处理后的微生物进行培养计数已成为亚致死微生物检测的一种有效手段。
本文通过向YPD固体培养基中添加不同浓度的NaCl作为选择性培养基对PEF处理前后酵母细胞进行培养以找到亚致死酵母的临界渗透压,NaCl的浓度梯度选择2%、3%、4%、5%,30℃下培养48 h后计数。亚致死率计算公式:

式中,N’:PEF处理后的选择性培养基中微生物数,CFU/mL;N0:PEF处理前的微生物数,CFU/mL。
2 结果与讨论
2.1 PEF不同处理时间对酿酒酵母的致死率影响
图1为PEF不同处理时间对PBS缓冲液体系中酿酒酵母致死率的影响。酿酒酵母的致死率是处理时间的函数,随着处理时间的增加而愈加显著,当处理时间由100 μs上升至500 μs,电场强度为30 kV/cm时,PBS缓冲体系中的酿酒酵母菌落数下降了3.3个数量级。

图1 不同处理时间对酿酒酵母细胞致死率的影响
在特定的环境条件下,数学模型已成为描述和预测食源性微生物的生长、存活以及灭活反应的重要工具[11]。由图1可知,PEF对酿酒酵母的致死作用较好地符合一级动力学模型(R2>0.97),30 kV/cm场强作用下PEF对酿酒酵母的杀菌动力学常数K为6.3×10-3(1/μs)。这与Marsellés-Fontanet等[11]研究的酵母细胞在橘汁中的杀灭动力学结果较为接近。
2.2 PEF不同处理时间对酿酒酵母的亚致死率影响
本实验选用的几种NaCl浓度下酿酒酵母的亚致死率随处理时间的变化趋势与致死率基本一致,且各个时间点处PEF对于酵母细胞的亚致死率均高于致死率,证明PEF处理后有亚致死酵母细胞的存在。当NaCl浓度达到4%时,30 kV/cm场强作用下PEF对酿酒酵母的亚致死杀菌动力学常数为8.2×10-3(1/μs),较其他两组相比显著高于未添加NaCl组的致死杀菌动力学常数6.3×10-3(1/μs)。NaCl浓度为5%时,平板中菌落数过小无法计数,即4%NaCl浓度为酿酒酵母细胞的临界渗透压,综合考虑可采用4%NaCl浓度的选择性培养基进行PEF处理后亚致死酿酒酵母亚致死细胞数量的监测。

图2 PEF在不同NaCl浓度下对酿酒酵母的亚致死杀菌动力学
由添加NaCl浓度为4%的选择性培养基30℃培养48 h后菌落计数情况可知,当处理时间达到500 μs时,酵母的亚致死率达到了4.5个数量级,此时PEF对酿酒酵母的亚致死作用也较好的符合一级动力学模型(R2>0.97)。不同时间强度的PEF处理条件下均有亚致死细胞产生,并且亚致死细胞产生数量与PEF处理强度正相关。
2.3 PEF不同处理时间对酿酒酵母的亚致死量影响
亚致死细胞的数量在一定程度上可以通过选择性培养基与非选择性培养基计数的差值估算。亚致死细胞只有在低NaCl浓度下才能修复,其数量增加的速度远大于总修复量[9]。经过同一场强下不同时间PEF处理后,样品酵母细胞中的亚致死细胞数量呈现递增趋势(图3),酿酒酵母经PEF处理后产生了1个对数的亚致死细胞,当处理时间达到500 μs时,酵母亚致死细胞的数量达到了1.5个对数,证明PEF对酵母细胞的伤害是经过一定程度的积累造成的,且酵母细胞损伤的程度大于其修复的程度。

图3 不同处理时间对酿酒酵母细胞亚致死细胞数量的影响
PEF对微生物的作用机制目前尚不完全清楚,关于脉冲电场杀菌机理的解释,人们提出了多种学说,其中以“细胞膜的电穿孔”和“细胞膜的电崩溃”这两种模型被广泛接受。其中“电穿孔”模型即细胞膜是脉冲电场作用的关键位点,瞬间高压脉冲电场可作用于细胞膜脂质双分子层,在细胞膜上形成小孔使细胞膜通透性增强,胞内物质外溢导致细胞死亡[2-3]。García等[13]和Perni等[9]报道,PEF对大肠杆菌和沙门氏菌的致死作用是由于PEF对微生物细胞的损伤积累所致。PEF处理后会产生亚致死微生物已被证实,目前对于亚致死细胞的检测主要有两种手段,其一是通过流式细胞仪结合荧光染色技术对亚致死细胞数量进行实时监测[14],其二就是本文中用到的通过找到亚致死细胞的临界渗透压进行选择性培养以确定其产生数量。亚致死微生物在适当环境下可自行修复,会对食品安全及货架期产生威胁,其进一步灭菌是提高PEF杀菌效果、延长PEF非热杀菌产品货架期的重要手段。
3 结论
(1)经过对酿酒酵母亚致死细胞不同渗透压条件下培养后确定其临界渗透压条件为4%NaCl。
(2)经30 kV/cm场强下循环处理500 μs后,酵母细胞的致死量可达到3.3个对数,亚致死量可达4.5个对数,PEF对酿酒酵母致死作用及亚致死作用的杀菌动力学常数均较好的符合一级动力学模型,一定处理强度下可产生1.5个对数的亚致死酵母细胞。
(3)亚致死细胞数量随着处理时间的延长而增加,PEF对酵母细胞的致死作用是经过逐渐的损伤积累造成的。
[1]赵伟,杨瑞金.高压脉冲电场对食品中微生物、酶及组分影响的研究进展[J].食品与机械,2010,26(3):153-157.
[2]Min S,Jin ZT,Zhang QH.Commercial scale pulsed electric field processing of tomato juice[J].Journal of Agricultural and Food Chemistry,2003,51(11):3338-3344.
[3]Evrendilek GA.Inactivation kinetics of pathogenic microorganisms by pulsed electric fields[D].The Ohio State University,2002.
[4]Zou Tiejun,Liu Xiang,Ding Shangshu,et al.Evaluation of sperm mitochondrial function using rh123/PI dual fluorescent staining in asthenospermia and oligoasthenozoospermia[J].Journal of Biomedical Research,2010,24(5):404-410.
[5]Ritz M,Tholozan J L,Federighi M,et al.Morphologicaland Physiological Characterization of Listeria monocytogenes Subjected to High Hydrostatic Pressure[J].Applied and Environmental Microbiology,2001,67(5):2240-2247.
[6]Christine E R Dodd.Suicide through stress:A bacterial response to sub-lethal injury in the food environment[J].International Journal of Food Microbiology,2007,120(1-2):46-50.
[7]Somolinos M,Mañas P,Condón S,et al.Recovery of Saccharomyces cerevisiae sublethally injured cells after Pulsed Electric Fields[J].International Journal of Food Microbiology,2008,125(3):352-356.
[8]Kalchayanand N,Sikes A,Dunne C P,et al.Factors influencing death and injury of foodborne pathogens by hydrostatic pressure-pasteurization[J].Food Microbiology,1998,15(2):207-214.
[9]Perni S,Chalise P R,Shama G,et al.Bacterial cells exposed to nanosecond pulsed electric fields show lethal and sublethal effects[J].International Journal of Food Microbiology,2007,120(3):311-314.
[10]Hyun-Gyun Yuk,David J Geveke.Nonthermal inactivation and sublethal injury of Lactobacillus plantarum in apple cider by a pilot plant scale continuous supercritical carbon dioxide system[J].Food Microbiology,2011,28(3):377-383.
[11]Jonathan Mosqueda-melgar,Pedro elez-mart'inez,Effects of Pulsed Electric Fields on Pathogenic Microorganisms of Major Concern in Fluid Foods:A Review[J].Food Science and Nutrition,2008,48(8):747-759.
[12]Á Robert Marsellés-Fontanet,Anna Puig,Paola Olmos,et al.Optimising the inactivation of grape juice spoilage organisms by pulse electric fields[J].International Journal of Food Microbiology,2009,130(3):159-165.
[13]García D,Manãs P,Gómez N,et.al.Biosynthetic requirements for the repair of sublethal membrane damage in Escherichia coli cells after pulsed electric fields[J].Journal of Applied Microbiology,2006,100(3):428-435.
[14]Skowronek P,Krummeck G,Haferkamp O,et al.Flow cytometry as a tool to discriminate respiratory competent and respiratory-deficient yeast cells[J].Current genetics,1990,18(3):265-267.
ABSTRACTTo explore the sterilization mechanism of Saccharomyces cerevisiae caused by pulsed electric field(PEF),the existence and production patterns of sub-lethal yeast cells under PEF treatment were revealed.Using phosphate buffer(PBS)at pH7.2 as model system,S.cerevisiae cells were processed under 30kV/cm electric field strength from 100μs to 500μs.Sub-lethal S.cerevisiae cells were counted respectively after incubation in selective medium and non-selective medium.The results showed that the critical osmotic pressure of sub-lethal S.cerevisiae were 4%NaCl.After PEF treatment,S.cerevisiae became to be sub-lethal with reductions to 4.5 Log units,and the number of sub-lethal cell were 1.5 Log,and the degree of sub-lethal increased with the treatment time increased.Selective medium can be used in quantitative detection of sub-lethal cells during PEF treatment.
Key wordspulsed electric field(PEF),Saccharomyces cerevisiae,sub-lethal cells,selective medium
Existence and Detection of Sub-lethal S.cerevisiae Cells Under Pulsed Electric Field Treatment
Gu Yan-jie1,Zhao Wei2,Yang Rui-jin2,Yan Wen1
1(School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
2(State Key Laboratory of Food Science&Technology and School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
硕士研究生(杨瑞金教授为通讯作者,E-mail:yrj@jiangnan.edu.cn)。
*国家自然科学基金(31000829);国家“十二五”863计划项目(2011AA100801-02);江苏省自然科学基金(BK2010148)
2012-03-27,改回日期:2012-05-21
