高效毛细管电泳法测定葛根及其制剂脑得生片中葛根素和大豆苷元含量
2012-09-12刘荔贞双少敏
刘荔贞,冯 锋,2*,双少敏
(1.山西大学化学化工学院,山西太原 030006;2.山西大同大学化学与化工学院,山西大同 037009)
高效毛细管电泳法测定葛根及其制剂脑得生片中葛根素和大豆苷元含量
刘荔贞1,冯 锋1,2*,双少敏1
(1.山西大学化学化工学院,山西太原 030006;2.山西大同大学化学与化工学院,山西大同 037009)
利用高效毛细管电泳法 (HPCE),配以二极管阵列检测器测定葛根及其制剂脑得生片中葛根素和大豆苷元的含量。以未涂层弹性石英管柱(57 cm×75μm,有效长度50 cm)为分离通道,60 mmol/L硼砂-硼酸(pH 9.0)为电泳缓冲溶液,分离电压为25 kV,毛细管柱温25℃,检测波长254 nm。葛根素和大豆苷元浓度与峰面积分别在0.2~1.2 mg/mL和0.1~0.6mg/mL范围内呈良好的线性关系,检出限 (S/N=3)分别为27.5 ng/mL和12.7 ng/mL,该方法简便、快捷、灵敏,可用于葛根和脑得生片的快速常规检测。
高效毛细管电泳;葛根素;大豆苷元;葛根;脑得生片
葛根是豆科植物葛的干燥根,具有解痉退热、生津透疹和升阳止泻的功效,用于外感发热头痛、项背强痛和热痢等的治疗[1]。葛根异黄酮为其有效成分,葛根中含有的两种异黄酮葛根素和大豆苷元在临床已用于治疗药物[2]。脑得生片收载于《中国药典》2005年版一部,由三七、川芎、红花、葛根和山楂5味中药精制而成,具有活血化瘀、疏通经络、醒脑开窍之功效,用于脑动脉硬化、缺血性中风及脑出血后遗症等病的治疗。现代研究表明,葛根素和大豆苷元是治疗心脑血管疾病的活性成分。对于葛根素和大豆苷元含量的测定方法,文献中报道的有高效液相色谱法[3-5]、反相高效液相色谱法[6-11]、近红外光谱法[12]、荧光光度法[13]、流动注射化学发光法[14]、薄层扫描法[15-16]等。脑得生片原质量标准中无葛根素和大豆苷元的含量测定。本文采用HPCE法对葛根和脑得生片中葛根素和大豆苷元的含量进行了测定,此法具有分离效率高、分析速度快、操作成本低、试剂用量小等优点,为进一步控制葛根及其制剂的质量提供了科学依据。
1 实验部分
1.1 仪器和试剂
P/ACEMDQ型毛细管电泳仪、二极管阵列检测器 (美国Beckman公司),融熔石英毛细管,AP250D电子天平(美国ohaus公司),PHS-25B酸度计(上海大中分析仪器厂),B3200S超声波清洗器(上海必能信超声有限公司),TFL-16C台式高速离心机(菏泽石油化工学校仪器设备厂)。
硼砂、硼酸 (分析纯,天津市化学试剂三厂),氢氧化钠 (分析纯,天津市北方天医化学试剂厂),甲醇 (色谱纯,天津市四友精细化学品有限公司),葛根素对照品、大豆苷元对照品(阿拉丁试剂公司),葛根(当地药材市场),脑得生片(哈尔滨华雨制药集团有限责任公司),实验用水均为去离子水。
1.2 测试溶液的制备
1.2.1 对照品溶液的制备
称定葛根素对照品10mg,大豆苷元对照品5mg,用甲醇分别定容成浓度为0.40mg/mL的葛根素对照品溶液和0.32 mg/mL的大豆苷元对照品溶液,备用。
1.2.2 样品溶液的制备
称取0.2 g葛根生药粉置具塞瓶中,加甲醇50 mL,称定质量,超声处理30 min,放冷,加甲醇补足质量,高速离心 (12 000 r/min)10 min,取上清液作为样品溶液。
取脑得生10片,除去糖衣,称取0.5 g置具塞瓶中,加甲醇40mL,称定质量,超声处理30min,放冷,加甲醇补足质量,高速离心(12 000 r/min)10min,取上清液作为样品溶液。
1.3 操作条件
运行缓冲溶液:60 mmol/L硼砂-硼酸缓冲溶液,操作电压25 kV,极性由正到负,检测波长为254 nm,柱温为25℃,采用压力进样,进样时间为5 s。
毛细管冲洗方法:开机后用0.1mol/L氢氧化钠溶液冲洗2min,水2min,运行缓冲溶液3 min。每次测定之间用运行缓冲溶液冲洗3min。
2 结果与讨论
2.1 毛细管电泳分离条件的选择
本实验选用60mmol/L硼砂-硼酸缓冲溶液(pH 9.0)为运行缓冲液。因为在碱性溶液中硼酸会与葛根素中的邻二醇羟基形成配合阴离子而增加溶解度,减少了因吸附造成的峰拖尾的影响。
实验发现随着分离电压的升高,峰电流增大,迁移时间变短;随着电压降低,迁移时间延长,峰变宽,峰形变差。 综合考虑分离度、噪音、焦耳热、峰形及迁移时间等因素,选择分离电压为25 kV。
2.2 葛根素和大豆苷元的紫外吸收光谱
用二极管阵列检测器在线检测对照品和样品中葛根素和大豆苷元在硼砂-硼酸缓冲溶液中的光谱,确定葛根素和大豆苷元在254 nm处均有最大吸收,故采用检测波长254 nm。
2.3 方法的可行性
取混合对照品溶液、样品溶液,在本实验的操作条件下测得3种溶液的电泳图谱,见图1。


图1 葛根(A),脑得生片(B)和对照品溶液(C)的电泳图
2.4 回归方程、线性范围及检出限
配制一系列不同浓度葛根素和大豆苷元的混合标准溶液,在选定的条件下测定,葛根素和大豆苷元浓度分别在0.2~1.2mg/mL和0.1~0.6mg/mL范围内与峰面积呈良好的线性关系,线性回归方程分别为y=523 079 x+266.18(葛根素,r=0.999 5)和y=598 369 x+284.6 (大豆苷元,r=0.999 4),其中y为峰面积,x为被测物浓度(mg/mL),r为回归系数。葛根素和大豆苷元的检出限(S/N=3)分别为27.5 ng/mL和12.7 ng/mL。
2.5 加样回收试验
向已知含量的葛根及脑得生样品中,加入葛根素和大豆苷元对照品,照样品处理方法处理并测定,结果见表1。

表1 加样回收实验结果
2.6 样品含量测定结果
取不同批次的脑得生片及葛根,依法测定,结果见表2
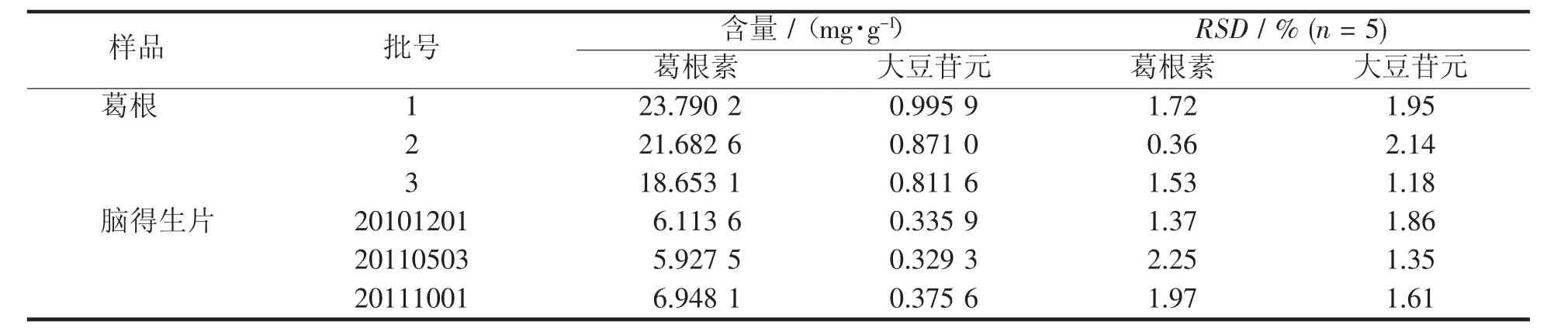
表2 样品含量测定结果
3 结论
本实验用高效毛细管电泳法,配以二极管阵列检测器测定葛根及其制剂脑得生片中葛根素和大豆苷元的含量,具有样品处理简单、灵敏度高、分辨率高、分析速度快、操作成本低及试剂用量小等优点。为葛根药材的真伪辨别、品质的鉴别及其制剂的质控和检验提供了一种新方法。
[1]中华人民共和国卫生部编辑委员会.中华人民共和国药典[M].北京:化学工业出版社,2000:273-274.
[2]孙文基,绳金房.天然活性成分手册[M].北京:中国医药科学技术出版社,1998.
[3]Yang G G,Liu P,Qu X L,et al.The simultaneous separation and determination of six flavonoids and troxerutin in rat urine and chicken plasma by reversed-phase high-performance liquid chromatography with ultraviolet-visible detection [J].Chromatogr B,2007,856:222-228.
[4]隆颖,于永州,朱淼.HPLC测定葛根宝软胶囊中葛根素和大豆苷元的含量[J].中国医药导报,2007,27(4):101-102.
[5]张玉莲,鲁传华,吴鸿飞.HPLC测定葛根素微乳中葛根素的含量[J].安徽中医学院学报,2007,26(2):45-46.
[6]Yu B S,Yan X P,Zhen G B,et al.RP-HPLC determination of puerarin in Chinese traditionalmedicinal preparations containing puerarin[J].JPharm Biomed Anal,2002,30:843-849.
[7]吴向阳,仰玲玲,仰榴青,等.RP-HPLC法同时测定野葛的根、茎和叶中葛根素、大豆苷和大豆苷元的含量[J].食品科学,2009,30(14):248-252.
[8]周红英,王建华,闫凤云.RP-HPLC分离测定甘葛藤茎叶中葛根素、大豆苷和大豆苷元的含量[J].中国中药杂志,2007,32(10):937-939.
[9]王黎,张小清,苗延青.RP-HPLC快速同时测定粉葛中葛根素和大豆苷元的含量[J].光谱实验室,2011,28(3):1431-1433.
[10]宋丽军,谭晓梅,罗佳波.RP-HPLC同时测定葛根异黄酮提取部位中葛根素、大豆苷、染料木苷和大豆苷元的含量[J].药物分析杂志,2009,29(6):968-970.
[11]何建涛,石志红,赵美萍,等.反相高效液相色谱法测定葛根素和大豆苷元[J].分析化学,2004,32(4):519-521.
[12]苏碧茹,叶彬,耿春贤,等.近红外光谱法快速测定消渴丸药粉中葛根素含量[J].中国中药杂志,2011,36(6):672-675.
[13]赵慧春,冯瑞琴,方昕.荧光光度法测定愈风宁心片中葛根素含量的研究[J].分析测试学报,1997,16(2):36-39.
[14]Zhang Q L,Myint A,Liu L J,et al.Flow injection-chemiluminescence determination of puerarin in pharmaceutical preparations [J].JPharm Anal,2004,36:587-592.
[15]闵庆旺,谭生建,陈陪让,等.薄层扫描法测定葛根岑连片中葛根素的含量[J].解放军药学学报,2001,17(2):81-82.
[16]徐艳春,魏璐雪,何大林,等.薄层扫描法测定红曲及其制剂血脂康中大豆苷元的含量[J].中国中药杂志,2001,26(1):33-34.
〔责任编辑 杨德兵〕
Determ ination of P uerarin and D aidzein in R adix P uerariae and N aodesheng T ablets by HPCE
LIU Li-zheng1,FENG Feng1,2,SHUANG Shao-min1
(1.School of Chemical Engineering,ShanxiUaiversity,Taiyuan Shanxi,030006;2.School of Chemistry and Chemical Engineering,ShanxiDatong University,Datong Shanxi,037009)
A high performance capillary electrophoresis (HPCE)method with diode array detection was established for the determination the contents of puerarin and daidzein in radix puerariae and naodesheng tablets.An uncoated fused-silica capillary(57 cm×75μm,effective length 50 cm)was used.60mmol/L borax-borate buffer(pH 9.0)was used as a running buffer,the applied voltage was 25 kV,the capillary temperature was controlled at 25℃and the wavelength of detector was set at 254 nm.There is a good linear relationship between the peak areas and the concentration of the analytes in the range of 0.2~1.2mg·mL-1for puerarin and 0.1~0.6mg·mL-1for daidzein.the detection limit(S/N=3)for puerarin and daidzein were 27.5 ng·mL-1and 12.7 ng·mL-1,respectively.the method was simple,rapid,accurate and can be used to control puerarin and daidzein in radix puerariae and naodesheng tablets.
h igh p erformance c apillary e lectrophoresis;Puerarin;Daidzein;Rradix pueraiae;Naodesheng t tablets
R914
A
1674-0874(2012)02-0028-04
2011-10-02
国家自然科学基金项目[21175085]
刘荔贞(1986-),女,山西大同人,硕士,研究方向:毛细管电泳。*冯锋,博士,教授,通信作者。
