固态发酵结合酶解技术制备花生肽及其促生长活性的研究
2012-09-11杨兰
杨 兰
(广东轻工职业技术学院,广东广州 510300)
固态发酵结合酶解技术制备花生肽及其促生长活性的研究
杨 兰
(广东轻工职业技术学院,广东广州 510300)
通过米曲霉固态发酵花生粕,结合酶解与冷冻干燥技术,制备花生肽。促生长实验表明,以0.5%添加分子量小于3ku的花生肽对保加利亚乳杆菌的促生长作用更为明显,其中乳杆菌的活菌数可提高1个数量级,凝乳效果改善,乙醛含量增加。比较氨基酸组成结果表明,该技术可有效提高氨基酸含量,改善氨基酸组成,乳杆菌生长必需的氨基酸含量达33.61~226.33mg/g。
花生肽,促生长,保加利亚乳杆菌,固态发酵
Abstract:Peanut peptide was made through solid state fermentation with Aspergillus oryzae on peanut meal and combination of enzymatic and freeze-drying technology.In the growth-promoting experiments,0.5%peanut peptide (Mw<3ku) gave better activity on Lactobicillus bulgaricus,including that the number of viable cells raised by an order of magnitude,better coagulatin effects and increased acetaldehyde contents.Comparison of amino acid revealed that the contents and composition were improved through the method,including that the contents of essential amino acids(33.61~226.33mg/g) for Lactobacillus bulgaricus were observed.
Key words:peanut peptides;growth-promoting;Lactobacillus bulgaricus;solid-state fermentation
花生是最重要的油料作物之一,榨油后产生大量的花生粕其中蛋白含量达45%以上[1]。但由于花生蛋白易严重变性,且具有氨基酸构成不太平衡、易受黄曲霉毒素污染等问题,花生粕大多数都被作为饲料使用[2]。生物活性肽对微生物的促生长作用日益受到关注[3-4],其制备方法主要包括外加酶解、微生物发酵等。与外加酶解法用酶单一、成本较高、产物苦味难以消除、液态发酵法投入成本大、排放污水多[5]相比,固态发酵使用的基质含水量低,不需要废水处理,并且直接利用微生物代谢产生的综合酶系,可大大降低生产成本,其发酵过程也不需要严格的无菌操作,具有明显优势[6]。同时米曲霉是一种易培养、产复合酶的菌株,具有高强度启动子、很强的蛋白分泌能力[7],其细胞内渗透压较高,在固态发酵中的应用较其他菌种更为广泛[8-9]。本次研究首先通过米曲霉固体发酵花生粕,利用代谢产生的以蛋白酶为主的综合酶系直接酶解花生粕,制得具有生物活性的花生肽,并进一步研究花生肽对保加利亚乳杆菌的促生长作用,以提高花生粕的附加值,为制备高质量的花生粕促生长肽提供科学依据。
1 材料与方法
1.1 材料与仪器
米曲霉(Aspergillus oryzae)M-11、保加利亚乳杆菌(Lactobacillus bulgaricus) 广东轻院微生物实验室提供;MRS液体培养基 葡萄糖20g,蛋白胨10g,酵母浸膏5g,牛肉浸膏10g,乙酸钠5g,吐温80 1g,柠檬酸二铵2.0g,MgSO4·7H2O 0.2g,K2HPO42.0g,MnSO4·4H2O 0.05g,加水至1000mL,121℃灭菌15min;杆菌计数培养基[10]蛋白胨10g,牛肉浸膏10g,酵母浸膏5g,吐温80 1g,磷酸氢二钾2g,柠檬酸二铵2g,乙酸钠5g,葡萄糖20.0g,MgSO4·7H2O 0.58g,MnSO4·4H2O 0.25g,琼脂15g,溶于1L蒸馏水中,调节pH5.4,过滤搅拌加热至沸,分装试管,121℃灭菌15min;脱脂复原乳 乳固体含量11%;花生粕 山东鲁花集团。
LG10-2.4A高速离心机 北京京立离心机有限公司;FD-4冷冻干燥机 北京博医康实验仪器有限公司;BT00-300M蠕动泵 保定兰格恒流泵有限公司;Vivaflow 200超滤装置 美国Vivascience公司;瑞利UV1801紫外可见分光光度计 北京瑞利公司;Agilent 1100液相色谱仪 美国Agilent公司。
1.2 实验方法
1.2.1 实验条件 色谱条件 PICO TAG氨基酸分析柱;柱温40℃;洗脱液A pH6.4醋酸钠缓冲液;洗脱液B 60%(v/v)乙腈;流速1.0mL/min;检测波长254nm。
1.2.2 工艺流程 制备米曲霉孢子悬液→制备种曲→制备花生粕曲→水解→膜分离、冻干得花生肽粉
1.2.3 操作要点
1.2.3.1 制备孢子悬液 将10mL无菌水加至30℃培养3d的豆汁斜面,用已灭菌的接种环在培养基表面轻轻刮动,制成孢子悬液,混匀后用血球计数板计孢子数,调整孢子悬液的孢子数为5.0×106个/mL。
1.2.3.2 制备麸皮种曲 麸皮100g及水100mL,拌匀后分装于250mL三角瓶中,添加1.00%葡萄糖、0.10%氯化钙、0.05%硫酸锌、3.00%豆粕,每瓶20g(约1~2cm厚),121℃灭菌20min,趁热打散,降至室温后接种孢子悬液,于28~30℃培养72h。
1.2.3.3 制作花生粕曲 称取1000g花生粕(润水、蒸煮并放凉至40℃左右)、0.75g种曲、100g麸皮,完全混匀,于32℃、RH 90%~95%条件下分别培养28、32、36、40、44h,测定花生粕曲蛋白酶活,以U/g花生粕曲干重表示。
1.2.3.4 花生粕曲水解 将培养好的花生粕曲打散,加入相当于花生粕曲4倍重量的水,于55℃水解9h,每隔1h测定花生肽得率。
1.2.3.5 膜分离与冷冻干燥 将水解液进行膜分离,其中膜的截留分子量为(Molecular Weight cut Off)10、3ku,蠕动泵(BT00-300M)转速为30r/min,共收集得到三个组分,即组分Ⅰ(Mw>10ku)、Ⅱ(10ku>Mw>3ku)、Ⅲ(Mw<3ku)。将各组分冷冻干燥后得花生肽粉,密封保存于4℃冰箱内
1.2.4 测定方法
1.2.4.1 蛋白酶活的测定 采用福林酚试剂法[11]。
1.2.4.2 花生肽得率的测定 以三氯乙酸(TCA)氮溶解指数表示[12],计算公式见式(1):
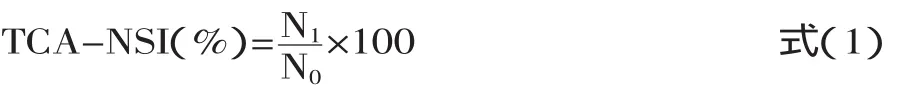
式中:N1──水解液在10%TCA中可溶性氮的含量,mg;N0──水解液中总氮的含量,mg。
1.2.4.3 OD值的测定 以生理盐水为调零基准,用UV1801型分光光度计于波长625nm测发酵液OD值。
1.2.4.4 pH的测定 用pHS-25型酸度计测定发酵液pH,每次使用前用pH6.86和pH4.00标准缓冲溶液校准酸度计。
1.2.4.5 活菌数的测定 杆菌以3%接种于脱脂复原乳培养基中,于42℃恒温培养。在无菌操作条件下,将发酵液充分混匀,移取1mL发酵液及9mL稀释液(0.1%胰蛋白胨溶液)置于试管内,并在涡流仪上充分混匀,依次做10倍递增稀释至合适的稀释度(预实验确定)。吸取1mL稀释后的发酵液于灭菌计数培养基中,做三个平行样,在37℃恒温培养箱中培养72h计数。
1.2.4.6 乙醛含量的测定 取发酵液40mL,加入等体积16%三氯乙酸溶液,以转速3500r/min离心10min,过滤后得待测上清液。精确量取1%NaHSO3溶液5.00mL置于锥形瓶中,加入待测上清液25mL,摇匀,室温放置1h后,加入1%淀粉溶液1mL,用0.1mol/L碘液滴定至近终点时,用0.01mol/L碘液滴定至浅蓝紫色。再加1mol/L NaHCO3溶液20mL,振荡混匀0.5min,用0.01mol/L碘(1/2 I2)标准溶液滴定至淡蓝紫色,记录消耗的标准碘液体积,同时用脱脂复原乳做空白试验,每样品至少做3次平行滴定,取平均值。计算公式见式(2):

式中:V(1/2I2)——滴定上清液时消耗碘(1/2 I2)标准溶液的体积,mL;V0——空白滴定时消耗碘(1/2 I2)标准溶液的体积,mL;C(1/2I2)——碘(1/2 I2)标准溶液的浓度,mol/L。
1.2.4.7 双乙酰含量的测定 将11%的脱脂复原乳121℃灭菌7min后迅速冷却,用于配制浓度分别为0、10、20、30、40、50mg/L的双乙酰标准液。取各浓度标准液按如下方法操作,绘制标准曲线:加等体积的16%三氯乙酰溶液,混匀,以转速3500r/min离心10min,取上清液20mL分别加入到2支(1号和2号)试管中,向1号管中加入1%的邻苯二胺溶液0.5mL,2号管不加,摇匀后置于黑暗处放置30min,然后各加入4.0mol/L HCl溶液2.0、2.5mL以终止反应,混匀后以不加邻苯胺的2号管的溶液作为参比液,用紫外-可见分光光度计在335nm波长下测定吸光度值,每样至少做2个平行,取平均值,然后以双乙酰浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。用发酵液代替脱脂复原乳,测定发酵液中双乙酰浓度。
1.2.4.8 氨基酸组成的测定 用6mol/L盐酸溶液水解待测样品,0.45μm微滤膜过滤,Agilent 1100液相色谱仪测定样品氨基酸组成。
2 结果与讨论
2.1 花生肽的制备
2.1.1 不同培养时间对成曲蛋白酶活的影响 花生粕曲的制作时间应根据所用菌种、制曲工艺来决定。在本次研究中采用米曲霉,其最适生长温度为32~35℃,温度过低则低温型微球菌、毛霉菌等容易生长;温度过高则枯草芽孢杆菌、根霉等耐高温的微生物容易生长繁殖,产生氨味。另外,考虑到成曲制作时,曲料的厚度会使得制曲过程中放出的热量不能及时排出,并结合笔者前期对米曲霉制曲的研究经验,选用32℃进行培养,结果如图1所示。

图1 制曲时间对花生粕曲中性及酸性蛋白酶活的影响Fig.1 Effect of koji-making time on neutral and acidic protease activity of peanut meal koji
2.1.2 不同水解时间对花生肽得率的影响 米曲霉代谢生成的蛋白酶最适水解温度为50~55℃,且在适宜温度范围内,较高的温度有助于提高水解的速度,因此将制好的花生粕曲加相当于4倍重量的水于55℃进行水解,观察其花生肽得率的变化情况,实验结果见图2。
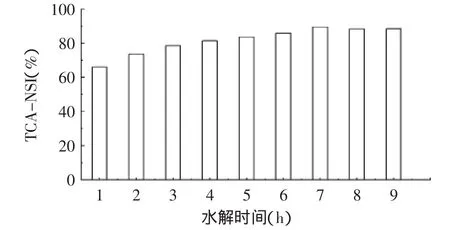
图2 水解时间对花生肽得率的影响Fig.2 Effect of hydrolyzing time on peanut peptide yield
图2中可以看出,随着水解时间的增加,TCA-NSI逐渐增加,在7h达最大值88.45%。在水解时间超过7h后,花生肽得率保持相对稳定的状态,这是因为随着水解底物蛋白的减少,生成的花生肽逐渐增加,抑制了水解反应,甚至会出现部分水解产物又重新聚合的现象。TCA-NSI的高低反映了水解产物的生化特性及肽链的长短,一般认为TCA-NSI值越大,肽链越短。因此选取7h作为花生肽制备的水解时间。
2.2 不同分子量范围的花生肽对MRS培养基中乳杆菌生长的影响
将保加利亚乳杆菌按3%(v/v)接种于含有不同分子量段花生肽的MRS液体培养基中,37℃有氧培养24h,在625nm下测量培养基的OD值与pH,结果如图3所示。
由图3可知,与对照组相比,不同分子量范围的花生肽均使得OD值提高、pH下降。添加组培养基OD值增加至0.95~1.12,对于蛋白分解能力较弱的杆菌而言,在MRS培养基中添加富含肽的蛋白水解物,作为乳杆菌生长过程中所需的氮源,是能够促进乳杆菌增殖和发酵的有效途径。另外,添加花生肽也使培养基的pH下降较对照组更为明显,原因可能是由于氮源利用效率提高,乳杆菌活力增强导致产酸能力增强,同时乳杆菌总量的增加也导致总酸量的增加。
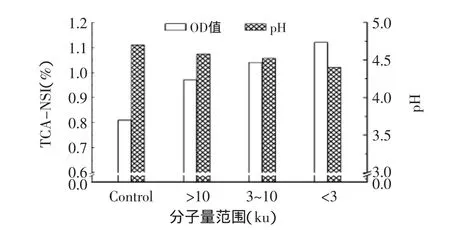
图3 不同分子量花生肽对保加利亚乳杆菌生长的影响Fig.3 Effect of peanut peptides with different moleculer weight on growth of L.bulgaricus in MRS
图3表明,分子量小于3ku的花生肽对培养基的OD值、pH的影响相较其他分子量范围的肽更为明显。近年来,研究发现不同分子量肽段对微生物的促生长作用有明显差异,如St-Gelais等[13]报道肽链的长短是决定肽促乳酸菌生长活性强弱的一个重要因素,Proulx等[14]发现分子量小于2ku的肽段对于B.ifidubactreia的生长最为有利,王洪荣[15]认为分子量小于3ku的鱼粉肽和豆粕肽对瘤胃细菌和原虫的生长有促进作用,能提高瘤胃中的蛋白酶活。因此,将以分子量小于3ku的花生肽作为下一步研究对象。
2.3 花生肽添加量对发酵乳的影响
分别添加0、0.2%、0.5%、1.0%、1.8%、3.0%花生肽于脱脂复原乳中,接种保加利亚乳杆菌,于42℃培养,观察凝乳时间和凝乳效果,测定凝乳时活菌数,结果如表1所示。

表1 不同添加量对脱脂复原乳中活菌数及凝乳效果的影响Table 1 Effect of different amounts on the number of viable cells and coagulating in reconstituted skim milk
表1表明,随着花生肽的添加,脱脂复原乳培养基出现活菌数增加、凝乳时间缩短及凝乳效果增强的现象,这主要是由于随着生成的乳酸增加,pH下降较快,以致α-酪蛋白、β-酪蛋白及κ-酪蛋白都倾向于从酪蛋白胶束中解离出来,疏水作用的排斥作用减少,酪蛋白胶粒开始凝聚沉降,出现凝乳现象。在添加量大于0.5%后,活菌数的增加变得缓慢,凝乳时间的变化也不明显,但出现酸乳黏度下降的现象,可能是随着pH进一步下降及乳杆菌对蛋白分解作用的增强,微小蛋白质亚胶体分子团之间的亲合连接作用减弱,导致酸乳胶体的刚性降低,出现由胶体分子团聚集形成的蛋白质网络松散、酸乳黏度降低的现象[16]。
There is also a series of iconic Chinese sculptures as horses, warriors or animals out of fairy tales. These are bronze sculptures partly covered by enamel in different colors. These arte facts are fascinating for those who still can believe in a romantic way of day dreaming.
发酵乳中生成上百种挥发物,Friedrich等[17]研究表明乙醛和双乙酰是对风味影响最大的物质。本实验对发酵乳中的乙醛和双乙酰含量进行测定,结果如图4所示。
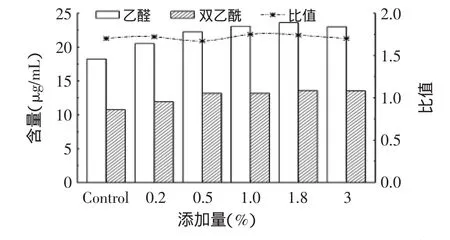
图4 花生肽对脱脂复原乳发酵液风味物质的影响Fig.4 Effect of peanut peptide on volatile components in fermented milk
乙醛的生成主要通过Threonine aldolase途径,将苏氨酸转变成甘氨酸和乙醛,添加组中可能由于花生肽的水解等原因使苏氨酸含量增加[18],乙醛含量达20~25μg/mL,对生成乙醛有一定的促进作用。双乙酰含量则由糖代谢生成的丙酮酸或乳中所含柠檬酸来决定,由图4可以看出,保加利亚乳杆菌发酵生成双乙酰的能力明显低于乙醛,且肽的添加也未带来明显变化。
对于发酵乳风味而言,双乙酰和乙醛的比例对酸奶的风味影响也很大,如Zouari等[19]认为两者比例为1∶1时,具有典型酸奶风味,而Bottazzi[20]认为乙醛与丙酮比例为2.8∶1时,可获得所期望的浓郁风味。实际上国内外学者对于产生酸奶最佳风味所需各物质的浓度和比例进行了大量的探索,但目前尚未取得一致结论[21]。本次研究中两者比值均大于1,这也与发酵时仅使用了单一菌种(保加利亚乳杆菌)且保加利亚乳杆菌产双乙酰的能力较差有关。考虑到酸奶实际生产与冷藏期间,由于多种微生物的持续作用,其风味物质的含量和比例还会继续变化,对风味的最终影响还有待于进一步研究。
2.4 花生肽对脱脂复原乳中保加利亚乳杆菌生长代谢规律的影响
将杆菌以3%接种于含0.5%花生肽的脱脂复原乳培养基中,在42℃恒温培养,并分别于0、4、8、12、16、20h取发酵液,观察保加利亚乳杆菌的生长代谢规律,测定发酵液中活菌数、pH,结果如图5所示。
由图5可知,随着保加利亚乳杆菌发酵的进行,添加组的保加利亚乳杆菌增殖速度明显变快,发酵4h后,添加组与对照组的活菌数差异较明显,之后始终高于对照组0.5~1个数量级。

图5 花生肽(Mw<3ku)对保加利亚乳杆菌生长代谢的影响Fig.5 Effect of peanut peptides with Mw<3ku on growth of L.bulgaricus
保加利亚乳杆菌为化能异养型微生物,营养要求较为苛刻,需要寡肽、氨基酸、维生素和嘌呤等物质及其它生长因子才能获得良好生长。保加利亚乳杆菌利用外加氮源主要发生在对数增长期,此时添加了肽的培养基中氨基酸和寡肽处于较高水平,对乳杆菌生长表现出明显的刺激作用。随着乳杆菌的生长,细胞数量的增加,菌株水解脱脂复原乳中的蛋白质释放出氨基酸及寡肽,pH也随着其主要代谢产物乳酸的累积而迅速下降。但由于肽的添加,将缓解发酵液的pH下降趋势,20h左右添加组与对照组的pH差别缩小。
2.5 花生肽的氨基酸组成
花生肽主要是由寡肽和部分游离氨基酸组成的混合物,既可为乳杆菌生长提供氨基酸来源,又能够从培养基中以肽转运的方式进入细胞以促进生长。将花生肽与花生粕中的氨基酸进行比较,结果如表2所示。
由表2可知,经过水解后,花生肽中各种氨基酸含量均有所提高,氨基酸比例适当,并且乳杆菌生长必需的谷氨酸、天门冬氨酸、亮氨酸、缬氨酸、异亮氨酸含量较高,在226.33mg/g与33.61mg/g之间,是促进保加利亚乳杆菌增殖的有效氮源补充物。可为乳杆菌生长提供很好的短肽和氨基酸来源,可以认为固态发酵结合酶解技术是提高花生蛋白氨基酸含量的有效途径之一。
但需要指出的是,乳酸菌的蛋白质水解系统由胞处定位的丝氨酸蛋白酶、肽转运系统和部分胞内肽酶组成,寡肽的运输是氮源进入细胞内的主要途径之一,如白凤翎[22]的研究发现以分子量小于5ku的大豆蛋白水解物代替全价氨基酸可以使保加利亚和乳杆菌细胞密度增加到5倍,最大增长速率增大1倍,因此研究花生肽(尤其是短肽)的组成与氨基酸序列对保加利亚乳杆菌促生长的影响将成为下一步工作的主要目标。

表2 花生肽(Mw<3ku)与花生粕的氨基酸组成Table 2 Amino acid composition of peanut meal and peanut peptide(Mw<3ku)
3 结论
3.1 研究了利用米曲霉固体发酵花生粕,产生以蛋白酶为主的综合酶系后,加水至花生粕曲中,确定花生粕曲的制作时间为36h。利用粕曲自身产生的蛋白酶进行水解花生粕蛋白,确定水解温度为55℃,水解时间为7h。将水解液按分子量进行分离后,冷冻干燥得花生肽,本工艺具有成本低、废液少、易操作等优点。
3.2 分子量范围在小于3ku的花生肽,用量为0.5%时促生长的效果最好,其生长曲线表明,活菌数比对照组增加1个数量级,pH下降速度增加,对风味物质如乙醛的生成也有一定的促进作用。
3.3 氨基酸测定结果表明,花生肽中氨基酸比例适当,其中乳杆菌生长必需的氨基酸如天门冬氨酸、亮氨酸、缬氨酸、异亮氨酸等含量较高,是促进增殖的有效氮源补充物。
[1]梅娜,周文明,胡晓玉,等.花生粕营养成分分析[J].西北农业学报,2007,16(3):96-99.
[2]张吉民,王秀贞,杨伟强,等.花生粕在水产饲料中的应用研究进展[J].第五届全国花生学术研讨会,2007.
[3]Setin I,Svein J H,Vincent G H E.Hydrolysates from Atlantic cod(Gadus morhua L.) viscera as components of microbial growth media[J].Process Biochemistry,2005,40(12):714-722.
[4]Russi S P,Wallace R J,Newbold C J.Influence of the pattern of peptide supply on microbial activity rumen simulating fermenter(RUSITEC)[J].British Journal of Nutrition,2002,88:73-80.
[5]秦思思,宋俊梅,刘天蒙.发酵豆粕制备大豆肽饮料发酵条件的研究[J].中国酿造,2011,233(8):129-132.
[6]Kumar S, Sharma H K, Sarkar, B C.Effect of substrate and fermentation conditions on pectinase and cellulase production by Aspergillus niger NCIM 548 in submerged(SmF) and solid state fermentation(SSF)[J].Food Science and Biotechnology,2011,20(5):1289-1298.
[7]刘丽,刘谨,唐国敏.丝状真菌外源基因表达分泌系统的受体菌的构建[C].武汉:首届中国青年学者微生物遗传学学术研讨会,2002:57.
[8]Kazunari I,Tomoka K,Hiroyuki S,et al.Uniform culture in solid-state fermentation with fungi and its efficient enzyme production[J].Journal of Bioscience and Bioengineering,2011,111(3):300-305.
[9]秦卫东,陈学红,马利华,等.黑曲霉发酵豆粕制备抗氧化肽研究[J].食品科学,2010,31(23):289-293.
[10]赵强忠,赵谋明,蒋文真.一种分离和检测酸乳中乳酸菌的有效方法[J].食品与发酵工业,2007,33(3):96-99.
[11]上海酿造科学研究所.发酵调味品生产技术[M].北京:中国轻工业出版社,1998:70-72.
[12]姜绍通,罗蕾蕾,潘牧,等.菜籽粕分步酶解制备水解产物的研究[J].食品科学,2009,30(10):52-55.
[13]St-Gelais D,Roy D,Haché S,et al.Growth of nonproteolytic Lactococcus lactis in culture medium supplemented with different casein hydrolysates[J].Journal of Dairy Science,1993,76:3327-3337.
[14]Proulx M,Ward P,Gauthier S F,et al.Comparison of bifidobacterial growth-promoting activity of ultrafiltered casein hydrolyzate fractions[J].Lait,1994,74(2):139-152.
[15]王洪荣,孙桂芬,卢德勋,等.饲料源活性肽混合物的提取及其对绵羊瘤胃微生物生长的影响[J].动物营养学报,2006,18(4):252-260.
[16]沈辉,Celestin S,Etienne N,等.酸乳发酵凝乳过程中的理化性质和生物活性[J].无锡轻工大学学报,2000,19(5):443-445.
[17]Friedrich J E,Acree T.Gas chromatography olfactometry(GC/O) of dairy products[J].International Dairy Journal,1998,8(3):235-241.
[18]Lees G J,Jago G R.Formationof acetaldehyde from threonine by lactic acid bacteria[J].Journal of Dairy Research,1976,43(1):75-83.
[19]Zouari A,Desmazeaud M J.Characterization of lactic acid bacteria isolated from Greek yogurts.2.Strains of Lactobacillus delbrueckii subsp bulgaricus and mixed cultures with Streptococcus salivarius subsp thermophilus[J].Lait,1991,71:463-482.
[20]Bottazzi V,Vescovo V M.Carbonyl compounds produced by yogurt bacteria[J].Neth Milk Dairy J,1969,23:71-78.
[21]Boelrijk A E M,Jong C de,Smit G.Dairy Processing-Improving Quality[M].New York:CRC Press,2003:130-154.
[22]白凤翎.蛋白水解物促乳酸菌增殖及高密度培养体系研究[D].北京:北京林业大学,2010.
Study on peanut peptides preparation through solid-state fermentation combined with enzyme hydrylyzing and growth-promoting activity
YANG Lan
(Guangdong Industry Technical College,Guangzhou 510300,China)
TS201.3
A
1002-0306(2012)16-0199-05
2012-05-07
杨兰(1974-),女,博士,讲师,研究方向:食品生物技术。
