绵羊卵巢卵泡颗粒细胞体外培养中促卵泡素和胰岛素浓度优化研究
2012-09-11庞钰莹岳文斌于雪静李鹏飞孟金柱刘岩李晓明黄洋任有蛇吕丽华
庞钰莹,岳文斌,于雪静,李鹏飞,孟金柱,刘岩,李晓明,黄洋,任有蛇,吕丽华
(1.山西农业大学 动物科技学院,山西 太谷030801;2.山西农业大学 生命科学学院,山西 太谷030801)
绵羊卵巢卵泡从原始卵泡形成开始就进入了一个卵泡生长与闭锁相交织的过程,这一过程贯穿雌性动物繁殖的始终。而卵泡的生长和排卵需要颗粒细胞正常的生长增殖和功能表达,这有利于卵母细胞的成熟[1~3],在这个过程中,FSH和胰岛素是促进颗粒细胞增殖和发挥生理功能的重要因子[4]。
本试验通过对无血清条件下绵羊卵巢卵泡颗粒细胞的体外培养,研究不同浓度的FSH和胰岛素对颗粒细胞增生及雌激素分泌的影响,在研究中排除了血清中未知因素干扰,确定了绵羊卵巢卵泡颗粒细胞体外培养最适宜的FSH和胰岛素浓度,为雌性动物卵巢功能的检测、卵巢疾病引起的不孕症治疗以及动物生殖提供新的理论基础。
1 材料与方法
1.1 材料
选取清徐县屠宰场成年健康母羊作为研究对象,动物宰杀后采集卵巢。
MEM 培养液、牛血清蛋白(Bovine Serum Albumin,BSA)、两性霉素 B(Fungizone)、4-羟乙基哌嗪乙磺酸(4-(2-hydroxyerhyl)piperazine-1-erhaesulfonic acid,HEPS)、非必需氨基酸、转铁蛋白、雄激素、胰岛素样生长因子(Independent Games Festival,IGF)、胰岛素、促卵泡素(folliclestimulating hormone,FSH)、台盼蓝、氢氧化钠、Sheep Estradiol Elisa kit、双抗等。
1.2 方法
1.2.1 体外培养试验器具的处理
试验所用玻璃器皿、胶塞和塑料制品,必须经严格的酸碱处理程序后,最后用自来水和双蒸水各冲洗3次,烘干后待用。
1.2.2 颗粒细胞的收集
从灭菌的DPBS中取出卵巢,冲洗干净,用眼科剪剪取卵泡,放入4℃无菌的培养液中,置于超净台。将卵泡一剪两半,用刮刀轻轻刮卵泡内壁,将颗粒细胞刮入盛有培养液的小表面皿中。离心弃上清,加入培养液重悬细胞,此悬浮细胞即为试验用颗粒细胞。
1.2.3 颗粒细胞的体外培养
将稀释颗粒细胞,加于96孔细胞培养板中,每孔约2×104个活细胞。分别加入不同浓度的FSH和胰岛素。未添加FSH和胰岛素的孔用等量培养液代替,每孔为200μL体系。培养第7d,用DPBS(Dulbecco PBS)胰蛋白酶消化并细胞计数。每孔抽取170μL细胞培养液,放入离心管并置于-20℃冰箱中待测激素。
1.2.4 雌激素测定
选用绵羊雌二醇放射免疫测定试剂盒对激素浓度进行测定。
1.2.5 雌激素浓度计算
以标准品5000、1000、300、50、0ng·L-1为横坐标,OD值为纵坐标,作出标准曲线;根据样品OD值在曲线图上得出相应雌激素含量,再乘以相应的稀释倍数即得培养液雌激素浓度。
1.2.6 数据处理与分析
结果用3次重复试验的平均值±标准误表示,采用Excel 2007作图,SPSS 11.03(Statistic Package for Social Science)对各指标进行线性模型分析。
2 结果与分析
2.1 绵羊卵巢卵泡颗粒细胞体外培养168 h细胞计数结果
对FSH的作用进行显著性检验,结果见图1。与未加FSH的对照组相比,培养液加入不同浓度FSH,体外培养7d,颗粒细胞数显著增加(P<0.01)。可见,FSH对绵羊卵巢卵泡颗粒细胞增殖具有促进作用。
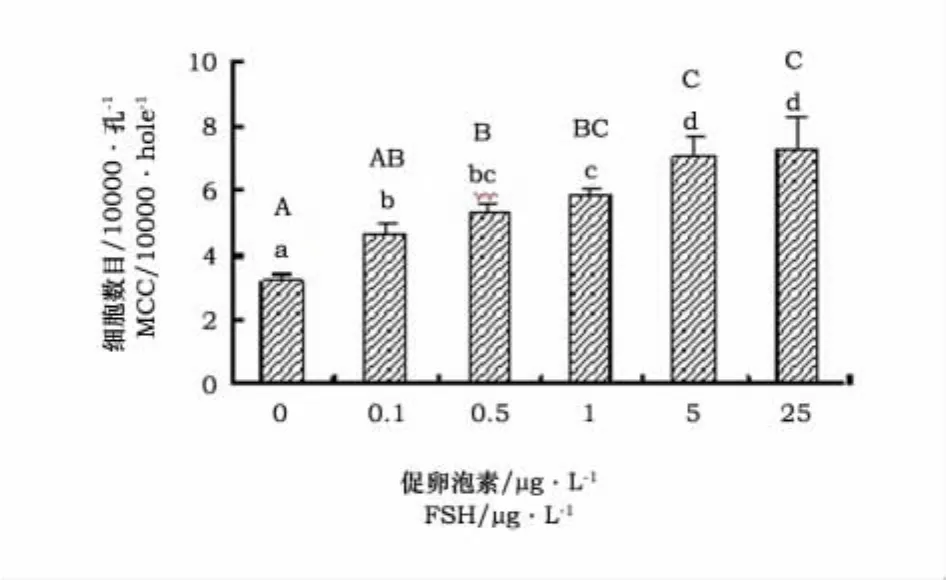
图1 FSH对颗粒细胞数目的影响Fig.1 Effects of FSH on the number of granulosa cells
当FSH浓度为0.1μg·L-1,培养体系中颗粒细胞数显著增加(P<0.05);当FSH浓度为5 μg·L-1,颗粒细胞数显著高于对照组和FSH浓度为0.1μg·L-1、0.5μg·L-1和1μg·L-1的培养组(P<0.01);当FSH浓度为25μg·L-1,颗粒细胞数目与其他组相比有上升趋势,但与FSH浓度为5μg·L-1的培养组差异不显著。这说明FSH浓度为5μg·L-1时,颗粒细胞的培养条件最优。
由图2可见,当培养体系中添加胰岛素时,与对照组相比(培养体系不加胰岛素),随着胰岛素浓度增加,颗粒细胞数显著增加(P<0.01),且两两之间差异极显著。可见,胰岛素对绵羊卵巢卵泡颗粒细胞增殖具有促进作用。

图2 胰岛素对颗粒细胞数目的影响Fig.2 Effects of insulin on the number of granulosa cells
2.2 绵羊卵巢卵泡颗粒细胞体外培养168 h雌激素水平的测定
绵羊卵巢卵泡颗粒细胞体外培养168h,不同浓度FSH对雌激素分泌量的作用效果进行显著性检验,结果见图3。随着FSH浓度的增加,雌激素浓度呈上升趋势;与对照组(培养体系不加FSH)相比,当FSH浓度为0.1μg·L-1,培养液雌激素浓度显著提高(P<0.05);当FSH浓度增加为0.5 μg·L-1以上时,培养液雌激素浓度都显著高于对照组(P<0.01);当FSH 浓度为5μg·L-1,培养液雌激素浓度最高,与FSH浓度为25μg·L-1的培养组相比,差异虽不显著,但雌激素分泌水平呈下降趋势。说明FSH浓度为5μg·L-1时,颗粒细胞的培养条件最优,这与颗粒细胞计数结果相吻合。

图3 FSH对雌激素分泌量的影响Fig.3 Effects of FSH on estradiol production
在不同浓度的胰岛素作用下,颗粒细胞体外培养168h,对雌激素的浓度进行显著性检验,结果见图4。结果表明,随着胰岛素浓度增加,颗粒细胞雌激素分泌量呈上升趋势;当胰岛素浓度为1 μg·L-1时,培养液雌激素浓度显著提高(P<0.01);当胰岛素浓度增加为10μg·L-1时,培养液雌激素浓度继续升高,但与胰岛素浓度为1μg·L-1的培养体系相比,培养液雌激素浓度差异不显著。表明胰岛素浓度为1μg·L-1时,颗粒细胞的培养条件最优。
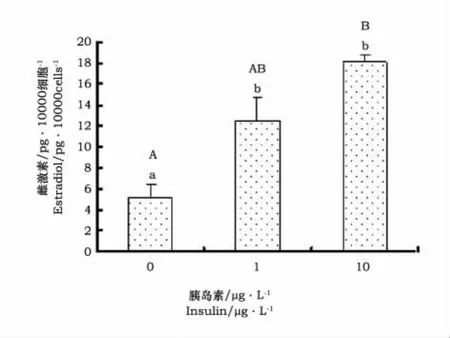
图4 胰岛素对雌激素的影响Fig.4 Effects of insulin on estradiol production
3 讨论
3.1 FSH和胰岛素的作用机理
FSH是在有节律的下丘脑促性腺激素释放激素刺激下,由垂体前叶合成和分泌的一种糖蛋白激素。FSH能够提高哺乳动物卵巢颗粒细胞增殖活性。颗粒细胞中有FSH受体,当受体与FSH结合时,可以激活cAMP系统,提高芳香化酶的活性[6],诱导颗粒细胞雌激素的产生[7,8],从而提高雌激素的分泌量等[9~11]。本研究通过对绵羊卵巢卵泡颗粒细胞体外培养,对颗粒细胞数和雌激素浓度测定结果表明,在对照组中,颗粒细胞数处于一定基数,雌激素水平也较低,增加FSH浓度可显著提高培养液中颗粒细胞数和雌激素浓度。
胰岛素对颗粒细胞的作用是多方面的[12,13],其可能的机制之一是通过与胰岛素样生长因子-I(IGF-I)受体结合而促进细胞代谢。在试验中,对胰岛素浓度设定了3个梯度,随着胰岛素浓度升高,颗粒细胞数和雌激素浓度呈上升趋势,进一步证明了胰岛素对卵泡生长的重要作用。
3.2 FSH和胰岛素对颗粒细胞体外培养的影响
本试验证明在无血清条件下,FSH和胰岛素对颗粒细胞增殖和雌激素分泌存在剂量效应关系。在无FSH或胰岛素作用下,颗粒细胞聚集生长的细胞团比较少,雌激素的分泌量增加也较低。当FSH为5μg·L-1时,雌激素的分泌量最高。当胰岛素浓度为10μg·L-1,培养液雌激素浓度最高,与1μg·L-1的实验组差异不显著。因此对于培养体系而言,胰岛素为1μg·L-1时,为最佳的体外培养浓度。本研究发现继续增加FSH和胰岛素的浓度,反而会降低颗粒细胞的功能,这与黄洋等研究结论一致[14]。也有研究表明,在无血清条件下高浓度的FSH会降低牛的卵泡颗粒细胞分泌雌激素的能力[8]。
本研究还发现,部分绵羊卵泡颗粒细胞有聚集生长的特性,能形成胚胎干细胞团样集落,这与牛、小鼠、猪的卵巢卵泡颗粒细胞体外生长的特性很相似[15~17],但是否具有干细胞特异性还需要进一步研究。
[1]朱丽,郭成志,邓思君,等.猪卵巢颗粒细胞分离培养及鉴定[J].中国兽医杂志,2011,47(4):21-22.
[2]Lihua Lv,Wenbin Yue,Wenzhong Liu,et al.Effects of sperm capacitation treatments and in vitro culture systems on development of in vitro fertilized embryos derived from prepubertal Boer goat oocytes[J].Asian Australian Journal of Animal Sciences,2009,22 (7):969-976.
[3]Lihua Lv,Wenbin Yue,Wenzhong Liu,et al.Effect of oocyte selection,estradiol and antioxidant treatment on in vitro maturation of oocytes collected from prepubertal Chinese Boer goats[J].Italian Journal of Animal Sciences,2010,9(11):50-54.
[4]Argov N,Arav A,Sklan D.Number of oocytes obtained from cows by OPU in early,but not late lactation increased with plasma insulin and estradiol concentrations and expression of mRNA of the FSH receptor in granulosa cells[J].Theriogenology,2004,61(5):947-962.
[5]Sen A,Bettegowda A,Jimenez-Krassel F,et al.Cocaine-and amphetamine-regulated transcript regulation of follicle-stimulating hormone signal transduction in bovine granulosa cells[J].Endocrinology 2007,148:4400-4410.
[6]王锋.卵泡生长发育成熟及其内分泌调控[J].国外兽医学——畜禽疾病,1994(1):1-8.
[7]李鹏飞,岳文斌,李富禄,等.CART对猪卵巢卵泡颗粒细胞雌激素产生的影响[J].畜牧兽医学报,2012,43(12):1879-1886.
[8]高庆华,蒋超祥,韩春梅.FSH和胰岛素对牛卵泡颗粒细胞长期培养的影响[J].中国草食动物,2004,24(4):16-18.
[9]Hughes F M Jr,Gorospe W C.Biochemical identification of apoptosis(programmed cell death)in granulose cells:evidence for a potential mechanism underlying follicular atresia[J].Endocrinology,1991,129(5):2415-2422.
[10]Sen Aritro,Lihua Lv,Nora Bello,et al.Cocaine and amphetamine-regulated transcript(CART)accelerates the temination of FSH-induced ERK1/2and AKT activation by regulating the expression and degradation of specific MAP kinase phosphatases[J].Mol endocrinol,2008,22:2655-2676.
[11]Lv Lihua,Fermin Jimenez-Krassel,Aritro Sen,et al.Evidence supporting a role for cocaine and amphetamine regulated transcript(CART)in control of granulosa cell estradiol production associated with dominant follicle selection in cattle[J].Biology of Reproduction,2009,81:580-586.
[12]Torner H,Brüssow K P,Alm H,et al.Mitochondrial aggregation pattern and activity in porcine oocytes and apoptosis in surrounding cumulus cells depends on the stage of pre-ovulatory maturation[J].Theriogenology,2004,61(9):1675-1689.
[13]龚衍,李尚为,樊伟.胰岛素促进体外培养的小鼠卵巢颗粒细胞增殖[J].四川生理科学杂志,2008,30(2):64-65.
[14]黄洋,孙晋艳,李鹏飞,等.绵羊卵泡颗粒细胞体外培养条件的优化[J].山西农业科学,2012,40(2):161-163.
[15]Gutierrez C G,Campbell B K,Webb R.Development of a long-term bovine granulosa cell culture system:induction and maintenance of estradiol production,response to follicle stimulating hormone,and morphological characteristics[J].Biol Reprod,1997,56:608-616.
[16]王妍,赵晓娥,杨培生,等.小鼠卵巢颗粒细胞的体外培养[J].西北农林科技大学学报:自然科学版,2007,35(8):12-14.
[17]孙晋艳,黄洋,张航,等.FSH对体外培养猪卵巢颗粒细胞生长及增殖的影响[J].山西农业科学,2011,39(5):465-470.
