无氮饲粮对肉鸡盲肠微生物菌群结构及内源氨基酸基础损失量的影响
2012-09-11蒋纯卫呙于明王永伟郭双双
蒋纯卫 呙于明 王永伟 雷 廷 郭双双
(中国农业大学动物科技学院,动物营养学国家重点实验室,北京 100193)
准确估测内源氨基酸基础损失量是测定饲料标准氨基酸消化率的一大关键,内源氨基酸基础损失量的测定方法也是近年动物营养研究的热点[1]。20世纪90年代,收粪法因具有简便可行且结果较饲料直接物化分析法更有效等优点而被广泛采纳,但也因受盲肠微生物影响一直备受争议。当前,无氮饲粮法研究盲肠微生物对氨基酸基础内源损失的影响主要有3种方法:完整成年公鸡、去盲肠成年公鸡强饲收粪法[2];无菌鸡、传统鸡收粪法;指示剂法同时收取肉鸡回肠食糜、粪进行比较分析。对5周龄肉鸡的研究表明,收粪法所得天冬氨酸、谷氨酸基础内源损失显著高于回肠食糜法,其余没有显著差异[4]。上述试验只是采用了传统方法间接研究了盲肠微生物对内源氨基酸损失的影响,所以本试验拟从微生物遗传标志分子16S rDNA、微生物关键代谢物氨态氮和挥发性脂肪酸(VFA)等方面进一步探讨盲肠微生物对内源氨基酸损失量的影响。因此,本试验选用10日龄和31日龄雄性肉鸡,饲喂无氮饲粮,旨在通过对回肠食糜法、收粪法所得的内源氨基酸基础损失量进行比较研究,同时采用变性梯度凝胶电泳(DGGE)技术分析盲肠微生物对收粪法测定内源氨基酸基础损失量的影响,为肉鸡饲料内源氨基酸基础损失量的测定提供理论指导。
1 材料与方法
1.1 试验设计
分别选用10日龄和31日龄罗斯(Ross)308雄性肉鸡120只和60只,均随机分为常规饲粮组和无氮饲粮组,每组5个重复,其中10日龄时每个重复12只鸡,31日龄时每个重复6只鸡,正式试验期均为4 d。试验期常规饲粮组肉鸡饲喂含有二氧化钛指示剂的常规饲粮,无氮饲粮组肉鸡饲喂含有二氧化钛指示剂的无氮饲粮,添加量均为0.5%。非正式试验期肉鸡均饲喂不含指示剂的常规饲粮。肉鸡除试验期有特殊饲喂要求外,其余时间均自由采食,充足饮水,按正常免疫程序进行免疫接种。常规饲粮参照中国鸡饲养标准(NY/T 33—2004)配制,无氮饲粮参照Adedokun等[1]推荐的配方配制,含指示剂的常规饲粮组成及营养水平、无氮饲粮组成分别见表1和表2。
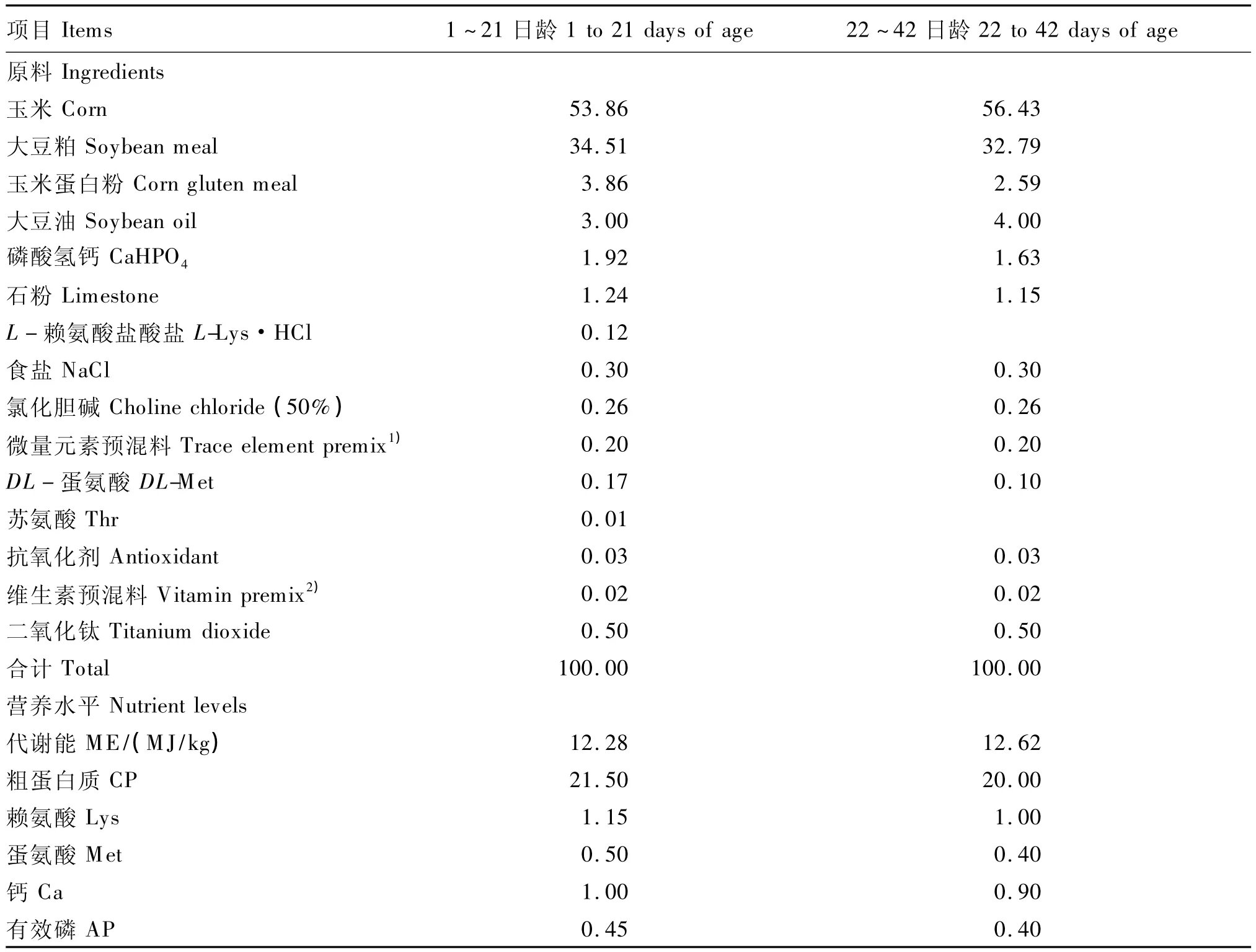
表1 常规饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of conventional diets(air-dry basis) %
1.2 样品采集与制备
在10日龄和31日龄时,对肉鸡进行饥饿处理,其中10日龄饥饿4 h,31日龄饥饿8 h,饥饿后称重,剔除体重极大和极小的鸡只,待试验鸡只体重排序后按照拉丁方原则,使得每个重复涵盖体重从高到低的鸡只,每个重复平均体重尽量一致。随后开始正式试验,无氮饲粮组肉鸡饲喂含指示剂的无氮饲粮,常规饲粮组肉鸡饲喂含指示剂的常规饲粮,共饲喂4 d。
在13日龄和34日龄时,肉鸡粪便用铺有尼龙纸的粪盘收集,收12 h,每隔2 h收1次,收集时将羽毛、饲料、皮屑等清除,收集后的粪便立即放入-20℃冰箱保存,12 h的粪便统一混匀后取部分冻干。室温回潮24 h后,将粪便粉碎过60目分析筛,密封样品,保存在-20℃冰箱待测。
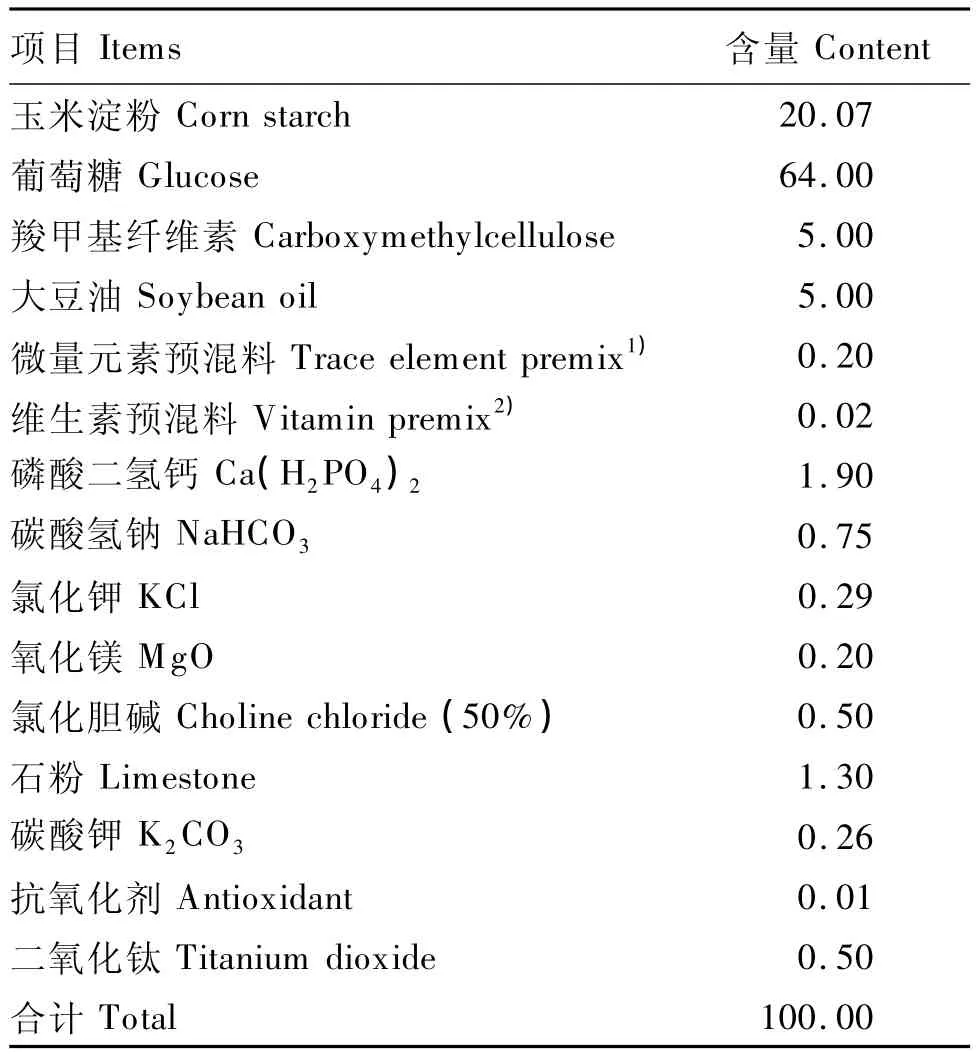
表2 无氮饲粮组成Table 2 Compositon of the nitrogen-free diet %
在14日龄和35日龄时,肉鸡先饥饿2 h,自由采食4 h后翅下静脉注射戊巴比妥钠麻醉剂麻醉所有鸡只,剂量为30 mg/kg体重,保证深度麻醉后立即屠宰,分离整段回肠。除去最后2(14日龄肉鸡)或4 cm(35日龄肉鸡)的回肠肠段再对折为2个部分,取后1/2段回肠食糜用于后续分析。将这部分肠段食糜用蒸馏水冲洗至铝盒中。每个重复所有食糜混合成一个样品。样品收集好后,冻干。后续操作与上述粪便的方法一致。取出左右盲肠,将左侧盲肠称重,两侧盲肠液氮冷冻后保存在-80℃冰箱。测定时将每个重复的左右盲肠食糜混合为一个待测样品,用于氨态氮浓度、VFA浓度、DGGE 谱带图分析[5]。
1.3 检测指标与方法
1.3.1 盲肠食糜重量
将左侧盲肠取出,称重(W1);在超净台上解冻后,用手挤出全部食糜,之后再称空盲肠重(W2),两者之差为盲肠食糜重量(△W=W1-W2)。
1.3.2 无氮饲粮水分测定
无氮饲粮水分测定参照国标GB/T 6435—2006。
1.3.3 样品中二氧化钛含量测定
样品中二氧化钛含量参照Short等[6]和邓雪娟等[7]所述方法进行测定。
1.3.4 样品中氨基酸含量测定
样品中氨基酸含量用氨基酸自动分析仪进行测定,检测单位为农业部饲料效价与安全监督检验测试中心(北京),采用一般酸水解法,具体参照国标GB/T 18246—2000。
1.3.5 盲肠食糜氨态氮、VFA浓度测定
盲肠食糜氨态氮浓度测定采用Broderick等[8]所述方法,VFA浓度测定采用气相色谱法,检测单位为中国农业大学肉牛研究中心。样品前处理:0.5 g盲肠食糜4℃解冻后,以W/V=1∶2比例用超纯水稀释,加入氧化锆珠子0.1 g,涡旋分散混匀食糜,20 000×g 4℃离心20 min后取上清[9]。后续试验步骤参照高巍[10]所述。
1.3.6 盲肠食糜16S rDNA V3高变区DGGE条带谱比较
1.4 内源氨基酸基础损失计算公式
内源氨基酸基础损失的计算公式为:

式中:EAA表示内源氨基酸基础损失;AA表示无氮饲粮饲喂肉鸡的回肠食糜或粪中某氨基酸含量(mg/kg,冻干基础);TDC1表示无氮饲粮中二氧化钛含量(mg/kg,干物质基础);TDC2表示无氮饲粮饲喂肉鸡的回肠食糜或粪中二氧化钛含量(mg/kg,冻干基础)。
1.5 DGGE图谱分析
利用Quantity One软件进行条带Match分析,超出胶图全长2%的垂直距离差被视作不同条带。允许2%距离差是考虑到同一板胶不同条带可能会有迁移误差。利用Quantity One软件中Gauss Model Bands命令计算条带灰度值,并用 Gauss Model Trace表示,单位为INT×mm。随后依据具体情况选取组内共有且灰度值在所在泳道属最亮的9~15条记录灰度值,以所选条带总灰度值作为分母,求所选条带灰度值百分比,计算各饲粮所选条带灰度值百分比的平均值。这样处理主要考虑到光度计计量DNA浓度、PCR反应、DGGE操作等产生的误差不适合不同样品进行量的比较,所以条带灰度值只在同一条泳道内进行比较,后转化为条带灰度值百分比这一相对量用于观察差异条带在所属样品中的丰度情况。
1.6 数据统计分析
试验数据采用SPSS 17.0软件中独立样本T-test法进行显著性分析。结果以平均值±标准差表示,以P<0.05作为差异显著性判断标准。
2 结果
2.1 14日龄和35日龄肉鸡回肠食糜与粪中内源氨基酸基础损失量的比较
由表3可知,与回肠食糜法相比,收粪法所得的14日龄肉鸡组氨酸内源基础损失量没有显著变化(P>0.05),其余均极显著升高(P<0.01);收粪法所得的35日龄肉鸡异亮氨酸、亮氨酸、苏氨酸、酪氨酸内源基础损失量没有显著变化(P>0.05),其余均显著升高(P<0.05);其中丙氨酸基础损失量提高最多,在14日龄和35日龄均高达100%左右。
2.2 无氮饲粮对14日龄和35日龄肉鸡盲肠食糜重、氨态氮和VFA浓度的影响
由表4可知,在14日龄时,与常规饲粮组相比,无氮饲粮组肉鸡盲肠食糜重、氨态氮浓度没有显著变化(P>0.05),盲肠食糜内丁酸浓度极显著降低(P<0.01),异丁酸、戊酸浓度显著降低(P<0.05),丙酸浓度极显著升高(P<0.01)。在35日龄时,无氮饲粮组肉鸡盲肠食糜重较常规饲粮组极显著升高(P<0.01),氨态氮、乙酸、异丁酸、异戊酸和戊酸浓度均极显著降低(P<0.01)。
2.3 饲喂常规饲粮与无氮饲粮的14日龄和35日龄肉鸡盲肠食糜微生物16S rDNA V3高变区DGGE图谱条带比较分析
由图1和表5可知,在14日龄时,常规饲粮、无氮饲粮各自灰度值百分比最高的条带存在差异,常规饲粮所特有的其余条带灰度值百分比分别为8%、15%、12%、4%,无氮饲粮的分别为6%、9%、5%、10%。在35日龄时,常规饲粮所特有的条带中灰度值百分比最高的为11%,其余为7%、7%、5%;无氮饲粮所特有的条带中灰度值百分比最高的为12%,其余为10%、6%、11%。
3 讨论
3.1 内源氨基酸基础损失量测定的影响因素
内源氨基酸基础损失量受动物饲粮类型、日龄和测定方法等因素的影响[1]。Adedokun等[13]及Golian等[17]研究表明,无氮饲粮法与酪蛋白梯度回归法测得的内源氨基酸基础损失量差异不显著,他们认为无氮饲粮法是简便可行的测定内源氨基酸基础损失量的方法。Ravindran等[18]研究发现采用18%酪蛋白作为饲粮唯一蛋白质来源时,35日龄肉鸡内源氨基酸损失量显著高于14日龄。Adedokun等[13]采用无氮饲粮法对不同日龄内源氨基酸基础损失量进行测定发现,21日龄与14日龄内源氨基酸基础损失没有显著差异,但5日龄要显著高于上述2个日龄。将本试验结果与之前已有的无氮饲粮法同一日龄的数据进行比较发现,本试验35日龄数据与Ravindran等[18]研究数据基本一致,14日龄数据与 Adedokun等[13]研究数据差异显著(表6),推测产生差异的原因可能与外源指示剂种类、基础饲粮中是否添加抗生素、麻醉方式等有关。

表3 14日龄和35日龄肉鸡回肠食糜法和收粪法基础内源氨基酸基础损失量比较Table 3 Comparison of ileal digesta-based and excreta-based endogenous amino acid basal losses of broilers aged 14 and 35 days g/kg DM intake
据Adedokun等[1]综述可知,影响内源氨基酸基础损失测定值的因素如下:黏蛋白周转速度、饲粮蛋白质或氨基酸水平、饲粮纤维水平、饲粮植酸含量、指示剂种类、肠道健康、动物日龄和品种及测定方法。比较本试验与Adedokun等[13]的试验方案,其中所用肉鸡品种(Ross 308)、测定方法(无氮饲粮法)、饲粮纤维水平(占整个饲粮的5%)、肉鸡日龄(14日龄)是一致的;在指示剂方面,Adedokun等[13]采用三氧化二铬,本试验采用二氧化钛,Selle等[14]通过对已有文献比较发现,较三氧化二铬,二氧化钛及酸不溶灰分能更显著地指示出饲粮中添加植酸酶后提高的氨基酸消化率,且Oberleas等[15]研究表明三氧化二铬在食糜中分布不均;另外,本试验中因需测定微生物指标,基础饲粮中没有添加任何抗生素,这可能会导致定植于肠道的微生物数量增多,黏膜层增厚,黏蛋白周转速度增加;在麻醉方式方面,Moughan等[16]试验中发现戊巴比妥钠麻醉法一直要优于二氧化碳麻醉法。

表4 无氮饲粮对14日龄和35日龄肉鸡盲肠食糜重、氨态氮和VFA浓度的影响Table 4 Effects of the nitrogen-free diet on cecal digesta weight,ammoniacal nitrogen and VFA concentrations of broilers aged 14 and 35 days

图1 饲喂常规饲粮与无氮饲粮的14日龄和35日龄肉鸡盲肠食糜微生物16S rDNA V3高变区DGGE图谱条带Fig.1 DGGE bands of highly variable region V3 in microbial 16S rDNA from cecum of broilers fed with the conventional diet and the nitrogen-free diet at 14 and 35 days of age

表5 饲喂常规饲粮与无氮饲粮的14日龄和35日龄肉鸡微生物16 S rDNA V3高变区DGGE主要条带灰度值百分比及特异性标识Table 5 Specific identity and percentage of the main bands from DGGE of highly variable region V3 in microbial 16S rDNA from cecum of broilers fed the conventional diet and the nitrogen-free diet at 14 and 35 days of age

表6 不同试验中回肠食糜法测定饲喂无氮饲粮的肉鸡内源氨基酸基础损失量比较Table 6 Comparision of ileal digesta-based endogenous amino acid basal losses of broilers fed the nitrogen-free diet in different experiments mg/kg DM intake
3.2 盲肠微生物对收粪法测定内源氨基酸基础损失量的影响
本试验结果表明,收粪法相对于回肠食糜法可极显著地提高绝大多数氨基酸内源基础损失,产生这一差异的原因可能是盲肠微生物有较强的蛋白质合成活动和较弱的蛋白质发酵活动。在家禽体内,尿酸逆流进入盲肠后可快速分解为尿素,进而转化为氨态氮[19-20]。微生物可利用糖类代谢所产生的碳链骨架和氨态氮合成其所需的所有氨基酸和其他含氮化合物[21]。有研究者用肥育猪瘘管法直接向大肠中加入若干淀粉,结果表明,随着微生物可利用能量的增多,大肠中微生物利用氨态氮和胺从头合成微生物蛋白质活动增强[22]。本试验结果表明,相对于常规饲粮组,无氮饲粮组14日龄肉鸡氨态氮浓度没有显著变化,35日龄氨态氮浓度极显著降低,但盲肠食糜重极显著增加。同时,无氮饲粮的主要成分为葡萄糖、淀粉等易被微生物有效利用的能量底物,饲喂无氮饲粮,肉鸡盲肠食糜主要成分应是葡萄糖、淀粉。因此推测,饲喂无氮饲粮,肉鸡盲肠微生物有充足的能量碳水化合物和一定量的氨态氮进行蛋白质合成作用,可能使粪中氨基酸浓度增加。另有研究表明:谷氨酸、天门冬氨酸、丙氨酸是从成年公鸡排泄物中直接分离纯化出的微生物细胞中含量最丰富的3种氨基酸[23],摩尔百分比都在13%左右。本试验结果发现,在14日龄和35日龄时,收粪法中所得肉鸡排泄物中谷氨酸、天门冬氨酸、丙氨酸内源基础损失量显著或极显著高于回肠食糜法,绝对量差值在所有氨基酸差值中属于最大的几个,与文献[23]所述基本一致。这也表明饲喂肉鸡无氮饲粮,粪中微生物蛋白质浓度可能高于回肠食糜。在14日龄和35日龄时,相对常规饲粮,无氮饲粮组肉鸡盲肠食糜蛋白质发酵分解的标志性脂肪酸异丁酸、戊酸、异戊酸含量,至少有2种无论从浓度还是每只鸡盲肠总量上都显著降低,这表明无氮饲粮使得肉鸡盲肠微生物发酵蛋白质生成异丁酸、戊酸、异戊酸的作用显著减弱。普通 PCR、DGGE能将16S rDNA含量占某微生态环境整个微生物16S rDNA总量超过1%的微生物检测出来[24],各种微生物16S rDNA拷贝数虽然存在一定差异,但是极少会引起10倍数量级的差别[25],因此可将能在DGGE胶上探测出来的条带对应的微生物纳为在某个微生态环境下数量占优势的优势菌群。本试验中,在14日龄时,无氮饲粮组5条优势条带区别于常规饲粮组,同时不具备常规饲粮组所拥有的5条优势条带,这些差异条带灰度值占常规饲粮组优势条带总灰度值的59%,占无氮饲粮组优势条带总灰度值的72%。在35日龄时,无氮饲粮组4条优势条带区别于常规饲粮组,同时不具备常规饲粮组所拥有的4条优势条带,这些差异条带灰度值占常规饲粮组优势条带总灰度值的30%,占无氮饲粮组优势条带总灰度值的39%。因此,DGGE图谱结果分析表明,饲喂4 d无氮饲粮能改变14日龄和35日龄肉鸡原有的盲肠微生物优势菌群,且14日龄改变尤为明显。综上所述,相对于回肠食糜法,收粪法测得的内源氨基酸基础损失量显著升高的原因可能与肉鸡采食4 d无氮饲粮后,盲肠原有微生物优势菌群发生改变,微生物蛋白质合成作用增强有关。但具体哪些微生物最终引起这一变化,还需要通过DGGE差异条带回收克隆测序作进一步研究。
4 结论
相对于回肠食糜法,收粪法测得的大多数氨基酸内源基础损失量显著升高。肉鸡采食4 d无氮饲粮后,盲肠原有微生物优势菌群发生改变。
[1]ADEDOKUN S A,ADEOLA O,PARSONS C M,et al.Factors affecting endogenous amino acid flow in chickens and the need for consistency in methodology[J].Poultry Science,2011,90(8):1737 -1748.
[2]PARSONS C M,POTTER L M,BROWN R D.Effects of dietary carbohydrate and of intestinal microflora on excretion of engogenous amino acid by poultry[J].Poultry Science,1983,62(3):483 - 489.
[3]SALTERA D N,FULFORDA R J.The influence of the gut microflora on the digestion of dietary and endogenous proteins:studies of the amino acid composition of the excreta of germ-free and conventional chicks[J].British Journal of Nutrition,1974,32(3):625-637.
[4]KADIM I T,MOUGHAN P J,RAVINDRAN V.Ileal amino acid digestibility assay for the growing meat chicken-comparison of ileal and excreta amino acid digestibility in the chicken[J].British Poultry Science,2002,43(4):588 -597.
[5]ZHOU H,GONG J,BRISBIN J T,et al.Appropriate chicken sample size for identifying the composition of broiler intestinal microbiota affected by dietary antibiotics,using the polymerase chain reaction-denaturing gradient gel electrophoresis technique[J].Poultry Science,2007,86(12):2541 -2549.
[6]SHORT F J,WISEMANA G P,BOORMAN K N.Determination of titanium dioxide added as an marker in chicken digestibility studies[J].Animal Feed Science and Technology,1996,59(4):215 -221.
[7]邓雪娟,刘国华,蔡辉益,等.分光光度计法测定禽饲料和食糜中二氧化钛[J].饲料工业,2008,29(2):57-58.
[8]BRODERICK G A,KANG J H.Automated simultaneous determination of ammonia and amino acids in ruminal fluids and in vitro media[J].Journal of Dairy Science,1980,63(1):64 -75.
[9]TAYLOR R D,JONES G P D.The incorporation of whole grain into pelleted broiler chicken diets.Ⅱ.Gastrointestinal and digesta characteristics[J].British Poultry Science,2004,45(2):237 -246.
[10]高巍.猪胃肠道正常微生物区系及其凝集素活性与性质[D].硕士学位论文.北京:中国农业大学,2001.
[11]TANIKAWA T S,SONOHARA N,SAITO N,et al.Aging transition of the bacterial community structure in the chick ceca[J].Poultry Science,2011,90(5):1004-1008.
[12]YU Z T,MARK M.Comparisons of different hypervariable regions of rrs genes for use in fingerprinting of microbial communities by PCR-denaturing gradient gel electrophoresis[J].Applied and Environmental Microbiology,2004,70(8):4800 -4806.
[13]ADEDOKUN S A,PARSONS C M,LILBURN M S.Endogenous amino acid flow in broiler chicks is affected by the age of birds and method of estimation[J].Poultry Science,2007,86(12):2590 -2597.
[14]SELLE P,RAVINDRAN V,BRYDEN W L,et al.Influence of dietary phytate and exogenous phytase on amino acid digestibility in poultry:a review[J].The Journal of Poultry Science,2006,43:89 -103.
[15]OBERLEAS D,LI Y C,STOECKER J,et al.The rate of chromium transit through the gastrointestinal tract[J].Nutrition Research,1990(10):1189 -1194.
[16]MOUGHAN P J,DONKOH A.Amino acid digestibility in non-ruminants:a review[C]//FARREL D J,ed.Recent advances in animal nutrition in Austrilia.Armidale,NSW(New South Wales):Australia University of New England,1991:172 -184.
[17]GOLIAN A,GUENTER W,HOEHLER D,et al.Comparison of various methods for endogenous ileal amino acid flow determination in broiler chickens[J].Poultry Science,2008,87(4):706 -712.
[18]RAVINDRAN V,HENDRIKS W H.Recovery and composition of endogenous protein collected at the terminal ileum as influenced by the age of broiler chickens[J].Australian Journal of Agricultural Research,2004,55(6):705 -709.
[19]LACEY R E,REDWINE J S,PARNELL C B.Particulate matter and ammonia emisson factors for tunnelventilated broiler production houses in the southern US[J].American Society of Agricultural Engineers,2003,46(4):1203 -1214.
[20]KARASAWA Y.Ammoniaproductionfrom uric acid,urea and amino acids and its absorption from the ceca of the cockerel[J].Journal of Experimental Zoology,1989,252(S3):75 -80.
[21]MOAT A G,FOSTER J W,SPECTOR M P,et al.微生物生理学[M].4版.李颖,文莹,关国华,等译.北京:高等教育出版社,2009:347.
[22]MISIR R,SAUER W C.Effect of starch infusion at the terminal ileum on nitrogen balance and apparent digestibilities of nitrogen and amino acids in pigs fed meat-and-bone and soybean meal diets[J].Journal of Animal Science,1982,55(3):599 -607.
[23]PARSONS C M,POTTER L M,BROWN R D.True metabolizable energy and amino acid digestibility of dehulled soybean meal[J].Poultry Science,1981,60(12):2687-2696.
[24]CRESSMAN M D.A molecular approach to understanding the interrelation between the microbiomes in the litter and intestines of commercial broiler chickens[D].Master degree thesis.Columbus:Ohio State University,2009:18 -25.
[25]KLAPPENBACH J A,DUNBAR J M,SCHMIDT T M.rRNA operon copy number reflects ecological strategies of bacteria[J].Applied And Environmental Microbiology,2000,66(4):1328 -1333.
