对硝基苯胺催化加氢合成对苯二胺的绿色工艺
2012-09-08储政
储 政
(南化集团研究院,江苏 南京 210048)
对硝基苯胺催化加氢合成对苯二胺的绿色工艺
储 政
(南化集团研究院,江苏 南京 210048)
建立了一种以对硝基苯胺和氢气为原料、水为溶剂、Raney Ni为催化剂,进行催化加氢反应合成对苯二胺的绿色工艺。研究了以水为溶剂的可行性,考察了反应压力、反应温度、搅拌转速、对硝基苯胺用量、催化剂用量等反应条件对加氢反应的影响,以及溶剂和催化剂的重复使用性能。实验结果表明,对硝基苯胺催化加氢合成对苯二胺的适宜反应条件为:水用量400 mL、对硝基苯胺用量175 g、Raney Ni催化剂用量5.0 g、搅拌转速1 000 r/min、反应温度50 ℃、反应压力3.0 MPa;在此条件下,对硝基苯胺的转化率为100.0%,对苯二胺的收率为98.9%,对苯二胺的纯度为100.0%(w);反应过程中溶剂和催化剂可重复使用。整个工艺过程安全环保,成本低,能耗低,收益高。
对苯二胺;对硝基苯胺;Raney镍催化剂;氢气;绿色工艺
对苯二胺是一种重要的有机化工原料,主要用于生产染料、橡胶防老剂等[1]。传统的对苯二胺生产方法是以对硝基氯苯为原料,在高温、高压下与氨水(或氨气)反应制备对硝基苯胺,对硝基苯胺再经硫化碱或铁粉还原生成对苯二胺粗品,最后经重结晶提纯制得高纯度对苯二胺。该工艺最大的缺陷是工业废水多,铁粉还原产生大量铁泥,严重污染环境。采用该工艺生产的对苯二胺纯度(w)较低,一般在95%左右,要得到纯度大于99%的产品还需重结晶提纯,成本较高。近年来,有关对苯二胺合成新工艺的研究很多[2-14],但有工业化应用前景的还是在传统工艺的基础上提出的催化还原工艺[15-18],即以乙醇或甲醇为溶剂,在负载型贵金属催化剂或Raney Ni催化剂作用下进行加氢反应制备对苯二胺。该工艺有效地解决了环境污染问题,但该工艺的缺点是贵金属催化剂的价格昂贵,同时分离溶剂甲醇或乙醇的损耗高,且甲醇有毒,因此整个工艺生产成本很高且不环保。
本工作以对硝基苯胺、氢气为原料,以水为溶剂,在加氢催化剂作用下合成了对苯二胺,考察了反应条件对加氢反应的影响,同时研究了以水为溶剂的可行性和催化剂与滤液的重复使用性能。
1 实验部分
1.1 试剂和仪器
对硝基苯胺:自制;Raney Ni催化剂:苏州新华催化剂有限公司;其他试剂均为分析纯;所有用水均为去离子水。
1 L GSFH型高压反应釜:威海化工机械厂;GC-6890型气相色谱仪:安捷伦公司。
1.2 对苯二胺的制备
向高压反应釜中投入一定量的对硝基苯胺、Raney Ni催化剂和水,分别用氮气和氢气置换反应釜2~3次;控制氢气钢瓶的出口压力,向反应釜中充入一定量的氢气,加热升温至设定温度,搅拌至反应釜压力不再下降;采用沉降法分离出催化剂和反应液,反应液经冷冻盐水冷却至一定温度后,过滤,滤饼于80 ℃下真空干燥,称重,得对苯二胺。
1.3 分析测试方法
用气相色谱仪分析产物组成,采用面积归一化法计算产品纯度。对硝基苯胺转化率(X)和对苯二胺收率(Y)的计算公式为:

式中,m1为原料对硝基苯胺的质量,g;m2为过滤烘干后产品的质量,g;w1为产品中对硝基苯胺的质量分数,%;w2为产品中对苯二胺的质量分数,%;108.1为对苯二胺的相对分子质量;138.1为对硝基苯胺的相对分子质量。
本实验所使用的设备为1 L高压反应釜,因设备规模较小,研究过程中产品的机械损耗对对苯二胺收率的影响较大,因此,本实验结果中对苯二胺收率的微小变化不作为评价实验条件优劣的依据。
2 结果与讨论
2.1 水作为溶剂的可行性研究
对苯二胺在水中的溶解度,决定着以水为溶剂的可行性。测定了对苯二胺在水中的溶解度,实验结果见表1。由表1可见,对苯二胺在水中的溶解度随温度的升高而增大,且增幅较大。由此可见,在对硝基苯胺催化加氢合成对苯二胺的过程中,以水为溶剂在理论上可行。

表1 对苯二胺在水中的溶解度Table 1 The solubility ofp-phenylenediamine in H2O
2.2 反应压力对加氢反应的影响
反应压力对加氢反应的影响见表2。由表2可见,反应压力为3.0 MPa时,实验结果最好,此时对硝基苯胺的转化率为100.0%,对苯二胺收率为98.7%,对苯二胺的纯度为100.0%。因此,选择反应压力为3.0 MPa较适宜。
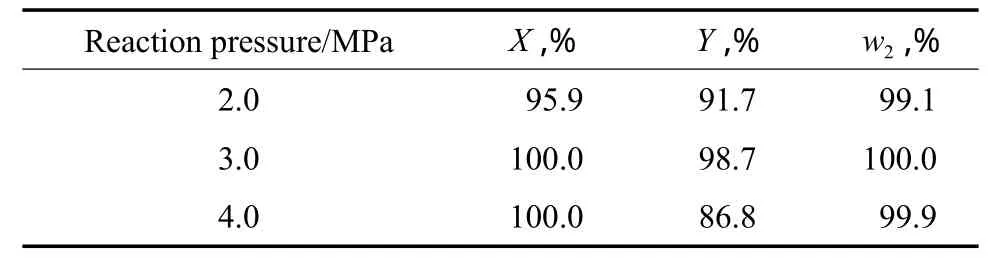
表2 反应压力对加氢反应的影响Table 2 The effect of reaction pressure on the hydrogenation
2.3 反应温度对加氢反应的影响
反应温度对加氢反应的影响见表3。

表3 反应温度对加氢反应的影响Table 3 The effect of reaction temperature on the hydrogenation
由表3可见,反应温度从40 ℃升至50 ℃,对硝基苯胺的转化率从85.2%增至100.0%,对苯二胺纯度从84.7%增至100.0%;当反应温度从50 ℃升至70 ℃时,对硝基苯胺转化率和对苯二胺纯度均为100.0%,对苯二胺的收率在98.8%左右。但从产品的外观来看,当反应温度为50 ℃时,所得的产品不仅粒度细而且颜色白,同时结晶母液中杂质的种类少,色谱分析中只出现4个杂质峰;当反应温度为60 ℃时,结晶母液中杂质的种类增至6种。因此,选择反应温度为50 ℃较适宜。
2.4 搅拌转速对加氢反应的影响
搅拌转速对加氢反应的影响见表4。由表4可见,转速由800 r/min增至1 000 r/min,加氢反应时间由3.00 h缩短至1.50 h。反应时间的缩短,有利于节能降耗,同时还可增加装置的产能。搅拌转速的改变对对硝基苯胺转化率和对苯二胺收率基本无影响。因此,选择搅拌转速为1 000 r/min较适宜。

表4 搅拌转速对加氢反应的影响Table 4 The effect of stirring speed on the hydrogenation
2.5 对硝基苯胺用量对加氢反应的影响
对硝基苯胺用量对加氢反应的影响见表5。

表5 对硝基苯胺用量对加氢反应的影响Table 5 The effect ofp-nitroaniline dosage on the hydrogenation
由表5可见,在水用量一定的情况下,随对硝基苯胺用量的增加,加氢反应时间相应延长,对苯二胺收率略有增加(对硝基苯胺用量为200 g时除外),分析对苯二胺收率增加的原因是在相同反应条件下,对苯二胺在水中的溶解量一定,对硝基苯胺的用量增加,生成的对苯二胺量也增加,冷却析出的对苯二胺量相应增多。但当对硝基苯胺用量为200 g时,对硝基苯胺大量吸附在反应釜壁和冷凝盘管上,反应进行不完全,因此,此时对硝基苯胺的转化率仅为86.3%。实验过程中,选择对硝基苯胺用量为175 g较适宜。对于工业生产,对硝基苯胺用量越大,装置的产能就越大。在产能相同的情况下,产生的废水也越少。因此,在工业生产中应尽可能增大对硝基苯胺的用量。
2.6 催化剂用量对加氢反应的影响
Raney Ni催化剂用量对加氢反应的影响见表6。由表6可见,催化剂用量从4.0 g增至6.0 g时,对硝基苯胺转化率和对苯二胺纯度无变化,但加氢反应时间却从4.00 h缩短到1.45 h。在实际生产中,催化剂用量增加会在一定程度上增加产品的生产成本;催化剂用量过少,虽然催化剂的消耗成本降低,但反应时间会延长,反应时间的延长直接影响整个装置的生产能力,同时也会增加生产过程中的动力消耗。综合成本、装置产能等因素,选择催化剂的用量为5.0 g(占对硝基苯胺质量的2.86%)较适宜。

表6 Raney Ni催化剂用量对加氢反应的影响Table 6 The effect of Raney Ni catalyst dosage on the hydrogenation
2.7 催化剂的重复使用性能
对硝基苯胺催化加氢反应结束后,将Raney Ni催化剂沉降于反应釜中,作为下一釜物料加氢还原反应的催化剂,考察催化剂重复使用性能,实验结果见表7。由表7可见,催化剂使用8次后,对硝基苯胺的转化率和对苯二胺的纯度都为100.0%,但反应时间随使用次数的增多明显延长。
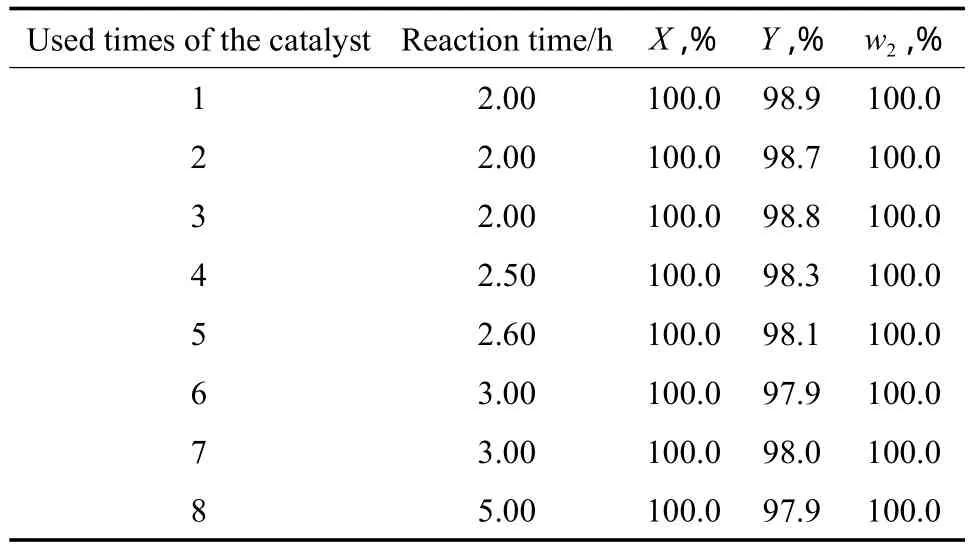
表7 Raney Ni催化剂的重复使用性能Table 7 The reusability of Raney Ni catalyst
Raney Ni催化剂使用次数与反应时间的关系见图1。由图1可见,当催化剂循环使用1~3次时,加氢反应时间不变,都为2.00 h;但当催化剂第4次使用时,反应时间延长到2.50 h;到第8次循环使用时,反应时间延长至5.00 h。反应时间延长的原因:一是催化剂在循环使用过程中有少量损失;二是随循环使用次数的增多,催化剂活性下降。所以,在工业化生产中,普遍的做法是在每次循环使用时补加少量的催化剂,循环一定次数后全部更换。
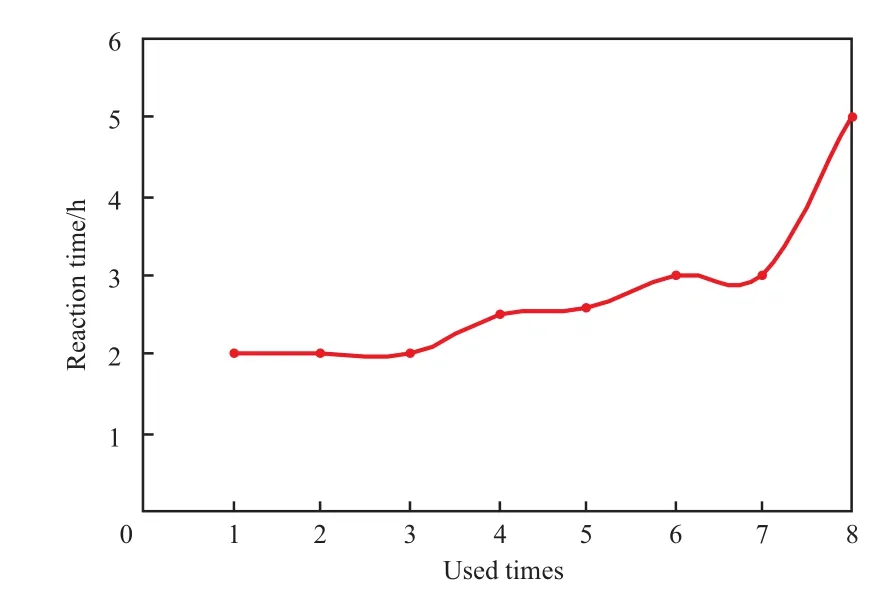
图1 Raney Ni催化剂使用次数与反应时间的关系Fig.1 The relationship between the used times of Raney Ni catalyst and reaction time. Reaction conditions referred to Table 7.
2.8 滤液重复使用次数对加氢反应的影响
将反应过程中产生的滤液代替水作为溶剂加到反应体系中,滤液体积一般为330 mL左右,补加新鲜水至400 mL,考察滤液重复使用次数对加氢反应的影响,实验结果见表8。由表8可见,滤液使用1~2次,对硝基苯胺转化率、对苯二胺纯度和反应时间均无明显变化;但滤液重复使用3次后,尽管对硝基苯胺转化率还维持在100.0%,但加氢反应时间明显延长,分析原因是滤液中的杂质吸附在催化剂表面影响了催化剂的活性。因此,工业应用中应根据实际情况考虑滤液的重复使用次数。
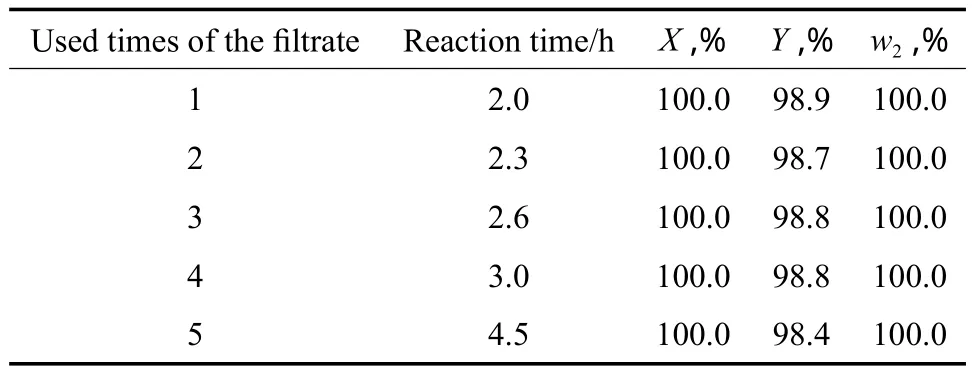
表8 滤液重复使用次数对加氢反应的影响Table 8 The effect of the used times of the fi ltrate on the hydrogenation
3 结论
(1)以对硝基苯胺和氢气为原料、水为溶剂、Raney Ni为催化剂,进行加氢反应合成对苯二胺,该工艺制得的对苯二胺不需提纯处理,对苯二胺的纯度接近100.0%,催化剂和溶剂可循环使用,整个工艺过程安全环保,成本低,能耗低。
(2)合成对苯二胺的最佳反应条件为:水用量400 mL、对硝基苯胺用量175 g、Raney Ni催化剂用量5.0 g、搅拌转速1 000 r/min、反应温度50 ℃、反应压力3.0 MPa。在此条件下,对硝基苯胺转化率为100.0%,对苯二胺收率为98.9%,对苯二胺纯度为100.0%,整个反应还原时间为2.00 h。
(3)滤液循环使用对加氢反应时间有明显影响,循环使用次数增多,反应时间明显延长,工业应用中应根据实际情况考虑滤液的循环使用情况。
[1] 李君,蒋毅,程极源. 对苯二胺类防老剂的合成[J]. 合成化学,2000,8(1):34 - 38.
[2] 崔天放,朱沧,苏燕. 对苯二胺新型合成工艺研究进展[J].精细化工中间体,2007,37(4):5 - 8.
[3] 李明慧,王井,方世东,等. 锌粉还原法合成对苯二胺的研究[J]. 光谱实验室,2001,18(6):796 - 798.
[4] 曹学增,汪学英,陈爱英. 对苯二胺生产条件的研究[J]. 应用化工,2002,3(15):34 - 36.
[5] 吕赛汉,钟爱国. 对苯二胺的合成及其谱学研究[J]. 光谱实验室,2006,23(1):136 - 137.
[6] 汪敏. 对苯二胺的合成研究[J]. 应用化工,2003,32(1):51 - 52.
[7] 魏科年,单玉华,李为民,等. 对苯二胺的合成新工艺的研究[J]. 石油化工,2005,34(2):157 - 159.
[8] 单玉华,邬国英,魏科年,等. Hofmann降解法合成对苯二胺[J]. 江苏石油化工学院学报,2002,14(3):1 - 4.
[9] 锦湖石油化学株式会社. 制备对苯二胺的新方法:中国,1332150[P]. 2002-01-23.
[10] Korea Kumho Petrochemical Co,Ltd. Method of Preparingp-Phenylenediamine:US,6245943[P]. 2000-08-16.
[11] Korea Kumho Petrochemical Co,Ltd. Preparation of 4,4′-Dinitrodiphenylamine from Urea and Nitrobenzene:US,6156932[P]. 2000-11-05.
[12] Korea Kumho Petrochemical Co,Ltd. Manufacturing Method for 4-Nitrosoaniline from Urea and Nitrobenzene:US,6198001[P]. 200l-03-06.
[13] Korea Kumho Petrochemical Co,Ltd. Production of 4-Nitrodiphenylamine and 4-Nitroanillne from Phenylurea:KR,20010009318 A[P]. 1999-07-08.
[14] Vass A,Dudas J,Toth J. Solvent-Free Reduction of Aromatic Nitro Compounds with Alumina-Supported Hydrazine Under Microwave Irradiation[J].Tetra Lett,2001,42:5347 - 5349.
[15] Maria A S,Isabel C,Guillermo G. Solvent Effects on the Reduction Potentials of Nitroanilines[J].J Chem Soc Perkin Trans,1985,2(11):1755 - 1758.
[16] 李宽义. 钯-炭低压催化加氢生产对苯二胺方法:中国,1475475[P]. 2004-02-18.
[17] 石油大学(华东). 对硝基苯胺加氢生产对苯二胺的方法:中国,1594278[P]. 2005-03-16.
[18] 唐琴,徐林,丁克鸿. 催化加氢制备对苯二胺工艺的研究[J]. 氯碱工业,2010,46(9):23 - 29.
(编辑 李明辉)
Green Process for Synthesis of p-Phenylenediamine by Catalytic Hydrogenation of p-Nitroaniline
Chu Zheng
(Research Institute of Nanjing Chemical Industry Group,Nanjing Jiangsu 210048,China)
The synthesis of p-phenylenediamine by the hydrogenation of p-nitroaniline on a Rainey nickel catalyst with water as the solvent was studied,which was a green process. The in fl uences of reaction conditions,namely reaction pressure,reaction temperature,stirring speed,p-nitroaniline dosage and catalyst dosage on the catalytic hydrogenation were investigated. The results showed that under the optimum reaction conditions:water dosage 400 mL,p-nitroaniline dosage 175 g,Raney Ni catalyst dosage 5.0 g,stirring speed 1 000 r/min,reaction temperature 50 ℃ and reaction pressure 3.0 MPa,the conversion of p-nitroaniline,the yield and purity of p-nitroaniline could reach 100.0%,98.9% and 100.0%(w),respectively. Both the solvent and the catalyst could be reused. The process is safe and environmentally friendly with low cost and low energy consumption.
p-phenylenediamine;p-nitroaniline;Raney nickel catalyst;hydrogen;green process
book=37,ebook=37
1000-8144(2012)06 - 0637 - 04
TQ 225.26
A
2011 - 12 - 23;[修改稿日期]2012 - 03 - 19。
储政(1966—),男,江苏省东台市人,博士生,高级工程师,电话 025 - 57765627,电邮 chu66458@hotmail.com。
中国石化集团资助项目(L208001)。
