乙酰肝素酶在子痫前期孕妇胎盘中的表达研究
2012-09-07周露崔敏于达
周露 崔敏 于达
大连妇产医院,辽宁大连 116000
妊娠期高血压疾病子痫前期是影响孕产妇及围生儿发病率及死亡率的严重产科并发症,其病因及发病机制较为复杂,目前,关于其病因学方面的研究有多种理论,如内皮细胞损伤、功能障碍、结构损伤、滋养细胞过度凋亡、免疫炎症反应等。近年来经过专家学者的研究发现,子痫前期重度孕妇血液中的肝素水平下降为正常孕妇的50%[1],血液呈高凝状态,临床采用肝素抗凝治疗取得了较明显的效果。1999年,以色列科学家Vlodavsky I等[2]从胎盘中成功克隆纯化出一种名为乙酰肝素酶(heparanase,Hpa)的物质,之后,对其研究深入开展。那么Hpa与孕妇肝素水平下降[1]及血管内皮损伤又有怎样的关系呢?本实验就是围绕这个问题而开展的。
Hpa是目前发现的能够降解细胞外基质(extracellular matrix,ECM)和基底膜(basement membrane,BM)主要成分硫酸乙酰肝素蛋白多糖 (heparan sulfate proteogly can,HSPGs)和侧链肝素(heparan sulfate,HS)及其衍生物的酶[3],它广泛存在于胎盘滋养细胞、血小板、巨噬细胞、活化的T、B淋巴细胞和癌细胞等多种细胞中,通过水解其底物来参与一系列的生理和病理过程,如胚胎发育、形态发生、血管形成及组织修复、炎症、自身免疫、肿瘤生长和转移等。产科领域,在胚泡植入、胎盘形成、分娩发动及产科并发症中均有较为重要的作用。Hpa在胎盘中的定位怎样?它在正常孕妇、子痫前期轻度及子痫前期重度孕妇胎盘中的蛋白含量是否有显著性差异?能否反映病情轻重?本实验用Western-blot来明确Hpa在子痫前期孕妇与正常妊娠孕妇胎盘中的定位情况及其蛋白表达水平与病情轻重的关系。
1 材料与方法
1.1 标本来源
取辽宁大连妇产医院2010年10月~2011年10月住院患者胎盘组织43例,分为3组,其中,正常对照组13例,子痫前期轻度15例,子痫前期重度15例。3组在年龄、孕周、孕产次、体重、身高等方面差异无统计学意义(P>0.05)。无妊娠期糖尿病、感染性疾病、肝、肾病和原发性高血压等疾病,且未用过与此实验相关的药物治疗。子痫前期患者的诊断标准以第七版《妇产科学》为依据。所取组织为脐带根部胎盘全层1 cm3。受试者资料详见表1。

表1 孕妇一般情况及胎儿情况
1.2 一般组织学处理
用于Western blot分析的新鲜组织,于术中切除后,立即于-80℃冰箱保存备用。
1.3 主要试剂与方法
Western-blot肝素酶一抗,碱性磷酸酶标记的羊抗鼠IgG二抗和NBT/BCIP染色试剂盒购自武汉博士得生物有限公司。取新鲜胎盘组织全层1 cm3,加入裂解缓冲液,剪碎,匀浆,低温超速离心(4℃,13 000 r/min,30 min),提取上清液为细胞总蛋白,电泳(10%SDS-PAGE凝胶),转印,5%正常小牛血清封闭,一抗(1∶500)4℃下孵育,过夜;与二抗室温下孵育1 h,NBT/BCIP显色30 min,水洗干燥,避光保存,测定灰度值比较结果。
1.4 统计学方法
应用SPSS 12.0软件进行统计学处理;乙酰肝素酶蛋白相对含量比较采用t检验,P<0.05为差异有统计学意义。
2 结果
3组标本均有Hpa蛋白表达。子痫前期轻度及重度组蛋白含量明显高于正常对照组,差异有统计学意义(P<0.001),且子痫前期重度组与轻度组结果比较,差异有统计学意义(P<0.001),见表 2、图 1。

表2 实验各组Hpa的蛋白表达结果
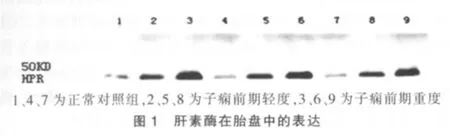
3 讨论
Hpa是一种能够降解ECM和BM的主要组成成分HSPGs、侧链乙酰肝素盐及体内肝素的内源性葡萄糖醛酸内切酶,当其发挥生物学效应时可以破坏内皮细胞的完整性及加重子痫前期孕妇血液的高凝状态[1],并以此为契机引发体内一系列的病理生理活动。早在1976年Klein U等[4]科研小组就发现了Hpa这种能够裂解ECM和BM中HSPGs、其侧链乙酰肝素盐及肝素的葡萄糖醛酸内切酶,但因纯化过程较为困难,使其发展一度较为缓慢。直到1999年,3个研究小组分别从血小板、胎盘和黑色素细胞瘤中克隆出一段相同的基因,提示目前发现哺乳动物细胞只表达一种能够降解肝素的酶即Hpa[5-6]。1999年,以色列科学家Vlodavsky I等[2]成功纯化出Hpa蛋白并克隆出其基因,将人类Hpa基因定位于4q21.3,其相对分子量约为65 000,降解后分子量为50 000的蛋白片段具有活性。
Hpa能够破坏血管内皮细胞。细胞膜和基底膜主要构成成分之一是糖氨聚糖,它的主要成分是HSPGs。HSPGs是一个由蛋白核心和数个与之共价连接的线性硫酸乙酰肝素侧链组成[7-8],对于细胞的完整性有至关重要的作用,Hpa通过酶解HSPGs及其侧链[9],可以破坏ECM和BM的完整性,同时,还可以释放并激活各种与肝素结合的活性分子破坏血管内皮完整性,使血管内皮细胞就会出现功能障碍,同时内皮受损会释放出大量的炎症介质以及介导免疫反应的活性蛋白片段,使血管内皮源性舒张因子减少,而血管内皮收缩因子血栓素A2产生增加,导致血管收缩因子和舒张因子比例失调,致血压升高[9]。同时Hpa裂解HSPGs所产生的一系列活性蛋白片断和其裂解肝素及其衍生物所致的血液高凝状态,使微小血栓形成,血管阻力增高,血压升高;同时血栓形成,血运不畅,形成酸性环境,进一步激活Hpa活性,形成恶性循环。本实验结果可见,Hpa在子痫前期轻度及重度孕妇胎盘中的蛋白表达明显高于正常对照组,而子痫前期重度孕妇胎盘中的Hpa蛋白表达又明显高于子痫前期轻度,这与血压升高趋势相同,由此推测,Hpa与子痫前期患者血压升高可能具有相关性。
Hpa破坏肝素与抗凝血酶Ⅲ的结合位点,阻碍肝素发挥抗凝作用[10],致血液处于高凝状态[11]。在以往研究发现,先兆子痫患者血清中基础肝素水平及抗凝活性比正常孕妇下降50%[1],这与本实验Hpa的变化趋势是一致的。子痫前期的孕妇,血压升高,胎盘小血管痉挛,血流量减少;血液高凝,胎盘血液流速减慢,易形成微小血栓,气体交换受到影响,胎儿供氧不足,致胎儿生长受限,胎儿窘迫,严重时会导致胎死宫内。而同时,供氧不足所致的酸性环境更加激活了Hpa的活性,形成恶性循环,导致严重并发症。本实验所选病例子痫前期组胎儿窘迫4例,胎死宫内1例,胎盘早剥1例,正常对照组胎儿情况基本正常。因本实验样本量有限,故Hpa与子痫前期孕妇并发症之间的相关性有待进一步研究证实。
Hpa酶解HSPGs破坏血管内皮后,产生的缩血管物质增加,血压升高,肾小球毛细血管痉挛,肾血流量减少,致肾缺血缺氧;Hpa降解HSPGs及HS,而HSPGs及HS是肾小球滤过膜电荷筛的主要成分,被降解后,大量阴离子丢失,肾小球滤过屏障电荷筛被破坏,即肾小球基底膜(glomerular basement membrane,GBM)多阴离子丢失,纤维蛋白沉积,内皮细胞肿胀、管腔变窄,加重肾脏的缺血缺氧;肾小球毛细血管内凝血,微血栓形成,导致肾小球萎缩,引起肾损害。肾脏上述变化可致肾小球基底膜渗透性增高,血浆蛋白自肾小球漏出,肾小管重吸收功能不全而出现蛋白尿[12]。实验所选子痫前期患者依据人民卫生出版社出版的第七版《妇产科学》中子痫前期的定义,患者的尿蛋白为阳性,正常对照组尿蛋白为阴性,其中,子痫前期轻度(+),子痫前期重度组患者(++)~(++++),总体趋势与Hpa变化一致。故Hpa蛋白表达含量增加可能是蛋白尿的产生原因之一,这点与文献报道一致[13]。
综上所述,Hpa在子痫前期孕妇胎盘中的蛋白表达水平增高可致孕妇体内肝素水平下降及血管内皮损伤,推测与妊娠期高血压疾病的发生、发展有关。随着人们对这一物质的认识深入,其在妇产科其他领域的作用也在逐步被发现。
[1]G.M.Savelieva,V.S.Efimov.Blood coagulation changes in pregnant women at risk of developing preeclampsia[J].International Journal of Gynecology and Obstetrics,1995,48:3-8.
[2]Vlodavsky I,Friedmann Y,Elkin M.Mammalian heparanase:gene cloning[J].Nat Med,1999,5:793-802.
[3]Benhamron S,Nechushtan H,Verbovetski I,et al.Translocation of Active Heparanase to Cell Surface Regulates Degradation of Extracellular Matrix Heparana Sulfate upon Transmigration of Mature Monocyte-Derived Dendritic Cells[J].J Immunol,2006,176(11):6417-6424.
[4]Klein U,Von Figura,K.Paritial purification and characterization of heparan sulfate specific endoglucuronidase[J].Biochem Biophys Res Commun,1976,73:569-576.
[5]Hulett MD,Freeman C,Hamdorf BJ,et al.Cloning of mammalian heparanase,animportant enzyme in tumor invasion and metastasis[J].Nat Med,1999,5(7):803-809.
[6]Gilat D.Molecular behavior adapts to context:heparanase functions as an extracellular matrix degrading enzyme or as a T cell adbesion molecule depending on the local pH[J].J Exp Mol,1995,181:1929.
[7]Friedmann Y,Vlodavsky I.Expression of heparanase in normal,dysplastic,and neoplastic human colonic mucosa and stroma.Evidence for its role in colonic tumorigenesis[J].Am J Pathol,2000,157(4):1167-1175.
[8]Rapraeger AC.The coordinated regulation of heparan sulfate,syndecans and cell behavior[J].Curr Opin Cell Biol,1993,5(5):844.
[9]褚红女,黄荷凤.肝素酶在产科领域中的应用[J].中华妇产科杂志,2003,38(7):444-445.
[10]Haimov-Kochman R,Friedmann Y,Prus D,et al.Localization of heparanase in normal and pathological human placenta[J].Mol Hum Reprod,2002,8:566-573.
[11]NJ,Nasser,GSarig,etal.Heparanaseneutralizestheanticoagulationproperties of heparin and low-molecular-weight heparin[J].Jounal of Thrombosis and Haemostasis,2006,4:560.
[12]Raats CJ,Van Den Born J,Berden JH.Glomerular heparan sulfate alternation:Mechanisms and relevance for proteinuria[J].Kidney Int,2000,57(2):385.
[13]Mitsuhashi H,Tsukada Y,Ono K,et al.Urine glycosam inoglycans and heparan sulfate excretion in adult patients with glomerular diseases[J].Clinical NepHrology,1993,39(5):231.
