砷及砷的形态检测方法的研究现状
2012-09-06张金玲钟耀广孙晓红邓健康
张金玲,钟耀广,孙晓红,邓健康,林 栋
(上海海洋大学食品学院,上海201306)
砷是一种自然界常见的非金属元素,具有较强的毒性,砷及其化合物对体内酶蛋白的巯基具有特殊的亲合力,使酶失去活性,影响细胞的正常代谢,导致细胞死亡[1]。砷在自然界分布广泛,动、植物机体中都含有微量的砷。据报道,海水砷含量为2.30ng·kg-1,工业城市毗邻的水域砷含量达140~1000ng·kg-1[2]。我国大部分地区的蔬菜中均检出含砷[3]。大量的研究表明:粮食、水果、蔬菜、肉类、乳、蛋类、鱼类及其制品、茶叶等食品中均有砷检出,部分食品砷含量超过了国家安全卫生标准[4]。随着人们对砷研究的深入,根据世界卫生组织(WHO)报告显示,人体每天摄入1.5mg的砷可以导致慢性中毒,而每天摄入0.15mg将对某些人群产生长期影响。日本公布了水中砷的限量为0.01mg·L-1,欧盟规定饮用水中砷的限量为 10μg·L-1[5-6],美国环保署 2002 年修订《国家一级饮用水规程》,将砷元素限量由原来的50μg·L-1降至 10μg·L-1。我国制定的标准规定:饮用水中砷含量不得超过50μg·L-1,食品中总砷的允许限量不得超过1.0mg·kg-1,海藻中无机砷的允许限量不得超过1.5mg·kg-1。随着国内外对砷限量要求的不断提高,砷的检测技术也不断地得到改进[7]。因此,准确、快捷、有效地测定砷,成为近年来分析方法研究中的重要内容。砷的毒性不仅与砷元素总量有关,还与其存在的化学形态密切相关[8]。砷的形态大致可分为有机砷和无机砷,无机砷主要形态表现为亚砷酸盐As(III)和砷酸盐As(V)两种,均具有较强的毒性,甲基化的砷毒性会变小,如砷甜菜碱和砷胆碱[9],各形态砷的毒性大小顺序为:AsH3>亚砷酸盐As(III)>砒霜(As2O3)>砷酸盐As(V)>一甲基砷酸(MMA)>二甲基砷酸(DMA)>砷甜菜碱(AsB)>砷胆碱(AsC)[10]。所以,砷的形态检测尤为重要。本文对砷及其形态的检测方法进行了介绍,并阐述各检测方法的优缺点,展望了砷及其形态检测的发展趋势。
1 分光光度法
1.1 砷斑法(Gutzeit法)
在酸性条件下,用还原剂将三价砷还原为砷化氢。砷化氢气体碰到溴化汞试纸片时,与溴化汞反应生成黄色至橙色的色斑。砷含量可通过与已知砷浓度的标准溶液形成标准色阶比色定量。由于砷斑法不需要分析仪器,操作简单,灵敏度高,所以比较适合条件简陋的实验室,或者现场监测的半定量分析或产品的定级,可作为大批量样品中砷的筛查。通过颜色对比,检测限可达 10μg·L-1[11],GB/T5750-2006中相对标准偏差为34%,相对误差为28%。Abrazheev等[12]对测砷装置进行改进并用计算机对实验数据进行处理,可将测定误差降低至10%以下,检出限可达0.01mg·L-1。
砷斑法的优点是快速、简便,缺点是以溴化汞为产生砷斑的基准物,其对光敏感易变色,固态溴化汞与砷化氢作用慢且不易完全,产生颜色深浅不一,而且专属性差,易产生干扰,目视法偏差较大。
1.2 砷钼蓝光度法
此法是利用砷在硫酸或硝酸中与钼酸盐络合生成砷钼杂多酸,用还原剂(氧化亚锡,抗坏血酸等)还原成砷钼蓝,比色定量。该法灵敏度不及砷斑法,但准确度比其高。研究表明,用此法测定水中的砷(As)检出限可达20μg·L-1,较高浓度的硅酸盐或硫酸盐(10~30μg·mL-1)不干扰测定[13]。彭翠红等[14]提出加入草酸溶液作为掩蔽剂,控制溶液中钼酸铵的浓度,防止钼酸铵的还原。在提高灵敏度方面,利用碱性染料和表面活性剂与砷钼杂多酸生成多元络合物体系,提高了选择性和灵敏度。这些染料包括罗丹明B染料、甲基绿和孔雀石绿等[15]。
1.3 银盐法(二乙氨基二硫代甲酸银)
在酸性介质中,样品经消化后,在碘化钾、氯化亚锡存在条件下,五价砷将还原为三价砷。用氯化亚锡与碘化钾将砷酸还原为亚砷酸,然后用金属锌将亚砷酸还原为砷化氢气体,方程式为:
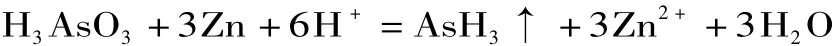
逸出的砷化氢气体用含有少量有机碱的银盐(Ag-DDTC)溶液吸收:
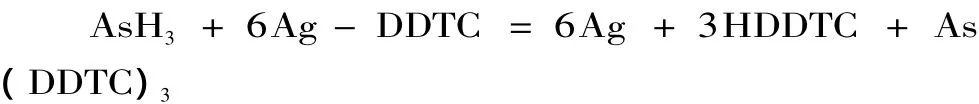
此时,析出棕红色的胶态银,在波长510nm处有最大吸收,借此进行砷的比色测定[16]。食品和水质中砷检出限分别为0.2mg·kg-1和0.01mg·L-1。该法是食品及水质的砷检测中最经典的方法。优点是仪器设备简单、方法易于推广、精密度和准确度都较高,但需要注意的是,所用锌粒大小要适度才能保证反应的正常进行。
陈辉等[17]比较原子荧光法与银盐法测定海苔中的无机砷含量的效果,认为银盐法回收率较好,原子荧光法回收率和测定结果均偏高,并且重现性不理想,两种方法有统计学差异。用银盐法测定海苔中的无机砷,比原子荧光法可靠。银盐法比光度法、取代砷斑法、目测法,灵敏度和准确度均有提高,但其发生砷化氢主体部分仍承袭砷斑法,其主要的缺点是反应时间长,并且二乙基硫代氨基甲酸银吸收液不稳定、易挥发、有毒、分析周期长。为解决上述问题,发展了新银盐光度法。
新银盐光度法用硝酸-硝酸银-聚乙烯醇-乙醇溶液为吸收液,将其中银离子还原成单质银(聚乙烯醇为分散剂),使溶液呈黄色胶体,在400nm波长处测定溶液的吸光度。新银盐光度法与砷斑法、二乙基硫代氨基甲酸银法相比较,具有方法简单、准确、灵敏、再现性好、试剂无毒等优点[18]。
2 光谱法
2.1 原子荧光光谱法(AFS)
原子荧光光谱法具有原子吸收光谱和原子发射光谱两种技术优势,是一种优良的痕量分析技术[19],目前氢化物发生-原子荧光光谱法已成为测定砷的标准方法。
原理:在酸性介质中,硫脲-抗坏血酸把As(V)还原成As(III),再以硼氢化钾或硼氢化钠作为还原剂还原成砷化氢气体,砷化氢由载气(氩气)带入石英原子化器,受热分解为原子态砷,在特制砷空心阴极灯的照射下,基态砷被激发至高能态,在去活化回到基态时,发射特征波长的荧光,在一定的浓度范围内,其荧光强度与砷含量成正比,与标准系列比较定量[20]。在食品中检出限达 0.01mg·kg-1,在水质检测中可达1μg·L-1。王凯等[21]采用微波消解法对海产品进行前处理,应用原子荧光光谱法测定海产品中微量的砷,通过单因素实验对仪器条件进行优化,结果方法检出限为0.0716ng·mL-1,砷的加标回收率在91.9%~104.6%之间,平均回收率为97.2%,变异系数为0.68%~1.03%,测定结果令人满意。Cava等[22]采用HG-AFS法测定牛奶中总砷含量,样品经微波消解后自动进样,检出限为0.006ng·mL-1,平均相对标准偏差为2.3%。侯淑敏[23]等对氢化物原子荧光法快速测定水产中无机砷进行了研究,对市售的3种鱼样中无机砷含量进行测定,该文章优化了前处理和检测的条件,认为80℃、5h的样品浸提条件和10.0g·L-1的还原剂浓度检测效果好。
2.2 原子吸收光谱法(AAS)
原子吸收光谱法(AAS)的原理是:样品经前处理后,砷以离子状态存在于试液中,当试液中砷被原子化后,基态原子吸收来自砷空心阴极灯发出的共振线,其吸收量与砷含量成正比,根据测量被吸收的谱线强度与标准系列比较进行定量。测量砷时大多采用氢化物发生-原子吸收光谱法(HG-AAS)和氢化物发生-石墨炉原子吸收光谱法(HG-GF-AAS)[24]。Moretto等[25]采用流动注射氢化物原子吸收光谱法测定鱼中砷含量,将VC-KI溶于5mol·L-1HCl中,可消除干扰离子的作用,每小时进样135次,检出限为0.34μg·L-1,线性范围 > 30μg·L-1,RSD=1.8%(30μg·L-1)。Oscar Díaz 等[26]研究了智利沿海的14种重要藻类中总砷和无机砷含量,包括绿藻1种、褐藻3种、红藻10种。总砷采用干法灰化,无机砷采用酸提取,用氢化物发生-原子吸收光谱法进行测定,总砷含量在3.0~68.0mg·kg-1,无机砷含量在0.15~1.06mg·kg-1,表明这些藻类中无机砷含量未超标。原子吸收光谱法、原子荧光光谱法及与其他设备联用技术也用于砷形态的分析,表1归纳了近年来用这些技术测定样品中砷形态及方法。
2.3 电感耦合等离子体-原子发射光谱法(ICPAES)
电感耦合等离子体-原子发射光谱(ICP-AES)法具有基体效应小、检出限低、测量精度高、线性范围宽、多元素同时检测等优点。由于样品基质的复杂性,消除光谱干扰、降低基体影响就成为ICP-AES法在食品分析中必须关注的问题[41]。该法可同时测定多种元素,在检测方面应用广泛。周世萍等[42]研究了超声雾化进样条件下,影响ICP-AES谱线强度和测量精密度的主要因素,比较了超声雾化进样和气动雾化进样条件下As、Pb、Cu等8种元素的检出限,结果表明,超声雾化技术进样有助于改善ICP-AES测定的灵敏度。
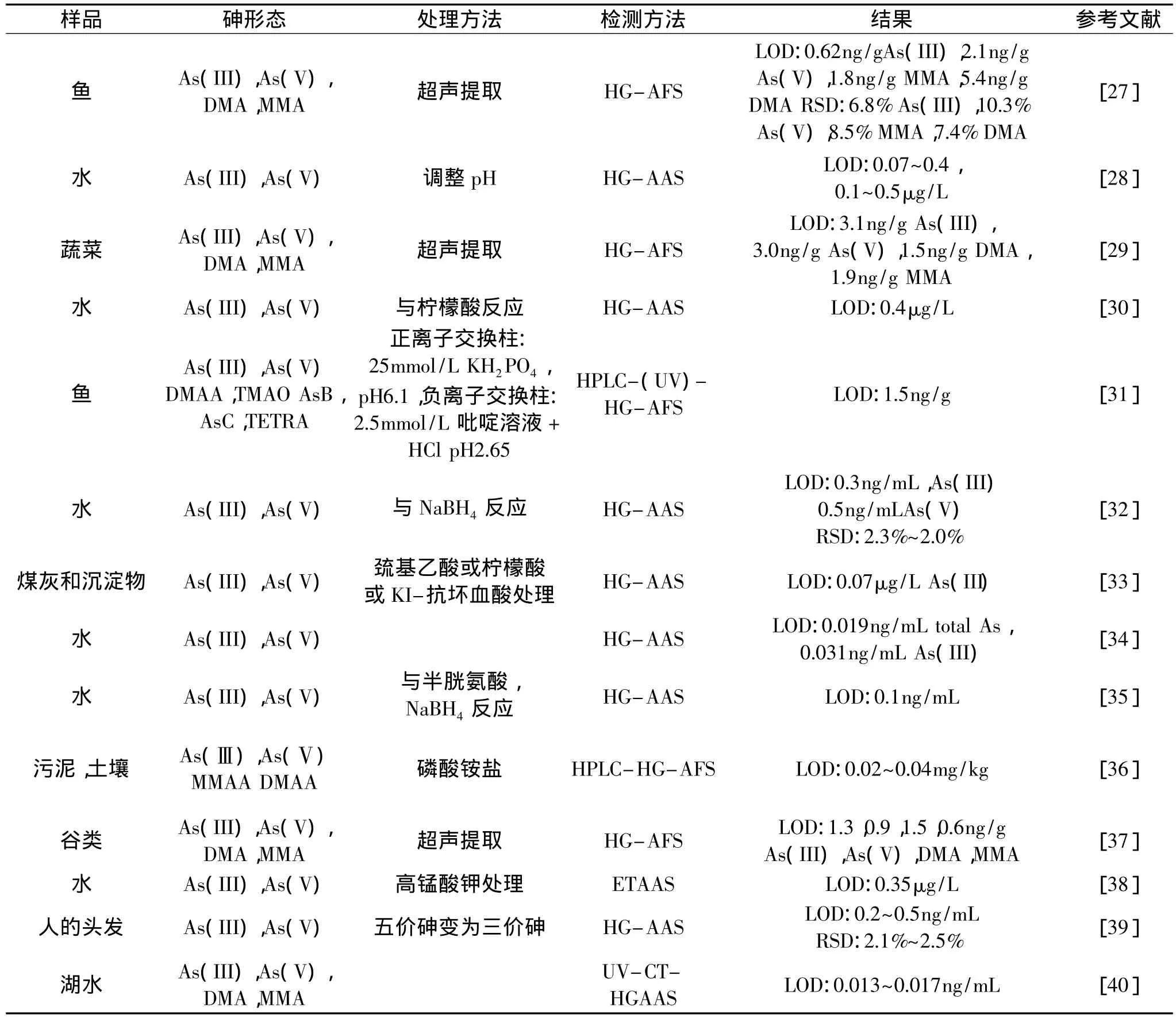
表1 原子吸收光谱法和原子荧光光谱法用于砷的形态分析Table 1 AAS and AFS used in species analysis of arsenic
3 电感耦合等离子体质谱技术(ICP-MS)
电感耦合等离子体质谱法(ICP-MS)是近10年发展最快的超痕量分析方法,它能一次完成从1×10-12~1×10-6的几十种元素的分析,并能同时检测同位素,是目前元素分析中灵敏度高、检测限低的方法之一[43]。虽然ICP-MS功能强大,但价格较贵,维护要求较高。特别是用于检测复杂样品时,由于基体干扰问题严重,必须对不同样品采取不同的处理措施,因此对操作人员要求较高[44]。Rubio 等[45]研究了样品前处理和提取方式对海藻和水产品中砷的形态有很大影响,用液相色谱-电感耦合等离子体质谱法分析了海藻和水产品中砷的形态,分析主要包括前处理和提取方式,研究表明:前处理和提取方式两步对分析结果起着十分重要的作用,不同种类的藻类和水产品经不同前处理和提取,检测得砷的形态差异很大,方法的 RSD 为3.2%。Llorente-Mirandes[46]等介绍了加泰罗尼亚地区沿海藻类中砷化物的检测,分析了10种藻类的总砷含量,通过微波消解电感耦合等离子体质谱法进行检测,总砷含量范围是2.9~39.0mg·kg-1。同时文章还对砷化物的形态进行了分析,包括 As(III),As(V),MA,DMA,AB,AC等。经检测链藻属和松藻属含砷量很高,不同种属中砷的形态差异很大。
高效液相色谱(HPLC)与ICP-MS的结合能够有效解决砷的形态分析问题,因为ICP-MS具有灵敏度高、干扰少、可进行连续测定、多元素同时检测、动态范围宽等优势,使得HPLC与ICP-MS联用进行元素形态分析具有诸多优点。而且,ICP-MS是一种极佳的检测系统,其检出限比ICP-AES还低2至3个数量级[47]。
表2归纳了近年来用不同质谱联用技术测定不同样品中各种砷的形态及含量。
4 快速检测法
砷的快速检验,一般采取经典的“雷因须氏法”为基本定性实验。
原理:在酸性条件下,砷化物与金属铜作用,产生反应,砷化物使铜的表面变成灰色或黑色。实验呈阳性反应时,表示样品中可能含有砷,现场监测时可作基本定论并采取相应措施,条件许可或中毒物定性时可再分别加以确证,主要用于预防以三氧化二砷(砒霜)为代表的剧毒砷化物等的混入、掺入食品中的监测和中毒物的筛选、定性鉴别。
快速试剂盒法基于砷斑法原理,产生砷化氢气体通过溴化汞试纸生成黄棕色斑点,与标准比色卡比较砷斑颜色的深浅从而进行砷定量。程晓天等人[61]对快速试剂盒法和HG-AFS法检测水中砷的含量进行了比较,表明速测法操作简单,可以在现场应用。用速测法初步筛选,用HG-AFS对速测法结果含砷定量分析,既可减少工作量,又能保证分析结果的可靠性,完全能满足地方性砷中毒工作的需求,在地方性砷中毒的现场样品的筛查中具有重要的意义。
Forzani[62]等研制出一种能现场快速检测砷的等离子体共振传感器,用几个含硫醇的有机化合物作为检测器的探头,在水的检测中已得到应用。该法对水中砷的检测不需前处理,简单、快速。
5 其他方法
除以上常用的方法之外,电化学方法、生物传感技术、离子色谱法、衍生气相色谱法、微型核反应堆中子活化法、动力学法、化学发光法、X射线荧光法等也可用于测定微量砷。
砷及砷的形态检测方法很多,并且每种方法都各有优劣。分光光度法灵敏度低,操作繁琐,只能分析比较简单的砷化物。荧光光谱法是测定砷的经典方法,具有灵敏度高的优点,但该法操作繁琐费时。ICP-MS法测定灵敏度高,但价格昂贵,一般实验室不具备,不易普及。色谱法是一种高效分离工具,但能同时分离多种砷形态的色谱系统不多,而且操作十分繁琐。

表2 液相色谱-质谱联用技术分析砷的形态Table 2 Arsenic species determination by high performance liquid chromatography-mass spectrometry technique
6 展望
随着科学技术的迅猛发展,重金属的检测技术将日益准确可靠,检测方法将朝着更简便、更快速、灵敏度高、检测限低、高度自动化的方向发展。今后的主要任务是进一步研究能实现各种砷形态的高效分离技术,以及研究高灵敏、高选择性测定痕量砷的分析方法。分离能力强、重现性高的HPLC技术与HG-AFS、ICP-MS等的联用技术仍是研究重点,将会是测定不同形态砷的主要研究方向。
[1]Norwood WP,Borgmann U,Dixon DG.Chronic toxicity of arsenic,cobalt,chromium and manganese to hyalella azteca in relation to exposure and bioaccumulation[J].Environmental Pollution,2007,147(1):262-272.
[2]潘乐.黄山贡菊中痕量镉和砷的测定法研究[D].南京:南京理工大学,2010.
[3]王小骊,张永志,王钢军,等.蔬菜中有害重金属元素污染研究进展[J].浙江农业学报,2004,16(5):259-262.
[4]中国国家标准化管理委员会.GB2762-2005食品中污染物限量[S].北京:中国标准出版社,2005:59.
[5]WHO.Guidelines for drinking water qualilty:health criteria and other supporting information[S].Switzerland,1992:151.
[6]沈静薇,杨滨,滕桂兰,等.砷测定方法进展[J].劳动医学,2000,17(1):42.
[7]Dan Melamed.Monitoring arsenic in the environment:a review ofscience and technologies with the potentialfor field measurements[J].Analytica Chimica Acta,2005,532(1):1-13.
[8]Rahman MA,Hasegawa H,Lim RP.Bioaccumulation,biotransformation and trophic transfer of arsenic in the aquatic food chain[J].Environmental Research,2012,166:118-135.
[9]Ilgen AG,Rychagov SN,Trainor TP.Arsenic speciation and transport associated with the release of spent geothermal fluids in Mutnovsky field(Kamchatka,Russia)[J].Chemical Geology,2011,288(3/4):115-132.
[10]Geng Wenhua,Komine Rieko,Ohta Toshiharu,et al.Arsenic speciation in marine product samples:Comparison of extraction HPLC method and digestion-cryogenic trap method[J].Talanta,2009,79(2):369-375.
[11]Kinniburgh DG,Kosmus W.Arsenic contamination in groundwater:some analytical considerations[J].Talanta,2002,58(1):165-180.
[12]Abrazheev RV,Zorin AD.An improved apparatus for determining microgram amounts of arsenic by the gutzeit method using computer-assisted data processing[J].Journal of Analytical Chemistry,2002,57(3):280-283.
[13]Lenoble V,Deluchat V,Serpaud B,et al.Arsenite oxidation and arsenate determination by the molybdene blue method[J].Talanta,2003,61(3):267-276.
[14]彭翠红,奚长生,曾懋华,等.草酸—砷钼蓝分光光度法测定砷[J].光谱实验室,2004,21(4):684-687.
[15]贺晓唯,陈永杰,张石,等.铜箔电解液中砷的测定[J].冶金分析,2004,24(3):38-39.
[16]邓樱花,苏明伟,华丽,等.土壤中砷的检测方法进展[J].湖北第二师范学院学报,2011,28(2):33-36.
[17]陈辉,于平胜,刘振林.海苔中无机砷测定方法的对比[J].现代预防医学,2009,36(1):125-127.
[18]龚文杰,马建明,邬晨阳.新银盐法测定保健食品中的砷[J].预防医学文献信息,2003,9(5):564-565.
[19]Correia CLT,GonçalvesRA,Azevedo MS,etal.Determination of total arsenic in seawater by hydride generation atomic fluorescence spectrometry[J].Microchemical Journal,2010,96(1):157-160.
[20]Zhang N,Fu N,Fang ZT,et al.Simultaneous multi-channel hydride generation atomic fluorescence spectrometry determination of arsenic,bismuth,tellurium and selenium in tea leaves[J].Food Chemistry,2011,124(3):1185-1188.
[21]王凯,高群玉.微波消解-原子荧光光谱法测海产品中的微量砷[J].现代食品科技,2009,25(7):848-851.
[22]Cava MP,Cervera ML,Pastor A,et al.Determination of arsenic and antimony in milk by hydride generation atomic fluorescence spectrometry[J].Talanta,2005,60(4):787-799.
[23]侯淑敏,向太吉,问思恩.氢化物原子荧光法快速测定水产中无机砷[J].微量元素与健康研究,2012,29(2):45-46.
[24]Emilene MB,Morgana BD,Wiliam BD,et al.Development of an analytical method for the determination of arsenic in gasoline samples by hydride generation-graphite furnace atomic absorption spectrometry[J].Spectrochimica Acta Part B,2012,71-72:102-106.
[25]Moretto AL,Cadore S.Determination of arsenic in food samples by hydride generation atomic absorption spectrometry[J].Mikrochimica Acta,2004,146(3/4):239-244.
[26]Díaz O,Tapia Y,Munoz O,et al.Total and inorganic arsenic concentrations in different species of economically important algae harvested from coastal zones of Chile[J].Food and Chemical Toxicology,2012,50(3/4):744-749.
[27]Cava-Montesinos P,Nilles K,Cervera ML,et al.Nonchromatographic speciation of toxic arsenic in fish[J].Talanta,2005,66(4):895-901.
[28]Narcise CS,Coo L,Mundo FR.On-line preconcentration and speciation of arsenic by flow injection hydride generation atomic absorption spectrophotometry[J].Talanta,2005,68(2):298-304.
[29]Matos Reyes MN,Cervera ML,Campos RC,et al.Nonchromatographic speciation of toxic arsenic in vegetables by hydride generation-atomic fluorescence spectrometry after ultrasound-assisted extraction[J].Talanta,2008,75(3):811-816.
[30]Maity S,Chakravarty S,Thakur P,et al.Evaluation and standardisation of a simple HG-AAS method for rapid speciation of As(III)and As(V)in some contaminated groundwater samples of West Bengal,India[J].Chemosphere,2004,54(8):1199-1206.
[31]Šlejkovec Z,Bajc Z,Doganoc DZ.Arsenic speciation patterns in freshwater fish[J].Talanta,2004,62(5):931-936.
[32]Coelho NMM,Silva AC,Silva CM,et al.Determination of As(III)and total inorganic arsenic by flow injection hydride generation atomic absorption spectrometry[J].Analytica Chimica Acta,2002,460(2):227-233.
[33]Gonzalez JC,Lavilla I,Bendicho C.Evaluation of nonchromatographic approaches for speciation of extractable As(III)and As(V)in environmental solid samples by FI-HG-AAS[J].Talanta,2003,59(3):525-534.
[34]Niedzielski P,Siepak M.Speciation analysis of inorganic form of arsenic in ground water samples by hydride generation atomic absorption spectrometry with insitu trapping in graphite tube[J].Central European Journal of Chemistry,2005,3(1):82-94.
[35]Cordos EA,Frentiu T,Ponta M,et al.Distribution study of inorganic arsenic(III)and(V)species in soil and their mobility in the area of Baia-Mare,Romania[J].Chemical Speciation and Bioavailability,2006,18(1):11-25.
[36]Vergara GM,Bohari Y,Astruc A,et al.Speciation analysis of arsenic in environmental solids reference materials by highperformance liquid chromatography-hydride generation-atomic fluorescence spectrometry following orthophosphoric acid extraction[J].Anal Chim Acta,2001,441(2):257-268.
[37]Matos-Reyes MN,Cervera ML,Campos RC,et al.Determination of arsenite,arsenate,monomethylarsonic acid and dimethylarsinic acid in cereals by hydride generation atomic fluorescence spectrometry[J].Spectrochimica Acta Part B:Atomic Spectroscopy,2007,62(9):1078-1082.
[38]Coelho LM,Coelho NMM,Arruda MAZ,et al.On-line bidirectionalelectrostacking forAs speciation/preconcentration using electrothermal atomic absorption spectrometry[J].Talanta,2007,71(1):353-358.
[39]Li X,Jia J,Wang ZG.Speciation of inorganic arsenic by electrochemical hydride generation atomic absorption spectrometry[J].Analytica Chimica Acta,2006,560(1/2):153-158.
[40]Anawar HM.Arsenic speciation in environmental samples by hydride generation and electrothermal atomic absorption spectrometry[J].Talanta,2012,88:34-42.
[41]Cheng YG.ICP-AES Determination of 15 Kind of impurity elements in the vanadium-aluminum alloy[J].Procedia Engineering,2011,24:447-453.
[42]周世萍,段昌群,付惠.超声雾化进样技术在ICP-AES中的应用研究[J].光谱学与光谱分析,2009,29(8):2254-2257.
[43]Leufroy A,Noël L,Dufailly V,et al.Determination of seven arsenic species in seafood by ion exchange chromatography coupled to inductively coupled plasma-massspectrometry following microwave assisted extraction:Method validation and occurrence data[J].Talanta,2011,83(3):770-779.
[44]Komorowicz I,Bara kiewicz D.Arsenic and its speciation in watersamples by high performance liquid chromatography inductively coupled plasma mass spectrometry-Last decade review[J].Talanta,2011,84(2):247-261.
[45]Rubio R,Ruiz-Chancho MJ,Lo'pez-Sa'nchez JF.Sample pre-treatment and extraction methods that are crucial to arsenic speciation in algae and aquatic plants[J].Trends in Analytical Chemistry,2010,29(1):53-69.
[46]Llorente-Mirandes T,Ruiz-Chancho MJ,Barbero M,et al.Measurement of arsenic compounds in littoral zone algae from the Western Mediterranean Sea Occurrence of arsenobetaine[J].Chemosphere,2010,81(7):867-875.
[47]田靖,陈昌云.砷形态分析技术研究进展[J].化学分析计量,2011,20(5):92-95.
[48]Heitland P,Koster HD.Comparison of different medical cases in urinary arsenic speciation by fast HPLC-ICP-MS[J].International Journal of Hygiene and Environmental Health,2009,212(4):432-438.
[49]Heitland P,Koster HD.Fast determination of arsenic species and total arsenic in urine by HPLC-ICP-MS:concentration ranges for unexposed German inhabitants and clinical case studies[J].J Anal Toxicol,2008,32(4):308-314.
[50]James WD,Raghran T,Gentry TJ,et al.Arsenic speciation:HPLC followed by ICP-MS or INAA[J].J Radioanal Nucl Chem,2008,278(2):267-270.
[51]Verdon CP,Caldwell KL,Fresquez MR,et al.Determination of seven arsenic compounds in urine by HPLC-ICP-DRC-MS:a CDC population biomonitoring method[J].Anal Bioanal Chem,2009,393(3):939-947.
[52]DausB,Mattusch J,Wennrich R,etal.Analytical investigations of phenyl arsenicals in groundwater[J].Talanta,2008,75(2):376-379.
[53]Daus B,Hempel M,Wennrich R,et al.Concentrations and speciation of arsenic in groundwater polluted by warfare agents[J].Environmental Pollution,2010,158(11):3439-3444.
[54]Rabieh S,Hirner AV,Matschullat J.Determination of arsenic species in human urine using high performance liquid chromatography(HPLC)coupled with inductively coupled plasma mass spectrometry(ICP-MS)[J].J Anal At Spectrom,2008,23(4):544-549.
[55]Button M,Jenkin GRT,Harrington CF,et al.Human toenails as a biomarker of exposure to elevated environmental arsenic[J].J Environ Monit,2009,11(3):610-617.
[56]Diaz-Bone RA,Hollmann M,Wuerfel O,et al.Analysis of volatile arsenic compounds formed by intestinal microorganisms:rapid identification ofnew metabolic products by use of simultaneousEI-MS and ICP-MS detection aftergas chromatographic separation[J].J Anal At Spectrom,2009,24(6):808-814.
[57]Sirot V,Gue’rin T,Volatier JL,et al.Dietary exposure and biomarkers of arsenic in consumers of fish and shellfish from France[J].Sci Total Environ,2009,407(6):1875-1885.
[58]Suzuki Y,Shimoda Y,Endo Y,et al.Rapid and effective speciation analysis of arsenic compounds in human urine using anion-exchange columns in HPLC-ICP-MS[J].J Occup Health,2009,51(4):380-385.
[59]Slejkovec Z,Falnoga I,Goessler W,et al.Analytical artefacts in the speciation of arsenic in clinical samples[J].Anal Chim Acta,2008,607(1):83-91.
[60]Castillo A,Roig-Navarro AF,Pozo OJ.Capabilities of microbore columns coupled to inductively coupled plasma mass spectrometry in speciation of arsenic and selenium[J].Journal of Chromatography A,2008,1202(2):132-137.
[61]程晓天,张杰,李军,等.快速试剂盒法与原子荧光法测定水砷含量结果比较[J].中国地方病防治杂志,2005,20(1):36-37.
[62]Forzani ES,Foley K,Westerhoff P,et al.Detection of arsenic in groundwater using a surface plasmon resonance sensor[J].Sensors and Actuators,2007,123(1):82-88.
