桉叶脂肪酸提取成分的MS优化分析
2012-09-06吴志华杨巧丽李天会谢耀坚
吴志华,杨巧丽,李天会,张 婧,谢耀坚
(国家林业局桉树研究开发中心,广东湛江524022)
桉树(Eucalyptus)是我国南部地区广泛种植的重要人工林树种[1],除作为速生丰产林生产木材外,其叶可入药,是我国广西、云南和四川等地常用的中药材;由桉叶油(桉叶蒸馏所得精油)中分离提纯的1,8-桉叶油素,可以治疗流感、咳嗽、肠炎、痢疾、风湿骨痛、湿疹、神经性皮炎等[1-2]。医药、化工上利用的主要桉叶品种是富含桉叶油素的主蓝桉(Eucalyptus globulus)和柠檬桉(E.citriodora)等少数几个种,而作为我国桉树主栽品种之一的尾巨桉(E.urophylla×E.grandis),因其含1,8-桉叶油素精油的含量相对较低被废弃,未得到有效利用。目前研究中多针对桉叶精油成分,也有对桉叶黄酮类化合物[3]、鞣质及酚类[4-5]等成分的分析报道。国内外有关分析桉叶脂肪酸组成成分的报道中,多与抗寒性有关[6-8],而关于桉叶片脂肪酸资源和利用方面的报道不多。目前脂肪酸分析测检方法以气相色谱-质谱(GC-MS)居多,在色谱条件中如程序升温初始温度和升温速率对成分分离快慢和分离好坏有直接关系,因此色谱条件是否能满足分析需求还存在疑问。响应面法(RSM,response surface methodology)通过一系列确定性的“实验”拟合响应面来模拟真实极限状态曲面,从而很容易地进行可靠性分析,因其具备经济性、实验次数少和实验时间较短等特点[9],广泛用于实验参数优化过程中[10]。本研究在前期基础上,以超声波获得的尾巨桉DH32-29叶片脂肪酸提取物为材料,对脂肪酸组成成分检测中GC-MS色谱条件进行了优化实验,旨在建立行之有效的桉叶脂肪酸的检测方法,为桉叶资源评估以及开发利用提供技术支持。
1 材料与方法
1.1 材料与仪器
桉叶 来源于尾巨桉DH32-29,为2年生健康植株树冠中部的叶片,2011年4月12日于广东湛江市遂溪的南方国家级种苗基地内所采集;石油醚、正己烷、甲醇、浓硫酸、无水硫酸钠 均为分析纯。
JJ-2型组织破碎机 江苏省金坛市金南仪器厂;KQ5200DE超声波处理器 江苏省昆山市超声仪器有限公司;N-1100S-W旋转蒸发仪 日本EYELA公司;Agilent 7890GC-5975MS气相色谱-质谱联用仪 美国Agilent公司。
1.2 粗脂的提取
桉叶经风干后,70℃烘干1h,过0.5mm筛粉碎备用。提取方法参照文献[11]实施:取干燥桉叶粉(80~150 目)10g,加入石油醚(沸点60~90℃)80mL,浸泡10~12h,进行超声波萃取(频率为40kHz、温度为30℃),萃取3次,每次20min,溶液过滤后,加入20mL石油醚(沸点60~90℃)冲洗滤渣,再次过滤,滤液合并后经旋转蒸发仪减压蒸馏,回收石油醚,得到桉叶粗脂,保存备用。
1.3 脂肪酸甲酯化处理
采用1%硫酸-甲醇酯化法[12]:取粗脂0.5g于具塞三角瓶中,加入1%硫酸-甲醇溶液20mL,充分振荡,50~60℃水浴1h,静置后加入20mL正己烷,振荡均匀,静置15min,取上层萃取液离心,将离心后的上清液作为分析试样。
1.4 GC-MS条件
1.4.1 色谱条件优化实验 HP-5MS 30m×0.25mm×0.25μm石英弹性毛细管柱,载气为高纯氦气,进样口温度 260℃,流速 1mL/min,进样量 1.0μL,分流比20∶1。在程序升温常规参数[11]基础上,分别就色谱条件程序升温中的8个因素进行了最优响应面设计(D-optimal Algorithm)[13],得 55 个处理组合。实验因素编码与水平见表1,处理组合见表2。
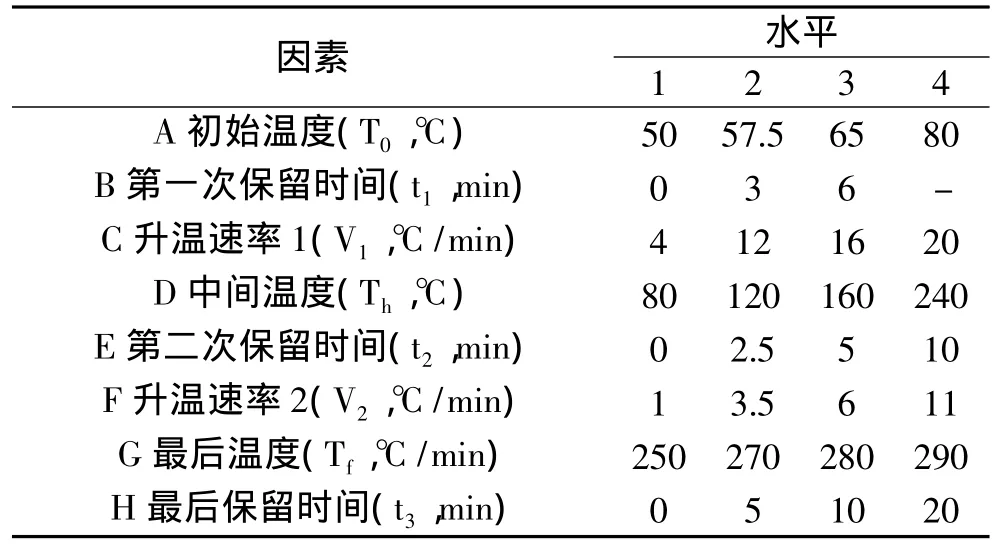
表1 实验因素编码与水平Table 1 Factors with different levels in the D-optimal RSM experiment
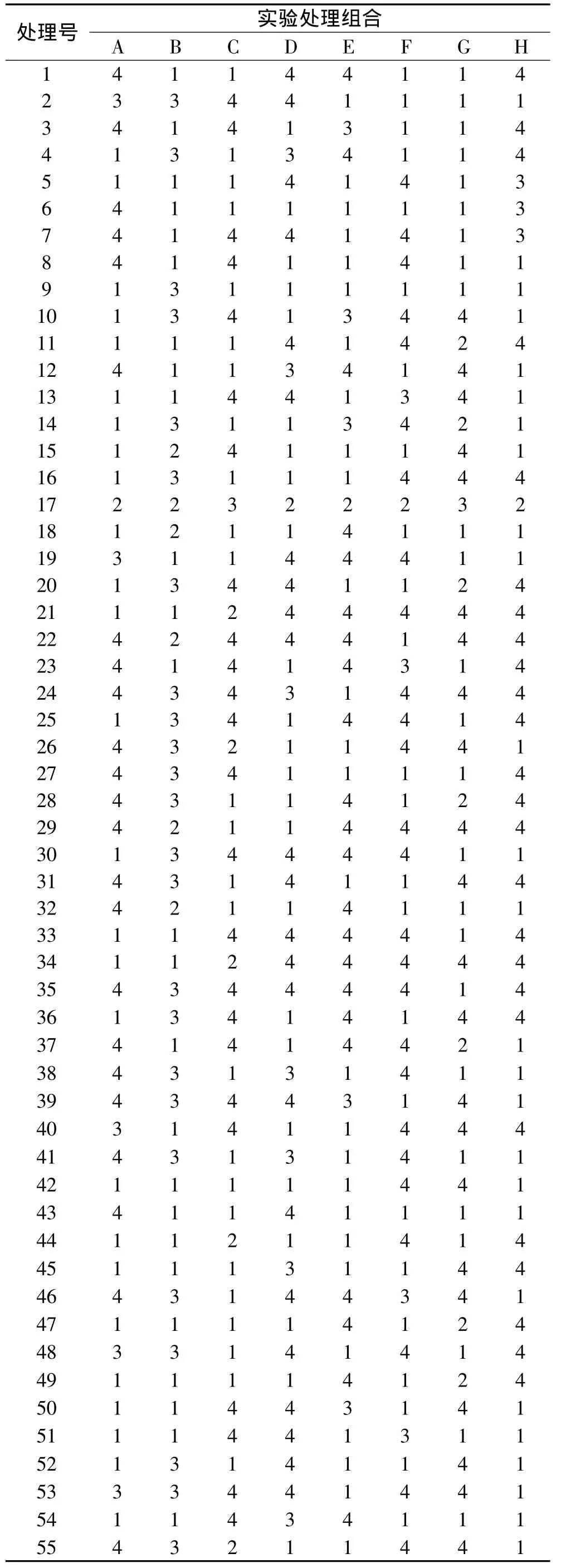
表2 实验处理组合Table 2 Factors combination of experimental treatments in the D-optimal RSM experiment
1.4.2 质谱条件 EI电离源,电子能量70eV,离子源温度230℃,四极杆温度150℃,EM电压1024V,质量扫描范围40~600u。
1.4.3 定性与定量分析 根据GC-MS数据处理系统利用NIST08谱图库进行自动检索,并结合人工图谱解析,对提取物成分进行定性分析。采用色谱峰面积归一化法确定各成分的相对百分含量。
1.5 统计指标和建模分析
以脂肪酸成分的相对含量(Y1)、脂肪酸种类数(Y2)、Simpson指数(Y3,可检测出的成分种类的多样性指数)、离子谱图质量(Y4)(根据的色谱图峰的分离度、分布等分成3级,1级别表示色谱图谱差,峰分离不清晰、不均匀,拖尾、甚至出现基线漂移,2级别表示谱图分离效果一般,3级别表示谱图质量好,以0表示不能实施的处理组合)为评价指标进行分析统计,采用Design-Expert 7.0软件进行建模分析。
2 结果与分析
2.1 桉叶脂肪酸相对含量
分别对尾巨桉 DH32-29无性系桉叶粗脂进行GC-MS处理分析(图1),对分离出来的脂肪酸相对含量进行统计,除不能实施的处理号19、28、29、31、37、46、48、52 外,平均相对含量达到 72.3%以上,最小值为57.0%(处理号21),处理号33达到最大值86.9%。
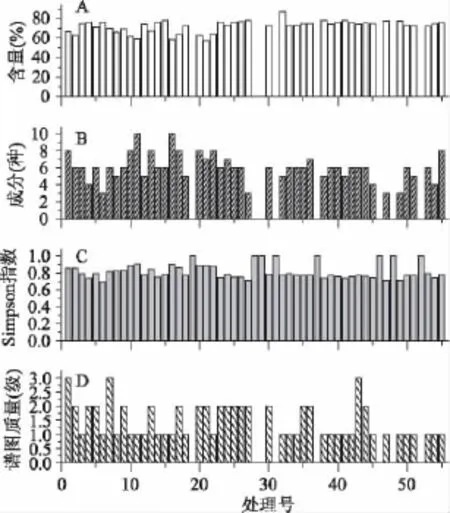
图1 不同GC-MS条件下检测出的脂肪酸情况Fig.1 The content,kind,Simpson index and TIC of fatty acids under the different GC-MS conditions
分别对甲酯化的尾巨桉叶片粗脂进行不同的程序升温条件下分析检测,以Design-Expert进行正交实验建模分析,得到有效Y1回归模型方程(R2=0.863,p=6.4×10-3)如下:


注:式(1)中,Y1为脂肪酸成分的相对含量,A-H因子前的各数字为标准化的回归系数,其中因素后的*、**分别表示在0.05、0.01水平上差异。
从式(1)可知,对于脂肪酸成分的相对含量(Y1)来说,因子主效应中,因子C(升温速率1)中回归系数绝对值最大为11.69,其次为因子F的回归系数(7.89),因子G的回归系数绝对值为6.80,因子E的回归系数绝对值为6.39,这4个因子影响均达到显著水平以上,而因子B回归系数绝对值最小为4.31,因此影响桉叶提取物分离检测的的因素从大到小依次为:C>F>G>E>A>H>B>D,也就是说,升温速率1(V1)对桉叶提取物中脂肪酸粗脂检测影响最大,其次是升温速率2(V2)、最后温度Tf、第二次保留时间(t2)、初始温度(T0)、最后保留时间、第一次保留时间、中间温度。在因子主效应中,除因子C起到正向效应外,其他的均为反向效应,即随着因子增大Y1相应减少。除此之外,因子 BC、BF、BH、CH、EF之间均存在着明显的交互作用。
2.2 脂肪酸成分分析
对尾巨桉DH32-29无性系桉叶粗脂进行GC-MS处理分析(图1B),除没有实施的处理号,共分离出脂肪酸(十四酸、棕榈酸、亚油酸、亚麻酸、硬脂酸、花生酸、二十二酸、二十四酸、二十六酸、二十八酸)甲脂产物10个峰,平均获得检测出5种脂肪酸,其中处理号11和17可鉴定10种脂肪酸。因此不同的处理组合之间差异较大,对脂肪酸成分含量来说是显著性的。对脂肪酸种类数与各影响因子进行建模分析,得到有效Y2回归模型方程(R2=0.881,p=2.3×10-3)如下:

从(2)式可知,对于脂肪酸成分种类数(Y2),因子C(升温速率1)是最主要的影响因子,其次为因子E(第二次保留时间t2),影响均达到极显著水平。因子 BC、BD、BH、CF、DH、EF 均存在着明显的因子交互影响。
2.3 脂肪酸成分的Simpson指数
Simpson指数为描述分类变量总体多样性大小的指数,多用于群体多样性计算,其公式为:D=1-ΣPi2(式中Pi种的个体数占群体中总个体数的比例),反映了一个群体的优异性,当总体的分类数增多时,相应的多样度增大,本实验以此分析脂肪酸成分的差异。分别以脂肪酸不同种类以及相对含量,计算脂肪酸成分的Simpson指数(Y3),结果如图1C。
大部分处理号的Simpson指数分别在0.4左右(平均值为0.3790±0.039),不能实施的处理号(19、28、29、31、37、46、48、52)的 Simpson 指数为最大值1,而处理号32最小(0.02)。

从式(3)可知,对脂肪酸成分Simpson指数(Y3)影响比较大的主效应因子为F、G、C,在交互作用中影响的因子分别为AE、BF、CH。
2.4 谱图质量(Y4)
根据不同处理的脂肪酸离子流色谱图进行峰的分离度、分布的评估,结果如图1D。离子谱图质量(Y4)除了处理号 19、28、29、31、37、46、48、52 为 0外,大部分处理号平均Y4为2级,只有处理号1、7、43达到3级。对Y4影响因子进行逐步回归分析(stepwise regression),得到有效Y4平方根的回归模型方程(R2=0.710,p<1.0×10-4)。

从式(4)可知,因子C、G、E是影响Y4的重要的因子,其中升温速率(C)的影响最大。
2.5 桉叶脂肪酸最优GC-MS条件确定
先由桉叶脂肪酸含量、成分种类数、脂肪酸成分的Simpson指数以及GC-MS离子流色谱图质量4个指标按照等比权重和脂肪酸成分种类数越大、Simpson指数越小,谱图质量等级越高的要求构建桉叶脂肪酸GC-MS综合指标,在上述分析以及拟合模型的基础上进行RSM优化分析,最后获得最优因子组合期望值较高的为10个(表3)。从优化的结果来看,在优化方案1中GC-MS条件下,理论上可以获得脂肪酸成分的相对含量86.9%、可检测脂肪酸成分为8种(Y2)、Simpson指数为0.16,离子流谱图质量为2.4等级。分别以两种方法(优化前的常规参数和获得最优化参数)对16个不同提取方法获得尾赤桉WC3桉叶提取物进行验证分析比较(表3),结果表明在优化获得的参数下,桉叶脂肪酸含量、成分种类数、脂肪酸成分的Simpson指数上均显著优于优化前常规参数条件,能获得满意的结果(如图2)。
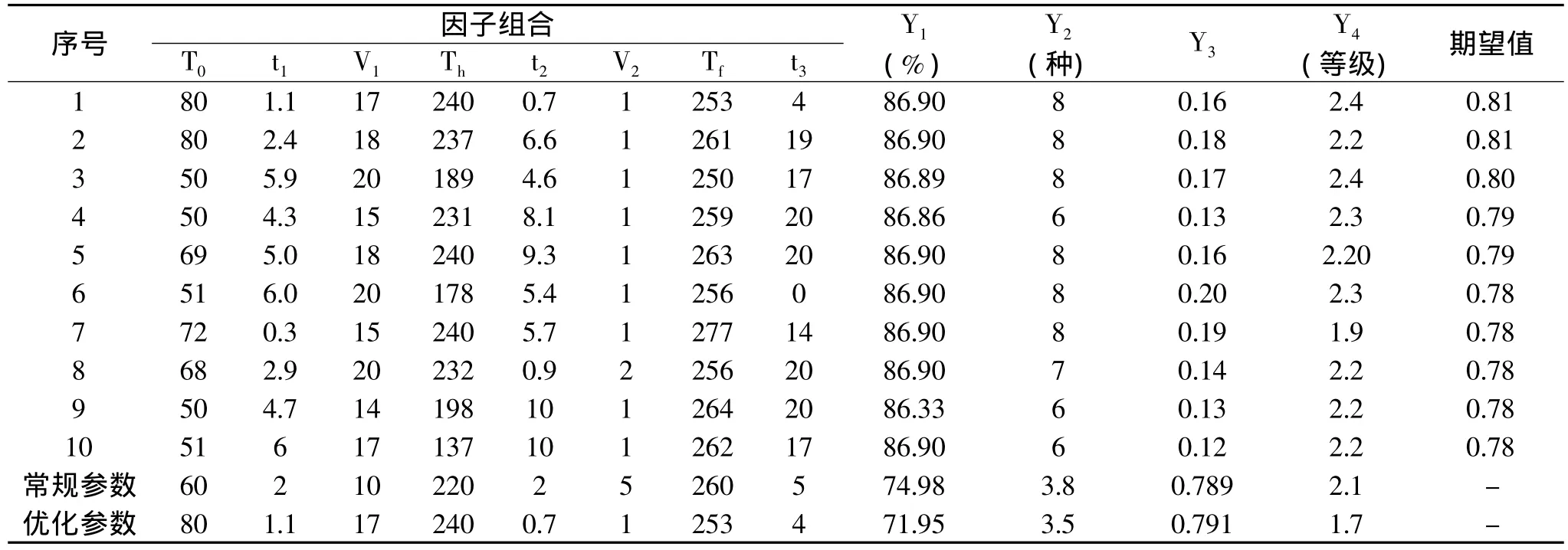
表3 桉叶脂肪酸分析GC-MS优选组合以及验证比较Table 3 The optimum GC-MS conditions for fatty acids analysis of Eucalyptus leaf and the tested resluts

图2 在优化GC-MS条件下尾赤桉WC3桉叶提取物离子图Fig.2 TIC of the fatty acid in E.urophylla×E.camaldulensis WC3cloneleaves
3 结论
3.1 以超声波法对尾巨桉叶脂肪酸成分时,检测所得的桉叶脂肪酸相对含量比较高(到达72.3%),脂肪酸成分种类平均可检测出5种脂肪酸,最大可以可获得10种脂肪酸成分,这与以前报道的一致[11],即桉叶中脂肪酸含量丰富。
3.2 GC-MS色谱条件对脂肪酸分析检测影响显著。程序升温中的升温速率对脂肪酸成分分离起到关键性的作用,不但影响分离快慢,也直接影响分离好坏。从本研究结果表明,对尾巨桉叶片脂肪酸成分检测影响最大的因素是升温速率V1。
3.3 通过D-optimal响应面法对色谱条件重要因子进行实验,共设计处理组合55个,尽管其中有8个不能实施的处理组合,但因实验设计中考虑到这点(其中5个为防缺失处理组合,5个为重复处理组合),因此所获得的回归模型均有效。最优GC-MS色谱条件为:初始温度(80℃)、第一次保留时间(1.1min)、升温速率1(17℃/min)、中间温度(240℃)、第二次保留时间(0.7min)、升温速率2(1℃/min)、最后温度(253℃)、最后保留时间(4min)。实验验证表明所获结果可行。
[1]祁述雄.中国桉树[M].北京:中国林业出版社,2002.
[2]国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2005.
[3]梁振益,杨雪蕊,李海峰,等.桉树叶中黄酮类化合物的提取工艺研究[J].海南大学学报:自然科学版,2007(3):256-258.
[4]马自超,劳伦斯·波特.桉树叶单宁组分的研究[J].植物学报:英文版,1988,30(5):534-538.
[5]Hou A J,LYZ,Yang H,et al.Hydrolyzable Tannins and related polyohenols from eucalyptus globulus[J].Journal of Asian Natural Products Research,2000(3):205-212.
[6]孙汉洲,赵芳,李志辉.用细胞膜脂脂肪酸成分分析法筛选抗寒巨桉种源[J].中南林学院学报,2000,20(3):59-62.
[7]李志辉,汤珧华,孙汉洲,等.耐寒性桉树早期选择Ⅲ巨桉种源和家系膜脂肪酸组成、含量与抗寒性关系[J].中南林学院学报,2000,20(3):80-85.
[8]Guimaraes R BL,Carvalho A M,et al.Aromatic plants as a source of important phytochemicals:vitamins,sugars and fatty acids in cistus ladanifer,cupressus lusitanica and eucalyptus gunnii leaves[J].Industrial Crops and Products,2009,30(3):427-430.
[9]惠尉,陈国广,唐俊,等.响应面分析法优化盐酸丁螺环酮微球制备工艺研究[J].时珍国医国药,2008,19(9):2268-2271.
[10]R V Muralidhar RRC,R Marchant P Nigam.A response surface approach for the comparison of lipase production by Candida Cylindracea using two different carbon sources[J].Biochemical Engineering Journal,2001,9(1):17-23.
[11]张婧,谢耀坚,杜阿朋,等.尾叶桉叶片脂肪酸成分的GC-MS分析[J].桉树科技,2011,28(1):9-13.
[12]寇秀颖,于国萍.脂肪和脂肪酸甲酯化方法的研究[J].食品研究与开发,2005,4(2):46-47.
[13]Piepel GF.Programs for generating extreme vertices and centroids of linearly constrained experimental regions[J].Journal of Quality Technology,1988,20(2):125-139.
