巴豆中佛波醇酯类成分及其生物活性研究进展
2012-09-06高文远张静泽
王 磊, 刘 振, 高文远, 张静泽
(1.天津大学药物科学与技术学院,天津 300072;2.天津中新药业集团股份有限公司乐仁堂制药厂,天津 300380)
巴豆Croton tigliumL.为大戟科Euphorbiaceae巴豆属植物,又名巴菽、刚子、江子、老阳子、双眼龙、猛子仁等。巴豆种子供药用,种子的油即巴豆油,有大毒,作峻泻剂;其根、叶也可入药,治疗风湿骨痛等;民间亦用其枝、叶作杀虫药或毒鱼[1]。
对于巴豆的化学成分研究,国内外学者更多的侧重于巴豆种子的研究,巴豆油是巴豆种子中的主要成分和药效活性成分,亦为毒性成分,刺激皮肤,其主要的化学成分是佛波醇二萜酯类化合物[2-4],是一个具有四环巴豆烷母核的二萜酯类化合物。
1 佛波醇酯分离方法
佛波醇酯类化合物不稳定,对热、光、氧气、酸和碱较敏感,在分离过程中容易发生氧化、酯化和差向异构化[5],因此,需要在无氧环境下分离,萃取时采用氮气或者氩气保护,常用的分离方法是将巴豆用甲醇提取后,除去溶剂后,残余物溶于甲醇-水 (一般比例为9∶1)混合溶液中,用己烷分配除去长链脂肪酸,然后用乙醚萃取,得到富含二萜类化合物的乙醚提取物。经硅胶和硅酸镁吸附柱层析分为几个部位,再采用液滴逆流色谱和薄层制备的方法进一步分离[6],或者采用液滴逆流色谱和低压柱层析方法联用[7];由于液滴逆流色谱的复杂性以及不广泛性,随后,Ocken[8]采用干柱色谱的方法从巴豆油中分离出佛波醇酯类化合物;随着制备液相的出现,Mekkawy[9]等采用中压色谱柱的方法分离得到佛波醇酯类化合物。
2 佛波醇酯结构
1941年,Berenblum[10]从巴豆油中发现佛波醇酯化合物,1967年Hecker[11]确定该类化合物结构,由于巴豆油中的该类成分极性较小,其分离获得比较困难,早期,Marshall[7]液滴逆流色谱方法对其进行分离,巴豆油经环己烷提取后,用甲醇-水 (20∶3)萃取后采用DCCC(环己烷-二乙醚-异丙醇-乙醇-水作为上相流动相)进行洗脱,然后再采用不同流动相的DCCC方法进行分离,以及采用制备薄层色谱的方法获得不同的佛波醇酯化合物;日本学者Mekkawy[9]采用中压色谱柱的方法对其进行分离,巴豆采用甲醇提取后,采用极性小的环己烷或者乙醚萃取后,经环己烷-乙酸乙酯硅胶柱洗脱后,得到粗的成分,再采用RP-18硅胶柱 (甲醇-乙腈,1∶1)分离后,用中压色谱柱(RP-18,RP-2,Si60)采用不同的洗脱系统 (甲醇-水;环己烷-乙醚-乙酸乙酯)进行分离。现已从巴豆中分离出33种佛波醇酯化合物[12](化合物1~33,见图1,表1),并采用LC-MS-MS,通过三步法确定该化合物的特征碎片离子,根据分子量快速简便鉴定化合物[13]。

图1 佛波醇酯化合物化学结构母核
3 佛波醇酯衍生物
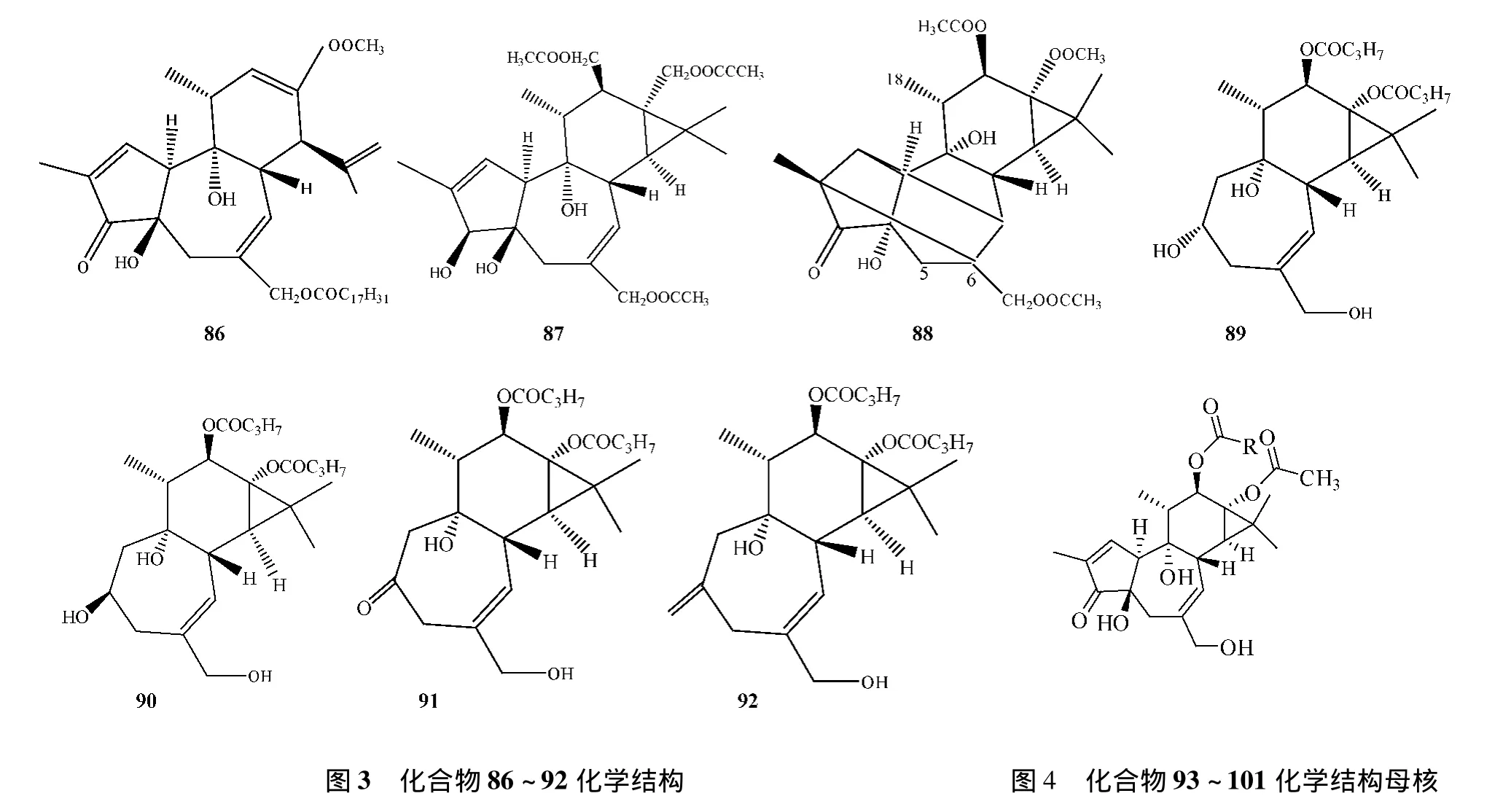
El-Mekkawy[9,14]通过比较巴豆油中的 8 个佛波醇酯化合物抗HIV-1活性,合成了成了44个佛波醇酯衍生物 (化合物34~74,化合物86~88);化合物12抑制HIV-1的活性很强,但是该化合物在血浆中不稳定,为了得到活性强且在血浆中稳定的化合物,以该化合物为基础合成了C-13位不变,C-12位为醚键的5个衍生物[15](化合物75~79)。同时根据化合物24具有抗HIV-1活性而无肿瘤促进作用[16],合成了6个巴豆醇-13-单酯化合物[17](化合物80~85)。上述55种衍生物是改变取代基的酯链长度,并未引入极性大的官能团,极性的变化并不大,Bertolini[18]等又合成了21种C-12,C-13为极性官能团 (如酰胺、羧酸、铵盐)的佛波酯类似物。
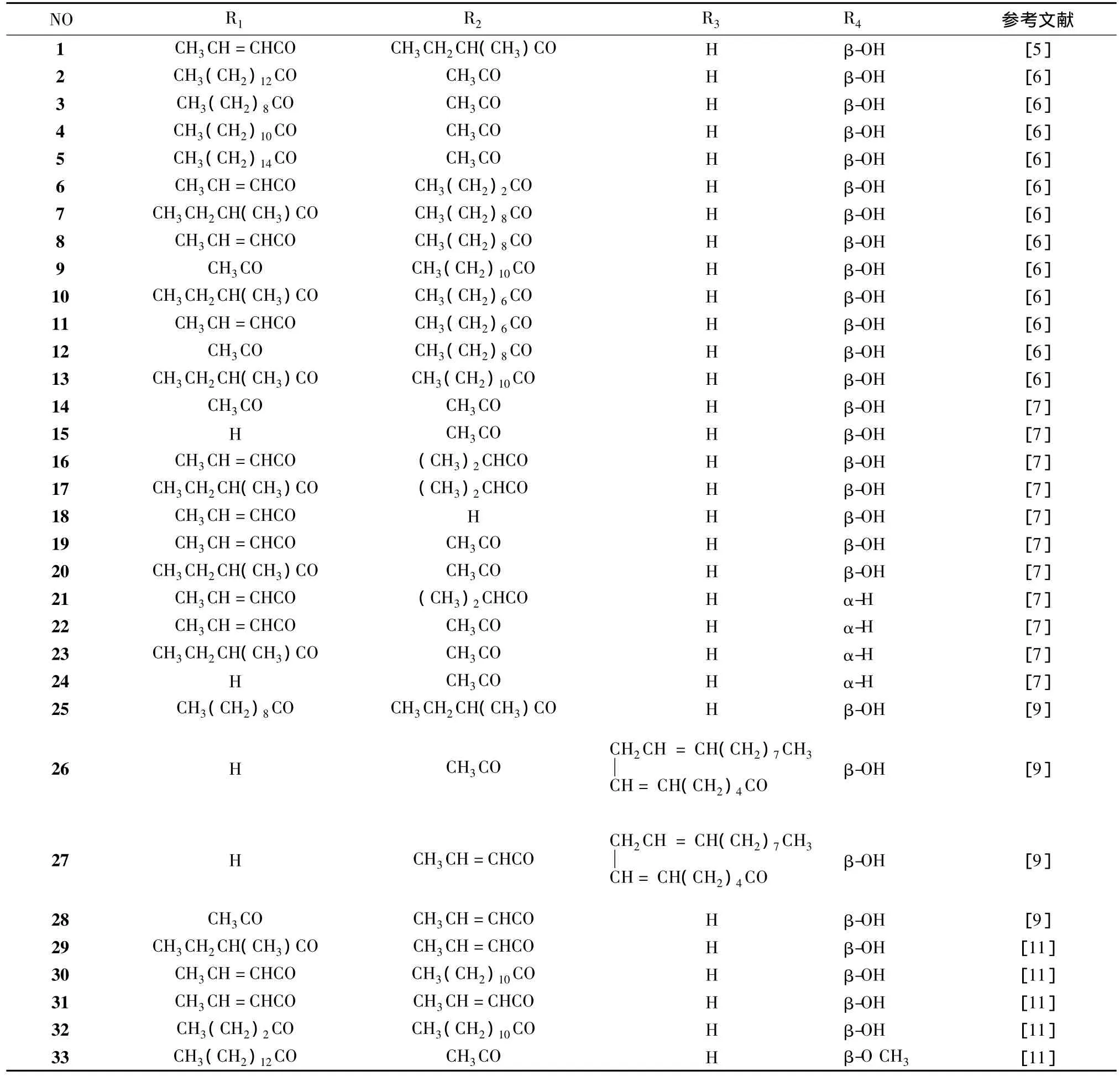
表1 佛波醇酯化合物结构

图2 佛波醇酯衍生物化学结构母核
对佛波醇酯的结构改造,多数是在保持母核不变而只改变侧链的取代基发现活性强的化合物,Wender[19]等则通过改变母核结构合成了4种 (化合物89~92)佛波醇酯衍生物。而Yamatsugu[20]根据佛波醇酯化合物结合蛋白激酶C(PKC)的能力,合成了9种佛波醇酯类衍生物(化合物93~101),从中寻找特异性抑制PKCα受体的化合物。佛波醇酯特殊的五元环结构除了能够激动或抑制蛋白激酶C外,还能和其它受体结合,从而产生不同的生物活性,如4α-佛波醇酯化合物对蛋白激酶C无活性,但是它可以激活瞬时感受器香草素电位离子通道 (TRPV4),据此合成了多种佛波醇酯衍生物[21]。

表2 佛波醇酯衍生物化学结构
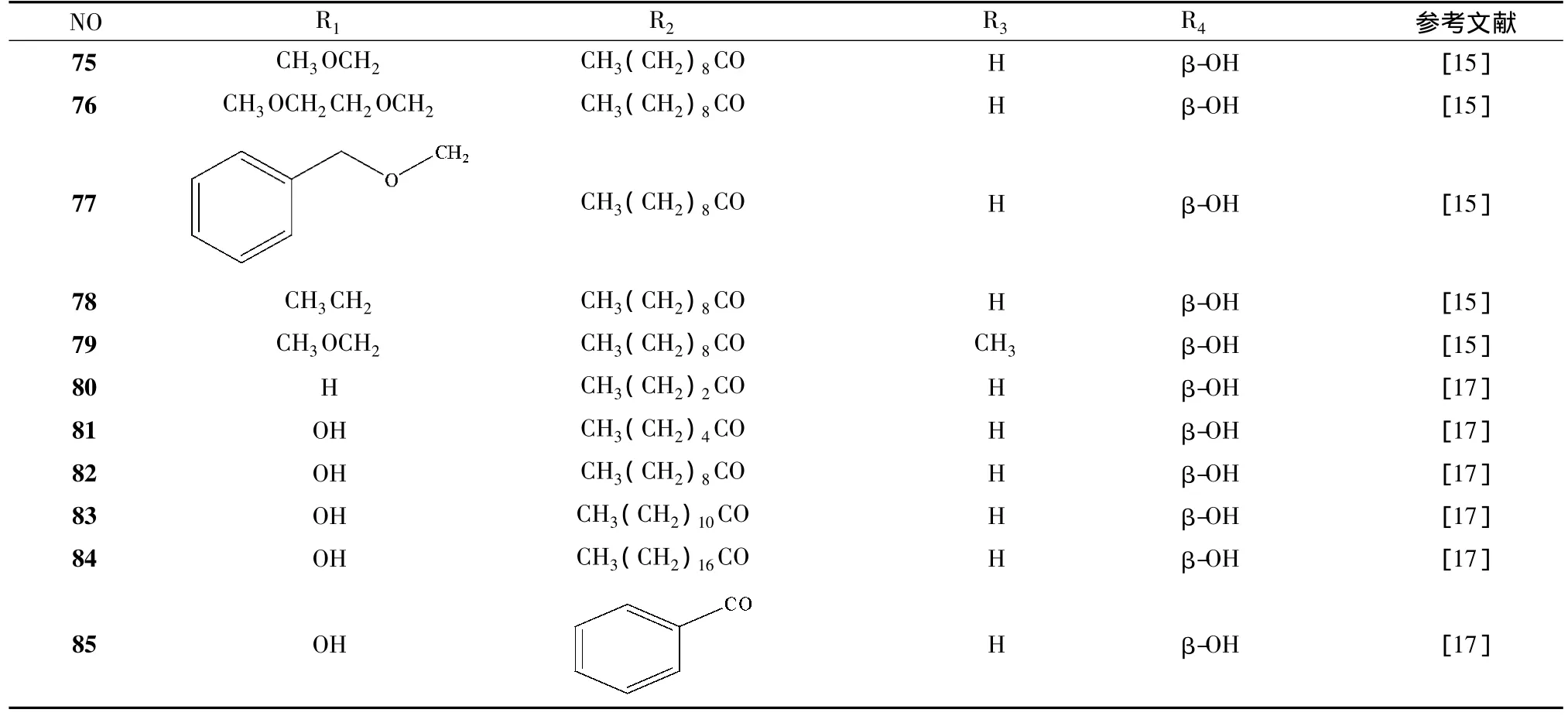
续表2
4 佛波醇酯化合物的生物活性
佛波醇酯类化合物具有多效生物活性,研究最多的是其与蛋白激酶C结合产生的作用,毒性方面如促肿瘤形成、炎症、细胞增殖、血小板聚集等作用,但同时也有抗HIV-1引起的细胞病变、抗红白血细胞等作用。
4.1 调节蛋白激酶C 佛波醇酯化合物与二酰甘油(DAG)相似,为蛋白激酶C激动剂,均调节依赖Ca2+(α,βⅠ,βⅡ,γ)和非依赖Ca2+(δ,ε,η,θ,μ)的蛋白激酶C同工酶[22-23],并且作用机制相似,都结合到蛋白激酶C的C1领域,但佛波醇酯与蛋白激酶C是不可逆结合[24],如化合物2能够激活蛋白激酶C产生毒副反应,如诱发肿瘤、刺激皮肤等,而有些如化合物12却能够抑制肿瘤的生长,说明佛波醇酯的结构影响其作用。采用合成的方法探讨其关系,通过改变母核结构合成不同的佛波醇酯衍生物,化合物91和92与蛋白激酶C的亲和力强,说明C-2的刚性结构起着重要的作用[19];C-3,4,9,20位的羟基自由基与蛋白激酶C的亲和力密切相关;C-12,13位取代基的疏水性/亲水性影响蛋白激酶C的活性[25],其中C-12位酯链是决定化合物是否为蛋白激酶C激动剂/抑制剂的基本因素[26],由此合成了一系列的化合物,当C-12,C-13为极性官能团 (如酰胺、羧酸、铵盐)时,能够使得蛋白激酶C的迁移能力降低,即促癌活性降低,这两位为短的羧酸链就可以使蛋白激酶C的活性降低90%,最有可能成为蛋白激酶C抑制剂的化合物为C-12,13位为羧酸的佛波酯类似物[18]。但是在合成过程中又发现了一种新的作用机制,当C-12位存在缺电子的芳香基团时,能显著提高化合物与蛋白激酶C的亲和力[20],说明这两者的亲和力不仅与母核上的羟基自由基有关,还与C-12位的取代基的电子云有关。蛋白激酶C有多种亚型结构,得到其某一亚型的专一性激动剂或抑制剂是发现新药的关键点,从中寻找特异性抑制PKCα受体的化合物时,发现化合物97、98的活性强,判断出缺电子的芳香环和聚醚侧链均为抑制蛋白激酶 C 的重要基团[20]。
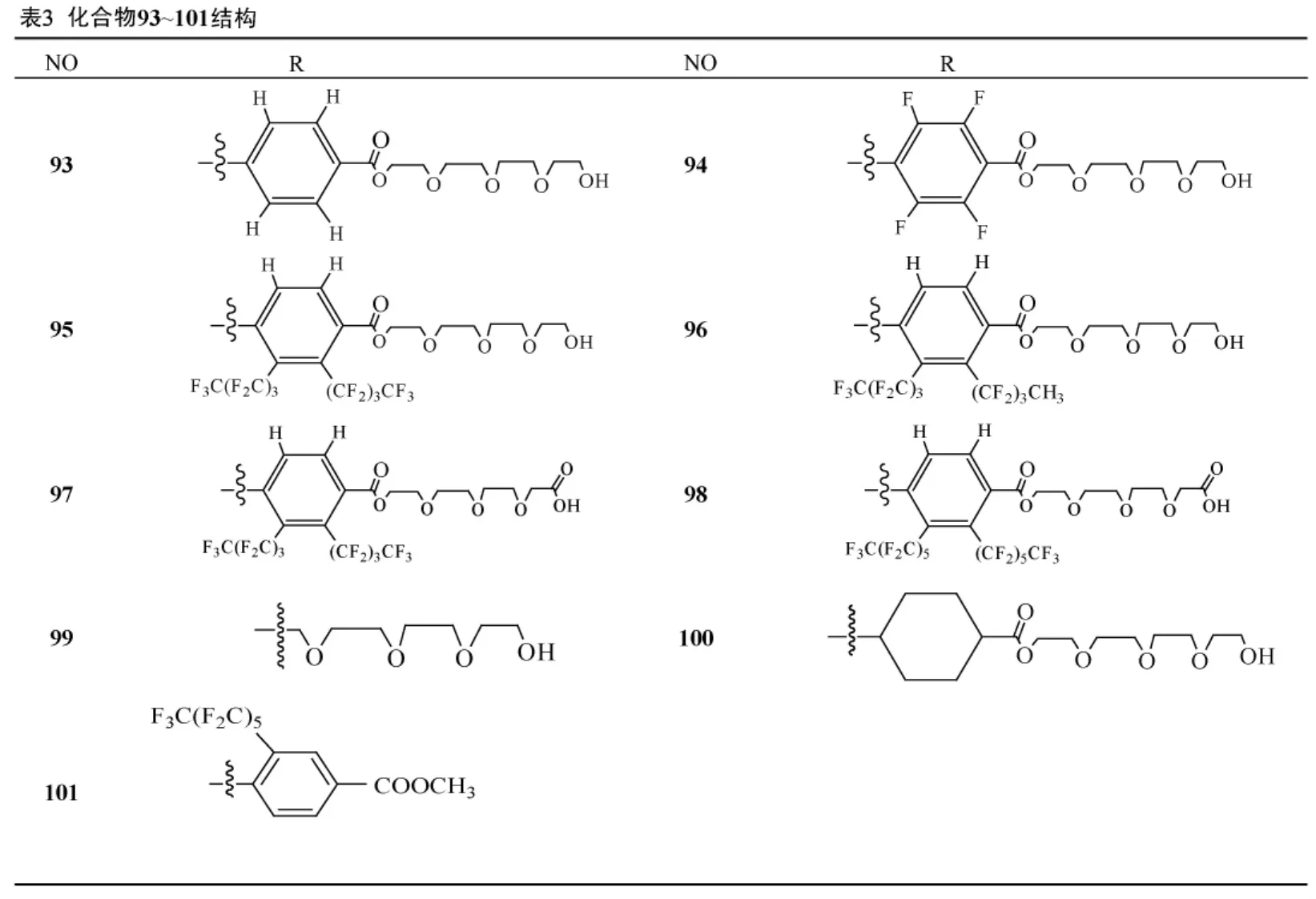

图5 佛波醇酯骨架结构与蛋白激酶C活性的关系
4.2 抗HIV-1作用 从巴豆油中分离出的化合物2、12、25和33能够完全抑制HIV-1诱导的MT-4细胞病变作用(IC100分别为 7.6 ng/mL、7.81 μg/mL 和 0.48 ng/mL)[9];从Homalanthus nutans中分离出的Prostratin(化合物24)具有强的抗 HIV-1活性[16];以及从Euphorbia poissonii和Euphorbia resiniferaBerg中分离出的脱氧佛波醇酯类化合物也具有强的抗HIV-1作用[27],虽然都是佛波醇酯类化合物并且均可以抑制HIV-1引起的细胞病变,但是产生的细胞作用不同,通过合成不同的佛波醇酯衍生物发现化合物的构型明显地影响其活性[14-15,17],如 C-4位为 α-OH或被甲氧基取代则失活;C-20位被乙酸取代后,活性明显下降;C-3位羰基改为羟基后,活性降低;增加或减少脂肪酸碳链的数目都能明显降低活性。如今利用合成的方法得到的抗HIV-1活性强、毒性小的为化合物75和化合物84,并且化合物84的活性强于化合物24 10倍[15,17]。
4.3 毒副作用 巴豆油有一定的毒副作用,主要包括刺激性、致癌性、抑制蛋白质合成和遗传损伤作用。对于巴豆引起的致癌作用报道的也较多,如小鼠口服巴豆油可引起胃部乳头状瘤及癌;大鼠腹腔注射巴豆油,可降低肝癌抑制因子水平;与其他致癌物合用时,致癌率也明显提高。
4.3.1 炎症作用 巴豆油具有强的皮肤刺激作用,外用对皮肤、黏膜有强烈的刺激性,引起发红,口服半滴至1滴即能产生口腔及胃黏膜的烧灼感及呕吐,并产生严重腹泻,甚至消化道出血、肾脏损伤、血尿、血闭等。灌胃给予小鼠两周后,电子显微镜下可见空肠、结肠黏膜上皮细胞肿胀,及炎症反应;巴豆油酸可引起腹痛、腹泻等消化道炎症,甚至引起肠坏疽;巴豆毒素作为一种剧烈的原形毒物,可引起皮肤、黏膜发赤、气泡等炎症。化合物2是最强的刺激剂 (作用机制见图6)[28]。佛波醇酯的结构影响其活性,化合物33不能引起炎症,而能引起细胞增生[29];12-脱氧巴豆醇酯类化合物有炎症作用[30]。研究发现侧链取代基不同时,刺激能力、炎症达峰时间和持续时间亦不同,一般单酯比二酯的刺激能力强,持续时间长,而炎症的持续时间与母体结构中自由羟基的个数相关,但是4位的构型 (α与β)与炎症持续时间无关[31],并且抗组胺药或前列腺素合成酶抑制剂对巴豆油引起的皮肤炎症不起作用,而皮质醇或相关的皮质甾醇类药物能够抑制该作用[32]。

图6 佛波醇酯引起的炎症反应
4.3.2 促肿瘤形成 1941年,Berenblum[10]从巴豆油中发现佛波醇酯类化合物,将其涂抹到小鼠皮肤时发现它能加速肿瘤的形成;1947年,Berenblum和Shubik[33]发现它的促癌活性仅是在用了致癌剂后才具有,本身不具有致癌作用,1979 年,Matsukura[34]等人将巴豆油和N-甲基-N'-硝基-N-亚硝基胍用于小鼠实验中,发现这两者单独应用时,没有产生胃癌,但是同时应用时,在小鼠中出现了胃癌细胞,进一步证实了巴豆油的促癌而非致癌作用。Hecker[6]从巴豆油中分离出了12,13-佛波醇酯类化合物,并确定其为潜在的促癌活性成分,其中化合物2是最强的促癌剂。对其机制进行研究后,该类化合物能够促进肿瘤形成,是由于其能够激活蛋白激酶C[35],从而调节信号通道引起基因转录,导致细胞增生。巴豆毒素通过抑制蛋白质合成、溶解红细胞,使局部组织发生变性、坏死,可导致死亡[12]。
而有些佛波醇酯化合物却能够导致肿瘤细胞的凋零死亡。在一些恶性肿瘤细胞中,佛波醇酯化合物激活蛋白激酶C后,会发现一些细胞会停止生长或者凋零死亡,有多种因素影响这一活性的改变,如蛋白激酶C激活的多种代谢途径、蛋白激酶C的磷酸化作用、蛋白激酶C的细胞定位、蛋白激酶C与其它信号分子的相互作用以及蛋白激酶C与不同底物的结合[36-37],但是化合物12能够抑制细胞的病变且不激活蛋白激酶C[14],说明化合物的结构亦影响其活性。
4.4 其它作用 佛波醇酯还能引起血小板的聚集、细胞增殖以及抗白血病等作用,如化合物2能够引起人红白血细胞中巨核细胞的病变,前列环素能够抑制该作用,前列腺素对其无影响,推断该作用可能通过环单磷酸腺苷[38];化合物8可以对抗P388淋巴细胞癌及抗白血病的活性[34]。
动物实验以及人体试验发现,佛波醇酯化合物对不同组织和动物种类有不同的作用,呈现双向调节,如既能激动蛋白激酶C亦能抑制蛋白激酶C,同样对平滑肌作用时也会出现收缩和松弛双向作用,如化合物14和化合物17对人支气管的作用是先松弛后收缩,最初的松弛作用是激活了Na+/K+-ATPase,而随后的收缩作用则依赖于细胞外Ca2+进入[39]。研究富含该类化合物的巴豆油时,也发现这种双向调节作用[40],如采用兔离体空肠平滑肌模型,研究巴豆油对其的收缩作用,表明该作用与浓度有关,浓度低时收缩;浓度高时则无收缩作用,作用机制是通过M3毒蕈碱受体和 L-型 Ca2+通道[41]介导。
5 结语
虽然巴豆有毒副作用,但是已有两千年的药用历史特别适用于胃肠道疾病,如肠梗阻、腹泻、肠炎、菌痢等,能够治疗顽固性便秘,临床应用广泛,巴豆油富含的佛波醇酯化合物,既是毒性分成也为活性成分,现代药理研究表明,该类化合物具有多种生物活性,但是对巴豆本身的泻下作用机制研究较少,研究最多的是其与蛋白激酶的关系。虽然从巴豆发现的该化合物数目有限,但是以其特殊的四元环母核合成一系列衍生物是发现活性好、毒性小化合物的主要方法,也表明研究该化合物具有较好的应用开发潜力。
[1]中国科学院中国植物志编辑委员会.中国植物志[M].北京,1996,44(2):133-134.
[2]Bertenrath J G M.150 years of croton oil research[J].Experientia,1969,25(1):1-5.
[3]王 媛,邹忠梅.巴豆属植物中二萜类成分研究概况[J].国际中医中药杂志,2006,28(1):17-27.
[4]Salatino A,Salatino M L F.Negri G.Traditional uses,chemistry and pharmacology ofCrotonspecies(Euphorbiaceae)[J].J Braz Chem Soc,2007,18(1):11-33.
[5]Haas W,Sterk H,Mittelbach M.Novel 12-deoxy-16-hydroxyphorbol diesters isolated from the seed oil ofJatropha curcas[J].J Nat Prod,2002,65(10):1434-1440.
[6]Hecker E.Phorbol esters from croton oil.Chemical nature and biological activities[J].Naturwissenschaften,1967,54(11):282-284.
[7]Marshall G T,Kinghorn A D.Short-chain phorbol ester constituents of croton oil[J].J Am Oil Chem Soc,1984,61(7):1220-1225.
[8]Ocken P R.Dry-column chromatographic isolation of fatty acid esters of phorbol from croton oil[J].J Lipid Res,1969,10(4):460-462.
[9]El-Mekkawy S,Meselhy M R,Nakamura N,et al.Anti-HIV-1 phorbol esters from the seeds ofCroton tiglium[J].Phytochemistry,2000,53(4):457-464.
[10]Berenblum T.The co-carcinogenic action of croton resin [J].Cancer Res,1941,1:44-48.
[11]Hecker E,Bartsch H,Bresch H,et al.Structure and stereochemistry of the tetracyclic diterpene phorbol fromCroton tigliumL.[J].Tetrahedron Lett,1967,33(8):3165-3170.
[12]胡 静.巴豆霜推进肠运动物质基础和胃肠安丸抗内毒素作用研究[D].天津:天津大学,2009.
[13]Vogg G,Achatz S,Kettrup A,et al.Fast,sensitive and selective liquid chromatographic-tandem mass spectrometric determination of tumor-promoting diterpene esters[J].J Chromatogr A,1999,855(2):563-573.
[14]El-Mekkawy S,Meselhy M R,Abdel-Hafez A A,et al.Inhibition of cytopathic effect of human immunodeficiency virus type-1 by various phorbol derivatives[J].Chem Pharm Bull(Tokyo),2002,50(4):523-529.
[15]Matsuya Y,Yu Z,Yamamoto N,et al.Synthesis of new phorbol derivatives having ethereal side chain and evaluation of their anti-HIV activity [J].Bioorg Med Chem,2005,13(14):4383-4388.
[16]Gustafson K R,Cardellina J H,Mcmahon J B,et al.A nonpromoting phorbol from the samoan medicinal plantHomalanthus nutansinhibits cell killing by HIV-1[J].J Med Chem,1992,35(11):1978-1986.
[17]Marquez N,Calzado M A,Sanchez-Duffhues G,et al.Differential effects of phorbol-13-monoesters on human immunodeficiency virus reactivation [J].Biochem Pharmacol,2008,75(6):1370-1380.
[18]Bertolini T M,Giorgione J,Harvey D F,et al.Protein kinase C translocation by modified phorbol esters with functionalized lipophilic regions[J].J Org Chem,2003,68(13):5028-5036.
[19]Wender P A,Kirschberg T A,Williams P D,et al.A new class of simplified phorbol ester analogues:synthesis and binding to PKC and ηPKC-C1B(ηPKC-CRD2)[J].Org Lett,1999,1(7):1009-1012.
[20]Yamatsugu K,Motoki R,Kanai M,et al.Identification of potent,selective Protein Kinase C inhibitors based on a phorbol skeleton[J].Chem Asian J,2006,1(3):314-321.
[21]Klausen T K,Pagani A,Minassi A,et al.Modulation of the transient receptor potential vanilloid channel TRPV4 by 4α-phorbol esters:A structure activity study[J].J Med Chem,2009,52(9):2933-2939.
[22]Nishizuka Y.Protein kinase C and lipid signaling for sustained cellular responses[J].FASEB J,1995,9(7):484-496.
[23]Ron D,Kazanietz M G.New insights into the regulation of protein kinase C and novel phorbol ester receptors[J].FASEB J,1999,13(13):1658-1676.
[24]Mosior M,Newton A C.Mechanism of interaction of protein kinase C with phorbol esters.Reversibility and nature of membrane association[J].J Biol Chem,1995,270(43):25526-25533.
[25]Zhang G Y,Kazanietz M G,Blumberg P M,et al.Crystal structure of the Cys2 activator-binding domain of protein kinase Cδ in complex with phorbol ester[J].Cell,1995,81(6):917-924.
[26]Wada R,Suto Y,Kanai M,et al.Dramatic switching of protein kinase C agonist/antagonist activity by modifying the 12-ester side chain of phorbol esters[J].J Am Chem Soc,2002,124(36):10658-10659.
[27]Bocklandt S,Blumberg P M,Hamer D H.Activation of latent HIV-1 expression by the potent anti-tumor promoter 12-deoxyphorbol 13-phenylacetate [J].Antivir Res,2003,59(2):89-98.
[28]Goel G,Makkar H P,Francis G,et al.Phorbol esters:structure,biological activity,and toxicity in animals[J].Int J Toxicol,2007,26(4):279-288.
[29]Fürstenberger G,De-Bravo M,Bertsch S,et al.The effect of indomethacin on cell proliferation induced by chemical and mechanical means in mouse epidermisin vivo[J].Res Commun Chem Pathol Pharmacol,1979,24(3):533-541.
[30]Hergenhahn M,Kusumoto S,Hecker E.Diterpene esters from“Euphorbium”and their irritant and cocarcinogenic activity[J].Experientia,1974,30(12):1438-1440.
[31]Schmidt R J,Evans F J.Skin irritant effects of esters of phorbol and related polyols[J].Arch Toxicol,1980,44(4):279-289.
[32]Belman S,Troll W.The inhibition of croton oil-promoted mouse skin tumorigenesis by steroid hormones[J].Cancer Res,1972,32(3):450-454.
[33]Berenblum T,Shubik P.The role of croton oil applications associated with a single painting of a carcinogen in tumor induction of the mouse’s skin[J].Br J Cancer,1947,1(4):379-382.
[34]Matsukura N,Kawachi T,Sano T,et al.Promoting action of croton oil on gastrocarcinogenesis byN-methyl-N'-nitro-N-nitrosoguanidine in rats[J].J Cancer Res Clin Oncol,1979,93(3):323-327.
[35]Wender P A,Koehler K F,Sharkey N A,et al.Analysis of the phorbol ester pharmacophore on protein kinase C as a guide to the rational design of new classes of analogs[J].Proc Natl Acad Sci,1986,83(12):4214-4218.
[36]Brodie C,Blumberg P M.Regulation of cell apoptosis by protein kinase Cδ[J].Apoptosis,2003,8(1):19-27.
[37]Gonzalez-Guerrico A M,Kazanitez M G.Phorbol ester-induced apoptosis in prostate cancer cells via autocrine activation of the extrinsic apoptotic cascade a key role for protein kinase C[J].J Biol Chem,2005,280(47):38982-38991.
[38]Shen H W,Chen Y L,Chern C Y,et al.The effect of prostacyclin agonists on the differentiation of phorbol ester treated human erythroleukemia cells [J].Prostaglandins Other Lipid Mediat,2007,83(3):231-236.
[39]Sarriá B,Pedrós C,Galan G,et al.Effects of phorbol 12,13-diacetate on human isolated bronchus [J].Eur J Pharmacol,2000,399(1):65-73.
[40]Murthy K S,Yee Y S,Grider J R,et al.Phorbol-stimulated Ca2+mobilization and contraction in dispersed intestinal smooth muscle cells[J].J Pharmacol Exp Ther,2000,294(3):991-996.
[41]Hu J,Gao W Y,Gao Y,et al.M3muscarinic receptor-and Ca2+influx-mediated muscle contractions induced by croton oil in isolated rabbit jejunum[J].Ethnopharmacol,2010,129(3):377-380.
