重楼中几个甾体皂苷类成分对鸡胚绒毛尿囊膜血管生成的影响
2012-09-06王鹏龙雷海民
毕 葳, 沈 葹, 王鹏龙, 李 强, 雷海民*
(1.北京中医药大学中药学院,北京 100102;2.中国中医科学院中药研究所,北京 100700;3.北京大学医学部,北京 100083)
鸡胚绒毛尿囊膜 (chick embryo chorioallantoic membrane)形成于胚胎生成早期,此时机体的免疫系统尚未完全建立,对各种异物几乎不发生排斥反应,将含药载体置于其表面,可观察药物对血管生成的影响,该模型对抗血管生成药物敏感,目前仍是较理想的药物筛选模型[1-5]。在前期的实验中,应用鸡胚绒毛尿囊膜模型对云南白药等中成药的抑制新生血管生成活性部位进行了筛选[6-7],发现云南白药的乙酸乙酯部位、乙醇部位具有抑制新生血管生成的活性。重楼又称七叶一支花,为中成药云南白药中的主要药物之一,以蚤休之名首载于《神农本草经》[8-9],2010年版《中国药典》收载的为云南重楼Paris polyphyllaSmith var.yunnanensis(Franch.)Hand.-Mazz.或七叶一枝花Paris polyphyllaSmith var.chinensis(Franch..)Hara的干燥根茎。味苦,性微寒,有小毒,归肝经,具有清热解毒、消肿止痛、凉肝定惊之功效[10]。近年研究发现,重楼的水、甲醇、乙醇提取物、总皂苷及一些皂苷单体对多种癌细胞株都有明显抑制作用[11-12]。另外,钱晓萍等[13]研究指出,重楼醇提物还以血管生成作为靶点,作用于内皮细胞,抑制内皮细胞的增殖、迁移,促使其凋亡及体外小管形成,在体内抑制血管生成,适于抗肿瘤血管生成及相关疾病治疗,该结论与课题组思路不谋而合,但文献未能指出抑制内皮细胞增殖的活性成分。因此,本实验对重楼的主要成分进行了分析测定,并筛选了重楼皂苷Ⅰ等4个甾体皂苷成分的抑制血管生长活性,这不仅对其作用机理是个有利的补充,而且对抗肿瘤药物的开发也具有重要的意义。
1 仪器与试药
UV—Vis 8500型紫外可见分光光度计 (上海天美科学仪器公司);Bruker500型核磁共振仪;KQ—500DE型数控超声波清洗器、旋转蒸发仪(上海亚荣生化仪器厂)。恒温孵化箱 (北京方通孵化器厂),超净工作台 (上海净化设备厂),解剖显微镜 (日本Olympus公司320040型),电子天平 (上海精密科学仪器有限公司JY2002型),数码相机 (佳能A75型),眼科镊,眼科剪,表面皿,打孔器。硅胶 (柱层析及薄层层析用)(青岛海洋化工厂);石油醚、环己烷、乙酸乙酯、95%乙醇、甲醇、丙酮、冰醋酸 (分析纯,购于北京化工厂);蒸馏水 (自制);医用酒精、生理盐水(购于同仁堂药店);明胶海绵 (江苏金陵制药厂)。苏拉明 (由北京市药检所提供);德国罗曼鸡胚蛋,蛋质量50~60 g(由中国农业大学提供)。
2 实验部分
2.1 成分分离 取2 kg重楼药材,依次用10倍量的石油醚、乙酸乙酯、95%乙醇、80%乙醇、60%乙醇、水分3次超声提取,每次30 min,过滤后,上清液减压浓缩后得到各部位。取乙酸乙酯部位60 g用适量乙醇分散后,2倍量的硅胶拌样,30倍量硅胶装柱,上样,依次用石油醚、石油醚-乙酸乙酯、乙酸乙酯、乙酸乙酯-乙醇、乙醇洗脱,TLC法检测,合并相同流份。得到化合物1、2、3、4。
2.2 活性研究
2.2.1 样品制备 精密称取苏拉明5 mg,用30%乙醇溶解,定容至10 mL。精密称取各受试纯品(重楼皂苷Ⅰ、重楼皂苷Ⅱ、重楼皂苷Ⅴ和纤细薯蓣皂苷),用乙醇溶解,配制成质量浓度约为0.4 mg/mL的溶液。将明胶海绵用打孔器制成直径约为6 mm的圆形小块,无菌环境下用微量进样器向小块内加药。阳性药和样品均加5 μL。待明胶海绵将药物完全吸收干燥后,置于紫外灯下消毒风干,备用。
2.2.2 实验方法 选择体质量相近 (50~60 g),表皮无污染、无破损的新鲜种蛋,消毒后,置于温度 (37.8±0.5)℃、相对湿度65% ~70%的恒温孵化箱中孵育,每日早中晚各翻转一次,孵育7 d后,将种蛋随机分为6组,即空白组、苏拉明组、重楼皂苷Ⅰ组、重楼皂苷Ⅱ组、重楼皂苷Ⅴ组和纤细薯蓣皂苷组,每组15枚。在超净台上将蛋胚用酒精消毒后用牙科钻在蛋胚顶端钻一小孔,去掉周围的蛋壳和壳膜,使开口约为1.2 cm×1.2 cm大小;确定加样部位后用注射针头从气室与卵黄分隔处挑破气室膜,注入1~2滴无菌水,使气室膜与鸡胚绒毛尿囊膜分开,用镊子轻轻去除上层的气室膜,暴露下层的鸡胚绒毛尿囊膜。将加药并消毒后的明胶海绵小块置于近胚头1 cm处两条前卵黄静脉之间的相对无血管区。用透明胶纸封闭卵壳口,(37.8±0.5)℃孵育2 d。
2.2.3 观察计数以及统计分析方法 给药后的鸡胚在 (37.8±0.5)℃的恒温孵化箱中孵育2 d后,取出,撕去透明胶纸,用甲醇-丙酮 (1∶1)将加药的鸡胚尿囊膜血管固化10 min,小心剥下鸡胚绒毛尿囊膜,用眼科剪将鸡胚尿囊膜以明胶海绵为圆心剪成直径约为2 cm的圆,置于载玻片上,在显微镜下观察、照相。数据以血管个数均数 (x)表示,以空白组作为标准组,等级资料采用Ridit分析,以P<0.05表示数据差异有统计学意义。
3 结果
3.1 结构鉴定
化合物1:无色透明针晶或白色粉末,易溶于三氯甲烷、甲醇。ESI-MS(m/z):855[M+],722 [M-Arb]-,576 [M-Arb-Rha]-,415[M-Arb-Rha-Glu]-,397[M-Arb-Rha-Glu-H2O]-,379[MArb-Rha-Glu-2H2O]-,283,271,253,251,213,199,173,159,147,139,129,107,93,85,69,55(100%)。1HNMR(DMSO-d6) δ:5.336(1H,br,H-6),0.9(3H,s,H-9,-CH3),0.739(3H,s,H-18)0.915(3H,d,J=6.7 Hz,H-21-CH3),0.74(6H, s, H-18-CH3, H-27-CH3),2.43,2.15(2H,m,H-1),1.8(4H,m,H-2,4),3.48(1H,m,H-3),1.53(1H,m,H-8),4.88(1H,m,H-10),1.5(2H,m,H-11),1.16(2H,m,H-12),1.8(1H,s,H-13),1.93(2H,m,H-15),4.27(1H,m,H-16),3.4(1H,m,H-17),0.96(3H,s,19-CH3),1.82(1H,m,H-20),1.53~1.60(2H,m,H-24),3.42、3.21(2H,m,H-26),4.43(1H,d,J=7.8 Hz,Glu-H-1'),3.35(1H,m,Glu-H-2'),3.23(1H,m,Glu-H-3'),3.26(1H,m,Glu-H-4'),3.47(1H,m,Glu-H-5'),3.60(1H,m,Glu-H-6'),5.037(1H,s,Rha-H-1″),3.64(1H,s,Rha-H-2″),3.41(1H,s,Rha-H-3″),3.19(1H,s,Rha-H-4″),3.99(1H,s,Rha-H-5″),1.089(3H,d,J=6.0Hz,Rha-H-6″),4.88(1H,s,Ara-H-1‴),3.68(1H,s,Ara-H-3‴),3.86(1H,s,Ara-H-4‴),3.67(1H,s,Ara-H-5‴)。13CNMR(DMSO-d6)δ:38.1(C-1),29.5(C-2),76.5(C-3),37.3(C-4),140.7(C-5),121.7(C-6),32.0(C-7),30.3(C-8),50.0(C-9),36.9(C-10),20.8(C-11),39.9(C-12),40.5(C-13),56.2(C-14),32.0(C-15),80.7(C-16),62.2(C-17),16.5(C-18),19.4(C-19),41.6(C-20),15.1(C-21),108.9(C-22),31.4(C-23),28.9(C-24),31.4(C-25),66.4(C-26),17.6(C-27),98.4(Glc C-1),76.9(Glc C-2),76.3(Glc C-3),75.3(Glc C-4),76.1(Glc C-5),61.8(Glc C-6),100.5(Rha C-1),70.9(Rha C-2),71(Rha C-3),72.3(Rha C-4),68.4(Rha C-5),18.2(Rha C-6),108.2(Ara C-1),81.8(Ara C-2),76.8(Ara C-3),84.9(Ara C-4),60.4(Ara C-5)。结合文献 [14-15]鉴定为重楼皂苷Ⅰ。
化合物2:白色粉末,易溶于三氯甲烷、甲醇、乙醇等溶剂。ESI-MS(m/z):721(M-H+),575 [M-146-H]-,344,302。1HNMR(DMSO-d6)δ:0.964(3H,s,H-19),0.910(3H,d,J=6.9 Hz,H-21),0.740(3H,s,H-18),0.740(3H,d,J=7.0 Hz,H-27),5.81(1H,s,H-6),8.08(1H,s, -OH),10.6(1H,s, -OH),4.35(1H,m,glu-H-1'),3.18(1H,m,glu-H-3'),4.00(1H,m,glu-H-5'),5.340(1H,m,glu-H-6'),5.126(1H,d,J=5.7 Hz,Rha-H-1″),1.085(3H,d,J=6.0 Hz,Rha-H-6″)。13CNMR(DMSO-d6)δ:38.1(C-1),29.5(C-2),76.7(C-3),37.3(C-4),140.8(C-5),121.7(C-6),32.0(C-7),30.3(C-8),50.0(C-9),36.9(C-10),20.8(C-11),39.9(C-12),40.5(C-13),56.2(C-14),31.9(C-15),80.7(C-16),62.2(C-17),16.5(C-18),19.4(C-19),41.6(C-20),15.2(C-21),108.9(C-22),31.4(C-23),28.9(C-24),31.4(C-25),66.4(C-26),17.6(C-27),98.6(Glc C-1),76.7(Glc C-2),77.0(Glc C-3),70.7(Glc C-4),78.2(Glc C-5),61.8(Glc C-6),100.5(Rha C-1),70.9(Rha C-2),71(Rha C-3),72.3(Rha C-4),68.4(Rha C-5),18.2(Rha C-6)。结合文献 [14-15]最终鉴定该化合物结构为薯蓣皂苷元-3-O-[α-L-吡喃鼠李糖基 (l→2)]-3-O-β-D-吡喃葡萄糖苷,即重楼皂苷Ⅴ。
化合物3:白色粉末 (甲醇),可溶于乙醇,难溶于石油醚、乙酸乙酯等溶剂。ESI-MS负离子(m/z):883 [M-H]-,737 [M-H-146]-,721[M-H-162]-,575 [M-H-146-162]-,413 [M-H-146-162-162]-。1HNMR (DMSO-d6) δ:0.74(6H,s,18-CH3,27-CH3),0.91(3H,d,J=6.7 Hz,21-CH3),0.96(3H,s,19-CH3),1.09(3H,d,J=6.0 Hz,Rha-CH3),δ5.34(1H,br,H-6)。13CNMR(DMSO-d6)δ:38.1(C-1),29.5(C-2),76.4(C-3),37.8(C-4),140.7(C-5),121.8(C-6),31.9(C-7),30.3(C-8),50.0(C-9),37.3(C-10),20.8(C-11),39.9(C-12),40.5(C-13),56.2(C-14),31.9(C-15),80.6(C-16),62.2(C-17),16.5(C-18),19.4(C-19),41.6(C-20),15.1(C-21),108.9(C-22),31.4(C-23),28.9(C-24),31.4(C-25),66.4(C-26),17.6(C-27),98.3(Glc C-1),77.4(Glc C-2),88.9(Glc C-3),68.9(Glc C-4),76.3(Glc C-5),61.4(Glc C-6),101.0(Rha C-1),70.8(Rha C-2),70.9(Rha C-3),72.4(Rha C-4),68.6(Rha C-5),18.3(Rha C-6),103.7(Glc C-1'),73.8(Glc C-2'),77.2(Glc C-3'),70.4(Glc C-4'),75.5(Glc C-5'),61.2(Glc C-6')。结合文献[14-15]最终鉴定该化合物结构为纤细薯蓣皂苷。
化合物4:白色粉末 (甲醇),可溶于乙醇,难溶于石油醚、乙酸乙酯等溶剂。ESI-MS负离子m/z:1013[M-H]-,867[M-H-146]-,721 [MH-146-146]-,575 [M-H-146-146-146]-,413[M-H-3 ×146-162]-。1HNMR(DMSO-d6)δ:0.74(6H,s,18-CH3,27-CH3),0.91(3H,d,J=6.7 Hz,21-CH3),0.96(3H,s,19-CH3),1.09(3H,d,J=6.0 Hz,Rha-CH3),1.12(6H,d,J=5.9 Hz,2Rha-CH3),5.33(1H,br,H-6)。13CNMR(DMSO-d6)δ:38.1(C-1),29.5(C-2),76.5(C-3),37.3(C-4),140.8(C-5),121.7(C-6),31.9(C-7),30.3(C-8),50.1(C-9),36.9(C-10),20.8(C-11),39.9(C-12),40.5(C-13),56.2(C-14),31.9(C-15),80.7(C-16),62.2(C-17),16.5(C-18),19.4(C-19),41.6(C-20),15.1(C-21),108.9(C-22),31.4(C-23),28.5(C-24),31.4(C-25),66.4(C-26),17.5(C-27),98.7(Glc C-1),77.5(Glc C-2),77.5(Glc C-3),76.7(Glc C-4),75.8(Glc C-5),61.2(Glc C-6),100.8(Rha C-1),70.9(Rha C-2),71.1(Rha C-3),72.4(Rha C-4),68.4(Rha C-5),18.3(Rha C-6),100.5(Rha C-1'),71.8(Rha C-2'),71.2(Rha C-3'),78.4(Rha C-4'),67.3(Rha C-5'),18.6(Rha C-6'),101.5(Rha C-1″),70.9(Rha C-2″),71.1(Rha C-3″),72.4(Rha C-4″),69.4(Rha C-5″),18.3(Rha C-6″)。结合文献 [14-15]最终鉴定该化合物结构为重楼皂苷Ⅱ。
3.2 活性结果
3.2.1 形态学观察 从形态学上可以看出,空白组血管生长正常,主次血脉分明,血管丰富,新生血管多,血色鲜明,载体周围血管走形正常,均围绕药膜向四周辐射出去,血管分布清晰;阳性组与空白组相比,血管明显减少,颜色灰暗,各给药组尤其是重楼皂苷Ⅰ组载体在与鸡胚绒毛尿囊膜直接接触的下方,血管生长较少,血管分支也少,因此,推测它们可能有抑制血管生长的作用。
3.2.2 数据统计 将血管按照直径进行统计,将数据分为大、中、小三个等级。数据以均数±标准误(±s)表示。
实验数据统计结果见表1。
不同化合物对鸡胚绒毛尿囊膜血管的影响见图1。

表1 鸡胚绒毛尿囊膜血管数目统计结果Tab.1 Statistical results of vascular numbers in chick embryo chorioallantoic membrane
3.2.3 统计结果 以空白组作为对照组,将各组数据进行Ridit分析,重楼皂苷I组P<0.05,其95%可信区间为0.62±(2×0.052),即0.52~0.73,重楼皂苷I有抑制新生血管生成的作用。结果见表1,图2。

图1 化合物1,2,3,4对鸡胚绒毛尿囊膜血管的影响Fig.1 Influence of compound 1,2,3,4 on angiogenesis in chick embryo chorioallantoic membrane
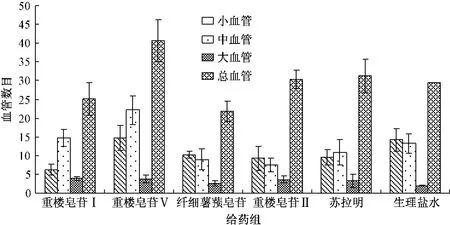
图2 给药后各组血管数目比较Fig.2 Statistical results of vascular numbers in chick embryo chorioallantoic membrane
4 讨论
Ridit分析结果显示,重楼皂苷I有抑制血管新生的作用。但由于大血管和中血管在给药之前就已经形成,因此,在分析数据时,主要对小血管进行分析比较,故认为重楼皂苷Ⅱ和纤细薯蓣皂苷亦有抑制血管新生的趋势。从图2中可以看出重楼皂苷Ⅰ、重楼皂苷Ⅱ和纤细薯蓣皂苷的活性顺序为纤细薯蓣皂苷<重楼皂苷Ⅱ<重楼皂苷Ⅰ。重楼皂苷Ⅰ的活性最佳,纤细薯蓣皂苷活性最弱,重楼皂苷Ⅴ没有活性。比较它们的结构发现,重楼皂苷Ⅰ是唯一含有阿拉伯糖的成分,因此推测阿拉伯糖对抑制血管生长活性有重要贡献;另外重楼皂苷Ⅴ不具有抑制血管生长的活性,纤细薯蓣皂苷的活性最低,它们的结构中与苷元直接相连的葡萄糖的4位上没有糖取代,而重楼皂苷Ⅱ和重楼皂苷Ⅰ的结构中葡萄糖的4位上有糖取代,因此推测与苷元直接相连的葡萄糖的4位上的糖取代对活性也有重要意义。纤细薯蓣皂苷的活性大于重楼皂苷Ⅴ的活性,是由于纤细薯蓣皂苷的结构中比重楼皂苷Ⅴ结构中的糖的数目多。因此得到如下结论:若薯蓣皂苷结构中含有阿拉伯糖,抑制血管生长活性增强;若皂苷结构中与苷元直接相连的葡萄糖的4位上有糖取代,抑制血管活性增强;结构中糖的数目增多,抑制血管活性增强。在下一步的研究过程中,将对它们抑制血管生长活性的量效关系进行详细的研究。
[1]Folkman J.What is the evidence that tumors are angiogenesis department?[J]J Natl Cancer Inst,1990,82(1):4-6.
[2]He Z Y,Chen Z Y,Qiu C P,et al.Cloning expression and tumor suppression of human endo statin[J].Acta Biochemicaet Biophysica Sinica,2000,32(4):333-336.
[3]沈先荣,贾福星,王 灵,等.鲨鱼软骨制剂抑制血管生成的研究[J].生物化学与生物物理进展,1997,24(2):155-159.
[4]胡德恩.抑制血管生成在抗癌治疗中的意义[J].国外医学肿瘤学分册,1990(6):321-324.
[5]郭青龙.肿瘤药理学[M].北京:化学工业出版社,2007:102.
[6]毕 葳,沈 葹,雷海民,等.云南白药抑制新生血管生成活性部位筛选[J].中国实验方剂学杂志,2011,17(22):223-225.
[7]李汉青,伍贤志,雷海民,等.复方三黄胶囊抑制肿瘤血管生成的活性部位筛选[J].中国实验方剂学杂志,2011,17(4):172-175.
[8]胡光万,雷立公.出自深山的良药—重楼[J].植物杂志,2002(3):16.
[9]国家中医药管理局《中华本草》编委会.中华本草精选本:下册[M].上海:上海科技出版社,1998:2062-2063.
[10]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:243.
[11]石小枫,杜德极.重楼总皂甙对H22动物移植性肿瘤的影响[J].中药材,1992,15(2):35.
[12]季 申,张锦哲.中药重楼和云南白药中抗肿瘤细胞毒活性物质 Gracinin的测定[J].中成药,2001,23(2):212.
[13]钱晓萍,刘宝瑞,胡 静.重楼醇提物作为抑制血管生成的应用:中国,200710020605[P].2007-08-29.
[14]孙敬勇,仲 英,左春旭,等.霞草中化学成分的分离与结构鉴定[J].药学学报,2005,40(11):994-996
[15]赵 玉.滇重楼中甾体类皂苷成分的研究[D].北京:中国人民解放军军事医学科学院,2007.
