炎症性肠病伴口腔溃疡患者个体化饮食健康管理方案研究
2012-09-06周惠芬张苏闽王元钊
杨 旭,周惠芬,张苏闽,叶 妮,赵 璟,王元钊
食物不耐受 (FI)是由于机体不能充分消化食物大分子物质并由此产生特异性IgG抗体而引发的抵抗性反应,其发生被认为是可重复出现的、对特定食物或食物成分产生的不良反应[1]。英国YORK营养学实验室对2 567例怀疑有FI的英国人进行调查,发现69%被划分为慢性病患者,其中消化性统疾病占44%。FI与慢性消化系疾病如肠易激综合征 (IBS)、炎症性肠病 (IBD)包括溃疡性结肠炎 (UC)和克罗恩病(CD)等的相关性研究已成为国内外学者研究的热点[2-4]。
口腔溃疡是IBD最常见的肠外表现,但IBD的病因和发病机制目前尚未完全明确,已知肠道黏膜免疫系统异常反应所导致的炎症反应在IBD发病中起重要作用,是环境、饮食、感染和免疫等多因素相互作用所致,其中饮食因素与IBD伴口腔溃疡的相关性正日益引起临床医师的关注。研究表明,复发性口腔溃疡与FI密切相关[5],而FI与IBD伴口腔溃疡相关性的研究报道较少。本研究采用酶联免疫吸附试验 (ELISA法)检测48例IBD伴口腔溃疡患者和25例健康体检正常者血清中14种食物特异性IgG抗体水平,根据检测结果对部分阳性患者实施个体化饮食健康管理方案并评价其对患者口腔溃疡症状的影响,现报道如下。
1 资料与方法
1.1 纳入与排除标准
1.1.1 纳入标准 (1)年龄18~65岁;(2)符合中华医学会消化病学分会IBD协作组《对我国炎症性肠病诊断治疗规范的共识意见》中UC及CD诊断标准并伴口腔溃疡[6];(3)疾病发作间歇期<2个月;(4)完成FI血清特异性IgG抗体检测;(5)知情同意,可完成随访。
1.1.2 排除标准 (1)过敏体质者;(2)急性暴发型患者;(3)孕产妇及哺乳期女性;(4)合并糖尿病、心脑血管疾病、肝肾和造血系统等严重原发性疾病及精神疾病者;(5)结肠狭窄、梗阻、肠穿孔、中毒性巨结肠、结直肠癌等严重并发症者;(6)未按规定方案管理饮食、出现不良反应而中止试验、无法判断疗效或资料不全影响疗效判断者。
1.2 一般资料 根据上述标准选择2009年1月—2012年2月我院收治的门诊及住院IBD伴口腔溃疡患者48例为病例组,其中男22例,女26例;年龄21~62岁,平均 (29.7±6.9)岁;病程0.5~7.3年,平均 (4.3±1.7)年;UC患者21例、CD患者27例;溃疡个数:1个者10例、2个者19例、3个者15例、4个者4例。选择同期我院健康体检正常者25例为健康体检组,其中男12例,女13例;年龄22~56岁,平均(32.1±8.7)岁;排除有IBD病史及近3个月内有口腔溃疡病史者。
1.3 FI血清特异性IgG抗体检查 采用ELISA法检测两组患者血清中14种食物过敏原特异性IgG抗体水平,食物过敏原检测试剂盒由美国BIOMERICA公司生产,Elx800酶标仪由美国BIO-TEK公司生产;14种食物包括牛肉、鸡肉、鳕鱼、玉米、蟹、蘑菇、牛奶、蛋黄蛋白、猪肉、大米、虾、大豆、西红柿、小麦。检测步骤:(1)绘制标准曲线;(2)将稀释100倍的血清100 μl加入每个反应孔; (3)封闭微孔板后室温孵育1 h;(4)清洗;(5)每孔加入100 μl抗人IgG抗体-辣根过氧化物酶结合液;(6)封闭并室温孵育0.5 h;(7)清洗孔板;(8)每孔加入100 μl工作底物混合液;(9)封闭微孔板后室温孵育10 min;(10)每孔加入50 μl终止液,混匀后测定吸光度值,根据每孔吸光度值计算IgG抗体水平。
1.4 阳性标准 根据FI血清特异性IgG抗体水平,以<50 U/ml为阴性,50~100 U/ml为轻度阳性,101~200 U/ml为中度阳性,>200 U/ml为重度阳性。
1.5 个体化饮食健康管理方案及结果判定 根据FI血清特异性IgG抗体检测结果,将不耐受的食物分为忌食、轮替食用和安全食用。对不耐受食物种类少者直接“忌食”,不耐受食物种类多者可将中度和重度阳性的不耐受食物列为“忌食”,轻度阳性的不耐受食物列为“轮替食用”,即间隔一段时间后重新食用。因患者不耐受的饮食物存在个体差异,故每例患者必须施行基于FI血清特异性IgG抗体检测结果的个体化饮食健康管理方案。结果判定:(1)有效:患者口腔溃疡发作间歇期延长至3个月以上;(2)无效:患者口腔溃疡发作间歇期无延长[7]。
1.6 统计学方法 应用SPSS 16.0统计软件进行分析,计量资料以 (±s)表示,采用t检验;计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 FI血清特异性IgG抗体阳性率 健康体检组FI血清特异性IgG抗体阳性者3例,阳性率为12.00% (3/25);病例组中FI血清特异性IgG抗体阳性者39例,阳性率为81.25%(39/48)。两组FI血清特异性IgG抗体阳性率比较,差异有统计学意义 (χ2=12.37,P<0.05)。
2.2 不耐受食物分析 病例组前6位不耐受的食物依次为蛋黄蛋白 (33.33%)、蟹 (18.75%)、虾 (16.67%)、牛奶(14.58%)、鳕鱼 (10.42%)、大豆 (10.42%);有1例患者对大米不耐受,1例对鸡肉不耐受,详见表1。
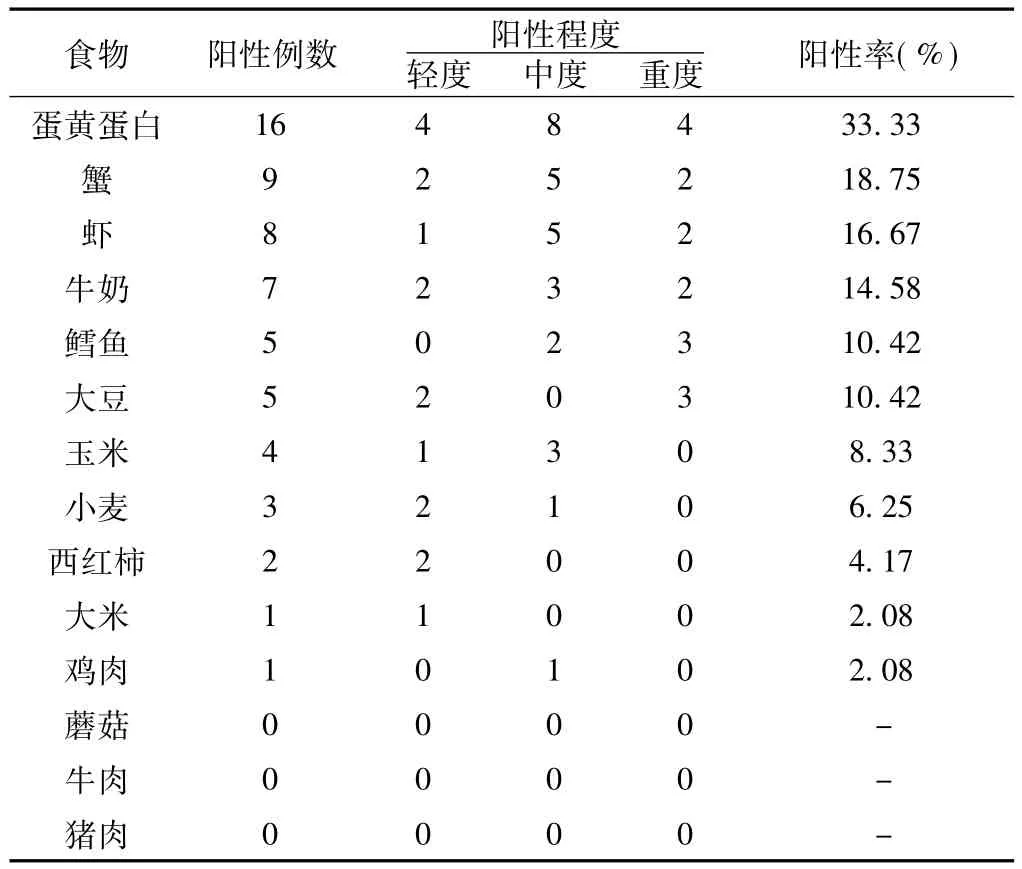
表1 IBD伴口腔溃疡患者不耐受食物分析 (n=48)Table 1 Analysis of intolerance food detection in IBD patients with oral ulcer
2.3 个体化饮食健康管理结果 将病例组中FI血清特异性IgG抗体阳性的39例患者按随机数字表法分为试验组20例,对照组19例,两组患者的性别、年龄、病程、溃疡个数等一般资料比较,差异均无统计学意义 (P>0.05,见表2),具有可比性。试验组实施个体化饮食健康管理方案+IBD常规治疗;对照组仅给予IBD常规治疗。两组疗程均为3个月,3个月后通过门诊或电话进行随访,对照组患者均完成随访,试验组完成个体化饮食健康管理方案者18例,1例因病情加重而退出、1例失访。对照组有效1例、无效18例,有效率为5.3%;试验组有效14例、无效4例,有效率为77.8%;两组有效率比较,差异有统计学意义 (χ2=25.37,P<0.05)。对照组3个月内口腔溃疡无复发者1例、复发2次者11例、复发2次以上者7例;试验组无复发者14例、复发1次者3例、复发2次者1例;两组口腔溃疡复发率比较,差异有统计学意义 (χ2=29.72,P <0.05)。
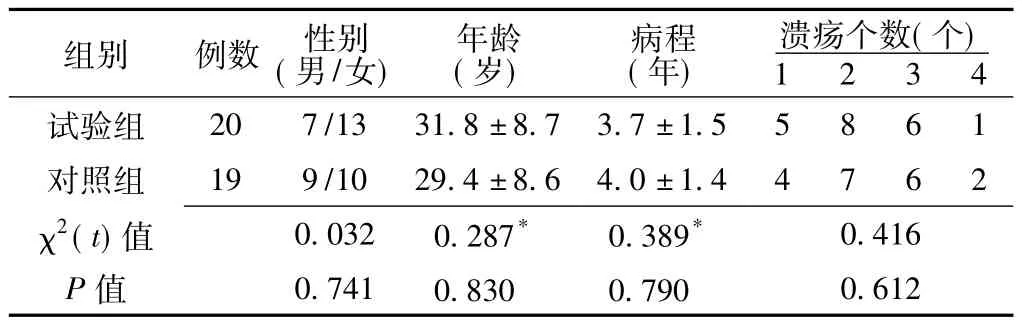
表2 试验组和对照组一般资料比较Table 2 Comparison of general information between experiment group and control group
3 讨论
1905年从事环境医学的英国医生Frances Hare博士发现许多慢性疾病的发生与食物有关,禁食有问题的食物之后症状就会消失。FI不同于传统意义上的食物过敏,食物过敏是机体对食物或食物成分的异常免疫反应,是由IgE介导的速发性超敏反应,常由天然蛋白质引起,而FI是由IgG抗体介导的迟发型免疫反应[8-9]。英国过敏协会的统计资料表明,人群中约45%对某些食物存在不耐受,可引起胃肠道疾病、皮肤病、肌肉骨骼疾病及神经性疾病等多种慢性反复发作性疾病或症状,严重影响患者的工作和生活。此类患者接受药物治疗可解除病痛,但无法从根本上解除病因,且可能给患者及其家属带来一定的经济负担。
研究证明,口腔溃疡与FI存在相关性并可通过饮食调整达到缓解或减少反复发作次数[10-11]。口腔溃疡是IBD患者最常见的肠外并发症,UC患者的发生率为5%~10%,CD患者的发生率为6% ~20%[12-13],以口腔黏膜的阿弗他溃疡为主,呈反复发作的圆形或椭圆形、浅而小的溃疡,临床表现具有红、黄、凹、痛等特点,治疗以药物局部外用为主,但疗效欠佳,严重影响患者的工作、生活和学习。
本研究结果显示,IBD伴口腔溃疡患者FI血清特异性IgG抗体阳性率明显高于健康人群,表明IBD患者存在FI。根据FI血清特异性IgG抗体阳性结果,在IBD常规治疗基础上对IBD伴口腔溃疡患者实施个体化饮食健康管理3个月,其口腔溃疡症状得到有效缓解,有效率为77.78%,明显高于仅给予IBD常规治疗者。试验组有14例患者3个月内口腔溃疡未再发作,口腔溃疡复发率明显低于对照组。口腔溃疡可作为IBD患者的首发症状出现,且与疾病活动性相关[14],本研究结果显示,对照组有1例患者口腔溃疡自行消退,可能与肠道基础炎症反应得到有效控制有关。研究表明,通过FI血清特异性IgG抗体检测并采取针对性的饮食调整计划可缓解IBD患者的症状,对IBD患者的临床治疗有辅助作用[8,15],本研究得到了相似的结果,分析其原因可能有两个方面:一方面个体化的饮食健康管理可直接缓解患者口腔溃疡的临床症状,减少溃疡复发次数,进而缓解IBD的炎症反应程度;另一方面个体化的饮食健康管理减轻了IBD患者的肠道症状,有利于其肠外表现的缓解,体现了整体治疗的理念。
综上所述,IBD伴口腔溃疡患者FI血清特异性IgG抗体阳性率较高,个体化饮食健康管理可有效缓解IBD伴口腔溃疡患者的口腔溃疡症状,降低其复发率,有利于IBD的治疗。但本研究样本量较小、观察时间较短,其远期疗效的评估及建立基于FI血清特异性IgG抗体检测的个体化饮食健康管理体系有待于通过扩大样本、采用多中心随机对照临床试验进一步验证。
1 David TJ.Adverse reactions and intolerance to foods[J].Br Med Bull,2000,56(1):34 -50.
2 MacDermott RP.Treatment of irritable bowel syndrome in outpatients with inflammatory bowel disease using a food and beverage intolerance,food and beverage avoidance diet[J].Inflamm Bowel Dis,2007,13(1):91-96.
3 周燕,王红玲,肖建群.四种常见消化系疾病患者食物不耐受的检测[J].现代检验医学杂志,2010,25(3):134-136.
4 杨旭,张苏闽,章金春,等.溃疡性结肠炎患者食物不耐受检测结果初步分析 [J].中华中医药杂志,2011,26(11):2576-2579.
5 潘晓骅,孙洪,陈琼,等.饮食控制缓解复发性口腔溃疡的临床研究[J].华西口腔医学杂志,2010,28(1):68-70.
6 中华医学会消化病学分会炎症性肠病协作组.对我国炎症性肠病诊断治疗规范的共识意见 [J].中华消化杂志,2007,7(8):545-550.
7 张举之.口腔内科学[M].北京:人民卫生出版社,1999:358.
8 杨旭,章金春,李梅,等.食物不耐受与炎症性肠病 [J].世界华人消化杂志,2011,19(30):3182-3185.
9 于燕,齐玲芝,李春荣.炎症性肠病65例临床分析[J].中国全科医学,2010,13(5):1683
10 孙改河.40例口腔溃疡患者血清食物不耐受特异性IgG抗体的检测[J].国际检验医学杂志,2008,29(1):16-17.
11 刘健,仇永乐,许彦枝.食物不耐受检测在复发性阿弗他溃疡诊治中的作用[J].河北医科大学学报,2010,31(11):1333-1334.
12 郑连鹏,吕宗舜,张洁,等.中国大陆地区炎症性肠病肠外表现的汇总分析[J].世界华人消化杂志,2009,17(21):2217-2220.
13 李敏,宋文婷,林梅.炎症性肠病的口腔损害及其诊断[J].国际口腔医学杂志,2010,37(3):330-332.
14 罗优优,陈春晓,厉有名.炎症性肠病的肠外表现与治疗 [J].国际消化病杂志,2006,26(2):87-90.
15 杨旭,周惠芬,张苏闽,等.基于食物特异性IgG检测的溃疡性结肠炎患者个体化饮食健康管理方案研究 [J].中国全科医学,2012,15(7):2319-2322.
