芪黄明目胶囊对糖尿病小鼠视网膜病变及生长因子表达的影响
2012-09-06朱慧明张会欣何奇龙高学东齐晓琳王宏涛
朱慧明,魏 刚,张会欣,何奇龙,高学东,齐晓琳,王宏涛
糖尿病性视网膜病变 (DR)是糖尿病微血管病变中最重要的表现,同时也是糖尿病并发症在眼部的主要表现[1]。研究表明,高糖状态下生长因子在眼内新生血管形成过程中起关键性作用,并且能够引起视网膜微血管渗透性的改变,造成视网膜屏障的破坏,同时能够诱导血管生成素生成增加,造成视力损坏。芪黄明目胶囊在DR临床研究中取得了很好的疗效[2],但其机制尚不明确。故本研究以自发性2型糖尿病KK/Upj-Ay小鼠为模型,观察芪黄明目胶囊对DR小鼠视网膜生长因子表达的影响,探讨其机制,为临床用药提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 KK/Upj-Ay小鼠 (自发性2型糖尿病小鼠,用专用饲料喂养3个月即可造模成DR小鼠)36只,体质量30~40 g;C57BL/6小鼠9只,体质量25~30 g。均为SPF级,雄性,12周龄,购于北京华阜康生物科技股份有限公司,动物合格证号:0225144。饲养于SPF级动物屏障系统。
1.1.2 试剂与仪器 芪黄明目胶囊,由石家庄以岭药业股份有限公司提供;血管内皮生长因子 (VEGF)、碱性成纤维细胞生长因子 (bFGF)、色素上皮衍生因子 (PEDF)、转化生长因子-β(TGF-β)、胰岛素样生长因子-Ⅰ (IGF-Ⅰ)引物由上海生工生物技术公司合成;VEGF、bFGF、PEDF、TGF-β、IGF-Ⅰ一抗购自Santa Cruz公司。荧光定量 PCR仪,ABI公司产品;凝胶成像分析仪,Biorad公司产品。
1.2 方法
1.2.1 动物分组与给药 36只KK/Upj-Ay小鼠按空腹血糖(FBG)水平随机分为模型组、芪黄明目胶囊高剂量组 (8.32 g生药/kg)、芪黄明目胶囊中剂量组 (4.16 g生药/kg)、芪黄明目胶囊低剂量组 (2.08 g生药/kg),另设C57BL/6小鼠为对照组,每组9只。采用灌胃给药,芪黄明目胶囊各组按照相应的剂量给予芪黄明目胶囊,对照组和模型组给予等体积的蒸馏水,1次/d,连续3个月。
1.2.2 小鼠视网膜消化铺片标本制备 连续给药3个月后,把小鼠麻醉,取眼球,固定于10%甲醛液中48 h,分离视网膜,自来水漂洗,放入3%胰蛋白酶消化液37℃孵箱中消化振荡约3 h,仅剩下一层透明的视网膜血管网,进行HE-PAS染色。
1.2.3 Real Time PCR(qPCR)方法测定 VEGF、bFGF、PEDF、TGF-β、IGF-Ⅰ mRNA的表达 取视网膜组织,常规方法提取RNA,进行Real Time PCR扩增,以GAPDH作为内参照。VEGF引物:上游:5'-TGTCTATCAAGGGAGTGTGTGC-3',下游:5'-TGGAGTATTTCCGTGACCG -3',产物片段150 bp;bFGF引物:上游:5'-CGTCAAACTACAACTCCAAGCA -3',下游:5'-CGTCCATCTTCCTTCATAGCA -3',产物片段 93 bp;PEDF引物:上游:5'-TGGGTAACCAAGTTTGACTCG -3',下游:5'-AAGCCGTATCGTAAGATGGC-3',产物片段116 bp;TGF-β引物:上游:5'-CCGCAACAACGCCATCTATG -3',下游:5'-TGCTTCCCGAATGTCTGACG-3',产物片段85 bp;IGF-Ⅰ引物:上游:5'-CTCTTCAGTTCGTGTGTGGAC-3',下游:5'-AATGCTGGAGCCATAGCCT-3',产物片段68 bp;GAPDH引物:上游:5'-TGCTGAGTATGTCGTGGAGTC -3',下游:5'-TGCTGAGTATGTCG TGGAGTC-3',产物片段143 bp。最终结果计为与对照组进行比较后的相对定量值,对照组设置为1。
1.2.4 Western blot法检测 VEGF、bFGF、PEDF、TGF - β、IGF-Ⅰ蛋白的表达 取视网膜组织,常规方法提取蛋白质,化学发光法显色,对条带进行吸光度积分扫描。GAPDH作为内参照。用目的蛋白吸光度值/内参照吸光度值的比值进行比较。
1.3 统计学方法 计量资料以 (±s)表示,采用SPSS 11.5软件进行ANOVA统计分析和Dunnet t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 视网膜消化铺片形态学观察 对照组正常小鼠视网膜毛细血管分布规则,走向较直,管径粗细均匀一致;模型组小鼠视网膜毛细血管网排列紊乱,走向极不规则,多根毛细血管扭聚成丛,部分毛细血管扩张、管腔粗细不均;芪黄明目胶囊能明显改善上述变化,以芪黄明目胶囊高剂组最为明显。
2.2 视网膜VEGF、bFGF、PEDF、TGF-β、IGF-Ⅰ mRNA表达的变化 模型组小鼠视网膜 VEGF、bFGF、PEDF、TGF-β、IGF-ⅠmRNA表达与对照组比较,差异均有统计学意义 (P<0.01)。与模型组比较,芪黄明目胶囊中、高剂量组小鼠VEGF、IGF-Ⅰ mRNA表达显著减少,芪黄明目胶囊高剂量组小鼠TGF-β mRNA表达显著减少,差异均有统计学意义 (P<0.05);而芪黄明目胶囊低、中、高剂量组小鼠bFGF、PEDF mRNA表达与模型组比较,差异均无统计学意义(P>0.05,见表1、图1)。
2.3 视网膜VEGF、bFGF、PEDF、TGF-β、IGF-Ⅰ蛋白表达的变化 Western blot结果显示,模型组小鼠视网膜VEGF、bFGF、PEDF、TGF-β、IGF-Ⅰ蛋白表达量与对照组比较,差异均有统计学意义 (P<0.01)。与模型组比较,芪黄明目胶囊中、高剂组小鼠视网膜VEGF、TGF-β、IGF-Ⅰ蛋白表达量显著减少,差异均有统计学意义 (P<0.05);而bFGF和PEDF蛋白表达量与模型组比较,差异均无统计学意义 (P>0.05,见表2、图2)。
表1 各组小鼠视网膜VEGF、bFGF、PEDF、TGF-β、IGF-ⅠmRNA表达比较 (±s)Table 1 Comparison of the mRNA expression of VEGF,bFGF,PEDF,TGF-β and IGF-Ⅰ in retina of each group
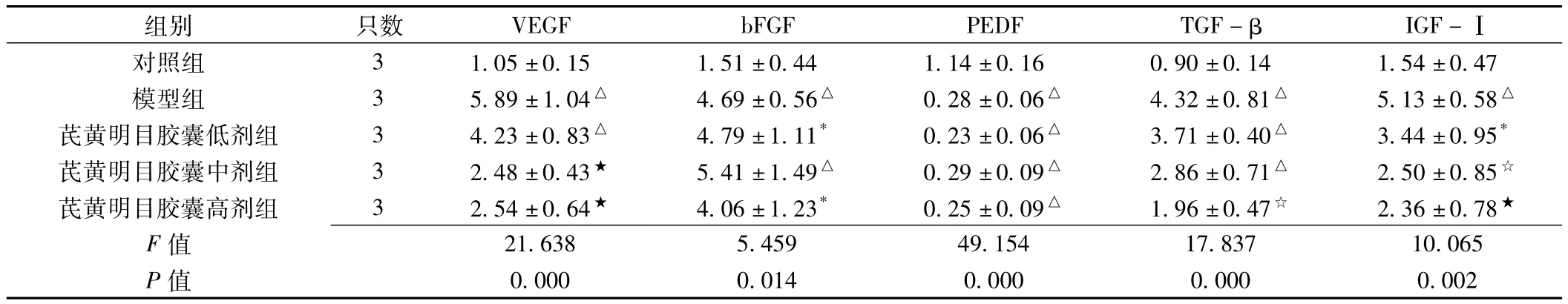
表1 各组小鼠视网膜VEGF、bFGF、PEDF、TGF-β、IGF-ⅠmRNA表达比较 (±s)Table 1 Comparison of the mRNA expression of VEGF,bFGF,PEDF,TGF-β and IGF-Ⅰ in retina of each group
注:与对照组比较,*P<0.05,△P<0.01;与模型组比较,☆P<0.05,★P<0.01;VEGF=血管内皮生长因子,bFGF=碱性成纤维细胞生长因子,PEDF=色素上皮洐生因子,TGF-β=转化生长因子-β,IGF-Ⅰ=胰岛素样生长因子-Ⅰ
组别 只数 VEGF bFGF PEDF TGF-β IGF-Ⅰ对照组 3 1.05±0.15 1.51±0.44 1.14±0.16 0.90±0.14 1.54±0.47模型组 3 5.89±1.04△ 4.69±0.56△ 0.28±0.06△ 4.32±0.81△ 5.13±0.58△芪黄明目胶囊低剂组 3 4.23±0.83△ 4.79±1.11* 0.23±0.06△ 3.71±0.40△ 3.44±0.95*芪黄明目胶囊中剂组 3 2.48±0.43★ 5.41±1.49△ 0.29±0.09△ 2.86±0.71△ 2.50±0.85☆芪黄明目胶囊高剂组 3 2.54±0.64★ 4.06±1.23* 0.25±0.09△ 1.96±0.47☆ 2.36±0.78★F 0.000 0.014 0.000 0.000 0.002 21.638 5.459 49.154 17.837 10.065 P值值
表2 各组小鼠视网膜VEGF、bFGF、PEDF、TGF-β、IGF-Ⅰ 蛋白表达的比较 (±s)Table 2 Compariosn of the protein expression of VEGF,bFGF,PEDF,TGF-β and IGF-Ⅰ in retina of each group

表2 各组小鼠视网膜VEGF、bFGF、PEDF、TGF-β、IGF-Ⅰ 蛋白表达的比较 (±s)Table 2 Compariosn of the protein expression of VEGF,bFGF,PEDF,TGF-β and IGF-Ⅰ in retina of each group
注:与对照组比较,*P<0.05,△P<0.01;与模型组比较,☆P<0.05,★P<0.01
组别 只数 VEGF bFGF PEDF TGF-β IGF-Ⅰ对照组 3 0.16±0.04 0.12±0.03 0.84±0.12 0.14±0.06 0.16±0.04模型组 3 0.79±0.12△ 0.61±0.08△ 0.34±0.05△ 0.71±0.11△ 0.69±0.11△芪黄明目胶囊低剂组 3 0.65±0.09△ 0.66±0.06△ 0.36±0.06△ 0.63±0.10△ 0.61±0.08△芪黄明目胶囊中剂组 3 0.48±0.07△★ 0.64±0.11△ 0.34±0.07△ 0.49±0.08△☆ 0.44±0.08△★芪黄明目胶囊高剂组 3 0.36±0.06*★ 0.59±0.09△ 0.32±0.06△ 0.42±0.07△★ 0.33±0.05△★F 值0.000 0.014 0.000 0.000 0.000 27.593 25.447 26.652 20.485 23.251 P值
图1 各组荧光定量PCR扩增曲线Figure 1 Amplification curve of real-time fluorescent quantitative PCR of each groups

图2 各组小鼠视网膜Western blot结果Figure 2 Results of Western blot of each group
3 讨论
许多因素,如血糖、血压等对DR的发生发展均有重要作用[3],其发病机制尽管尚未明确,但随着细胞生物学和分子生物学技术在DR发病机制方面的深入研究,已证实VEGF、bFGF、TGF-β、IGF-Ⅰ、PEDF等细胞因子通过一个复杂的网络系统共同参与了DR的发生发展。其中,正常情况下视网膜细胞可产生较低水平的VEGF,用以维持血管稳定性和视网膜正常发育,高血糖状态下视网膜局部缺氧导致VEGF表达上调,强力促进内皮细胞增殖,增加血管通透性及诱导新生血管生成,在DR的发生发展中起重要作用[4-5]。TGF-β眼内来源广泛,DR患者血清中TGF-β水平明显高于健康人群,并随病程的延长及眼部病情的加重而增高[6],可能是促进内皮细胞的增生、黏附及细胞外基质的沉积、激活丝裂原活化蛋白激酶、增加纤维连接蛋白的合成而参与了DR的形成。IGF-Ⅰ是一种多功能细胞增生调控因子,是眼组织正常发育并完成其生理功能所必需的重要因子,但在糖尿病条件下,IGF网络系统的作用明显增强[7],可以促进视网膜新生血管的形成。本研究结果显示,自发性2型糖尿病小鼠视网膜毛细血管网排列紊乱,走向极不规则,多根毛细血管扭聚成丛,部分毛细血管扩张、管腔粗细不均,提示6个月的KK/Upj-Ay小鼠发生了DR,采用qPCR和Western blot技术发现DR小鼠视网膜VEGF、TGF-β、IGF-ⅠmRNA和蛋白表达量均显著升高,与文献报道一致[4-7]。芪黄明目胶囊治疗3个月后能明显改善视网膜损伤,延缓视网膜病变的发展,显著降低DR小鼠VEGF、TGF-β、IGF-Ⅰ mRNA和蛋白水平,提示芪黄明目胶囊治疗DR与下调VEGF、TGF-β、IGF-Ⅰ表达有关。
同时本研究检测了DR小鼠bFGF和PEDF的表达。bFGF促进DR发展的具体机制尚不明确,目前认为bFGF可通过旁分泌途径和自分泌途径作用于视网膜的各层细胞,并促进其他生长因子的分泌,因而与DR密切相关[8]。PEDF被认为是最有效的天然血管抑制因子,在减少血管渗漏和新生血管形成等病理过程中发挥着重要作用,研究表明在DR的早、中、晚期PEDF的保护性作用持续存在[9]。本研究结果显示,模型组小鼠视网膜bFGF表达较正常小鼠显著升高,PEDF表达显著降低,芪黄明目胶囊各组bFGF、PEDF表达与模型组比较无显著差异,提示芪黄明目胶囊对DR的作用与bFGF、PEDF途径无关。
芪黄明目胶囊为中药复方制剂,以化瘀通络为前提,配合滋润通补、补气通络、熄风解痉、解毒通络诸法,从络论治DR的复方中药,在Ⅲ期临床试验中显示了很好的效果,同时还具有降糖的作用[2]。总之,芪黄明目胶囊对2型糖尿病小鼠视网膜发挥保护作用,可能与其下调 VEGF、TGF-β、IGF-Ⅰ表达有关,但具体机制还需进一步深入研究。
1 张楠,郑远远,万钢,等.社区糖尿病视网膜病变及危险因素探讨[J].中国全科医学,2011,14(9):2949-2952.
2 吴烈,晏飞,苏航,等.芪黄明目胶囊治疗非增殖期糖尿病视网膜病变的临床研究[J].中国中医眼科杂志,2009,19(2):74-78.
3 韦旭,孙继玮.影响2型糖尿病患者视网膜病变的临床因素分析[J].中国全科医学,2008,11(8):1482-1484.
4 Grant MB,Afzal A,Spoerri P,et al.The role of growth factors in the pathogenesis of diabetic retinopathy [J].Expert Opin Investig Drugs,2004,13(10):1275-1293.
5 Montero JA,Ruiz-Moreno JM,Correa ME.Intravitreal anti-VEGF drugs as adjuvant therapy in diabetic retinopathy surgery [J].Curr Diabetes Rev,2011,7(3):176 -184.
6 叶健华,林晓峰,马承红,等.转化生长因子β1在非增殖型糖尿病视网膜病变中的变化 [J].眼科学报,2006,22(1):14-16.
7 Bergman PB,Moravski CJ,Edmondson SR,et al.Expression of the IGF system in normal and diabetic transgenic(mRen-2)27 rat eye[J].Invest Ophthalmol Vis Sci,2005,46(8):2708 -2715.
8 Yoshida S,Ishikawa K,Asato R,et al.Increased expression of periostin in vitreous and fibrovascular membranes obtained from patients with proliferative diabetic retinopathy [J].Invest Ophthalmol Vis Sci,2011,52(8):5670-5678.
9 Yoshida Y,Yamagishi S,Matsui T,et al.Protective role of pigment epithelium-derived factor(PEDF)in early phase of experimental diabetic retinopathy [J].Diabetes Metab Res Rev,2009,25(7):678-686.
