特异性小干扰RNA抑制诱骗受体3在结肠癌SW480细胞表达的研究
2012-09-05伍冀湘钟晨熙梁杰雄许英晨
何 平 伍冀湘* 钟晨熙 戴 洁 梁杰雄 李 洋 许英晨 于 玮
(1.首都医科大学附属北京安贞医院普外科,北京100029;2.首都医科大学基础医学院病理学系,北京100069)
诱骗受体3(decoy receptor 3,DcR3)/又称肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)6B/TR6是1998年Pitti等[1]发现的一种可溶性TNFR超家族的新成员。它可竞争性地与肿瘤坏死因子超家族成员人凋亡相关因子配体(people apoptosis related related factor ligand,FasL)、疱疹病毒侵入介体配体(herpes virus intrusion fixator lagand,LIGHT)及肿瘤坏死因子样配体(tumor necrosis factor sample ligand,TLIA)结合,在肿瘤免疫、移植免疫、自身免疫及抗感染免疫中都发挥着重要的作用[2]。构建人特异性DcR3小干扰RNA(small interfering RNA,siRNA)表达质粒,转染入人结肠癌SW480细胞系,检测内源性DcR3基因的表达情况,为进一步研究DcR3在体内恶性肿瘤的发生、发展以及肿瘤的免疫逃逸等相关作用奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 细胞系
人结直肠癌细胞株SW480(中国科学院上海生命科学研究院细胞资源中心)。
1.1.2 主要试剂
1)细胞培养:RPMI 1640细胞培养液(美国GIB-CO公司),胎牛血清(天津川页生化制品公司)。
2)siRNA表达质粒构建、提取及转染:pSUPER质粒(中日友好医院肾病中心馈赠),DcR3的siRNA特异引物合成(上海生工生物工程公司,详见表1);T4联接酶、限制性内切酶(日本宝生物公司),质粒中提试剂盒(美国Promega公司),Lipofectamine 2000转染试剂(美国Invitrogen公司)。
3)RNA提取、反转录及多聚酶链反应试剂:总RNA提取试剂盒(上海生工生物工程公司),莫洛尼鼠白血病病毒(M-MLV)反转录酶(美国Promega公司),Taq DNA聚合酶、RNA酶抑制剂(华美生物工程公司),PCR引物(上海生工生物工程公司,详见表2)。
4)蛋白免疫印迹:小鼠抗人DcR3单克隆抗体,辣根过氧化物酶(HRP)标记的羊抗小鼠IgG(美国Santa Cruz公司);ECL发光试剂盒(美国 Roche公司)。

表1 DcR3的siRNA特异引物合成Tab.1 DcR3 siRNA specific primer synthesis

表2 PCR引物序列Tab.2 Primer sequences
1.2 方法
1)siRNA序列筛选:自GeneBank中查找人DcR3全序列,编号AF104419。通过Dharmacon公司的网上siRNA设计工具siDESIGNR○Center,设计siRNA序列;根据结果,选择最佳序列进行合成。
2)DcR3的pSUPER表达质粒的构建:用限制性内切酶(BgⅢ/HindⅢ)将pSUPER载体进行酶切处理;将配对的2条引物加入延伸缓冲液形成双链,经磷酸化后处理后与经载体联接。联接后的载体经转化和扩增后,提取质粒进行鉴定。鉴定成功后进行中提,以用于转染。
3)SW480细胞培养:将SW480用含10%灭活胎牛血清的RPMI 1640培养液在37℃、5%CO2条件下孵育2~3 d后,传代1次,计数后按1×105个细胞/孔接种于100 mm培养皿中,2 d后细胞达到80%融合,融合后的细胞用于实验。
4)质粒转染:将 6 μg纯化的质粒以 Lipofectamine 2000为介质转染入SW480。
5)反转录及PCR测定:提取总RNA并反转录。以反转录所获cDNA为模板,以β-actin为内参照,检测DcR3的表达。经PCR扩增后行凝胶成像后,用Scion Image 4.03进行分析,结果以所测样品指标的吸光度值与作为内参照的β-actin吸光度比值来表示。
6)蛋白免疫印记:SW480转染48 h后,分别加入十二烷基硫酸钠样本缓冲液裂解细胞(内含100 mmol/L Tris-HCl、2%SDS、5% β 巯基乙醇及10%甘油),冰上裂解10 min,刮下细胞及其裂解产物,超声波粉碎后煮沸5 min,离心,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,100 V恒压转膜,分别用小鼠抗人DcR3单克隆抗体(第一抗体)及HRP标记的羊抗小鼠IgG(第二抗体)进行杂交,ECL试剂盒发光,暗室曝光X片,凝胶扫描分析系统(Scion Image 4.03软件)测定吸光度。
7)MTT法检测DcR3-siRNA对SW480细胞生长的影响:取对数生长期细胞接种于96孔培养板中,每孔加100 μL,每组6孔,接种24 h后弃去上清,分别加入 pSUPER-hDcR3-1、pSUPER-hDcR3-2和 pSUPER-Con(终浓度0.1 nmol/L),置于37℃、5%CO2培养箱中无血清继续培养6 h,再各补加无双抗含10%小牛血清的RPMI-1640 100 μL。于48 h后加入MTT 20 μL,继续培养4 h后离心弃上清,加入DMSO 150 μL,震荡15 min后,酶标仪下读取吸光度(A)。
细胞存活率=(实验组吸光度/空白对照组吸光度)×100%。
1.3 统计学方法
采用SPSS 12.0进行统计学处理。计量资料数据以均数±标准差(±s)表示,组间比较行单因素方差分析和均数多重比较。以P<0.05为差异具有统计学意义。
2 结果
2.1 DcR3特异性siRNA筛选与构建
本研究使用的pSUPER载体含H1Ⅲ型聚合酶启动子,能精确高效地转录出发夹状RNA,进而在体内被切割成可以发挥RNAi效应的siRNA[3]。
根据 GeneBank中的人 DcR3全序列(AF104419),利用siDESIGNR○Center,(http://www.dharmacon.com/DesignCenter/DesignCenterPage.aspx),设计 siRNA。其中 GGAACTACCTGGAGCGCTG(345~364)和ACGCGGAGTGGCAGAAACA(181~200)两段序列的积分最高,被选为本实验中的siRNA的靶序列,命名为 siRNA-1、siRNA-2。按pSUPER载体要求合成引物并联接入载体后,用EcoRⅠ和HindⅢ双酶切鉴定和DNA序列分析,序列与预期完全相符,证明克隆构建正确。将鉴定正确的重组质粒命名为pSUPER-hDcR3-1和pSUPER-h DcR3-2,无关序列重组质粒为pSUPER-Con(为pSUPER-hDcR3-1的错配序列)(图1)。

图1 EcoRⅠ和HindⅢ双酶切鉴定重组质粒DcR3 siRNA表达质粒Fig.1 EcoRⅠand HindⅢdouble enzyme identification of recombinant plasmid DcR3 siRNA expression plasmid
2.2 Dcr3 siRNA对SW480中DcR3 mRNA表达的抑制作用
将重组质粒pSUPER-hDcR3-1、pSUPER-hDcR3-2和pSUPER-Con瞬时转染入SW480细胞,36 h后提取细胞总RNA进行反转录,以β-actin作为内参照,检测DcR3的mRNA的表达变化,实验独立重复3次,每组样本例数为6。结果显示转染pSUPER-hDcR3-1后,细胞DcR3 mRNA表达显著下降(P<0.01);转染pSUPER-hDcR3-2后,细胞DcR3 mRNA表达也有显著下降(P<0.01),说明针对DcR3的siRNA在真核细胞中表达后可以抑制DcR3的mRNA表达(图2,表3)。
表3 siRNA对SW480中DcR3 mRNA表达的抑制作用Tab.3 siRNA inhibition of DcR3 mRNA expression in SW480(±s,n=6)
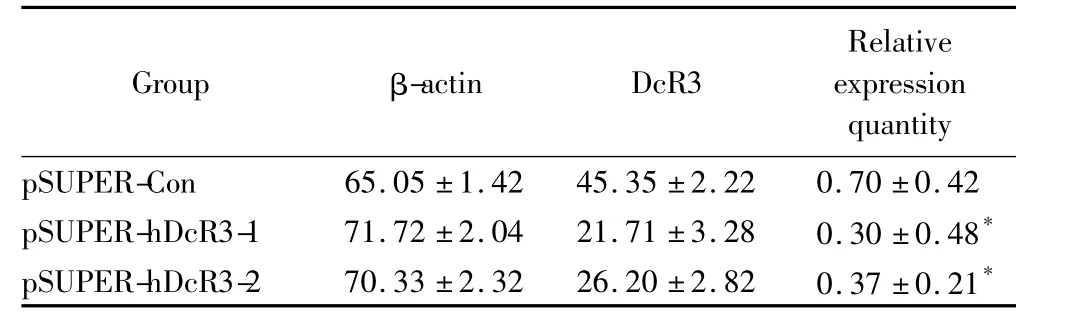
表3 siRNA对SW480中DcR3 mRNA表达的抑制作用Tab.3 siRNA inhibition of DcR3 mRNA expression in SW480(±s,n=6)
* P<0.01 vs pSUPER-Con group;DcR3:decoy receptor 3.
Group β-actin DcR3 Relative expression quantity pSUPER-Con 65.05±1.42 45.35±2.22 0.70±0.42 pSUPER-hDcR3-1 71.72±2.04 21.71±3.28 0.30±0.48*pSUPER-hDcR3-2 70.33±2.32 26.20±2.82 0.37±0.21*

图2 RT-PCR方法检测siRNA对SW480中DcR3 mRNA表达的作用Fig.2 Effects of RT-PCR on siRNA DcR3 mRNA expression in SW480
2.3 Dcr3 siRNA对SW480中DcR3的蛋白质表达的抑制作用
收 集 pSUPER-hDcR3-1、pSUPER-hDcR3-2和pSUPER-Con瞬时转染后48 h的SW480细胞,提取总蛋白,Bradford法进行蛋白定量,上样量为30g/孔,以GAPDH作为内参照,检测细胞中DcR3的表达,实验独立重复3次,每组样本例数为6。Western blotting结果显示,转染后pSUPER-hDcR3-1后细胞DcR3的蛋白质的表达显著下降(P<0.01);转染pSUPER-hDcR3-2后,细胞DcR3蛋白质的表达也有显著下调(P<0.01),表明针对DcR3的siRNA可以抑制DcR3的蛋白表达(图3,表4)。
2.4 Dcr3 siRNA对SW480细胞生长的影响
MTT试验结果显示,pSUPER-hDcR3-1组的吸光值为0.762±0.051(n=6),48 h细胞存活率为51%;pSUPER-hDcR3-2组的吸光值为0.737±0.048(n=6),48 h细胞存活率为48%,与pSUPER-Con组的吸光值为0.842±0.061(n=6),48 h细胞存活率79%相比差异有统计学意义(P<0.01)。
表4 siRNA对SW480中DcR3蛋白质表达的抑制作用Tab.4 Inhibitory effect of siRNA on protein expression of DcR3 in SW480(±s,n=6)

表4 siRNA对SW480中DcR3蛋白质表达的抑制作用Tab.4 Inhibitory effect of siRNA on protein expression of DcR3 in SW480(±s,n=6)
* P<0.01 vs pSUPER-Con group;DcR3:decoy receptor 3.
Group GAPDH DcR3 Relative expression quantity pSUPER-Con 147.12±5.27 59.64±3.77 0.41±0.04 pSUPER-hDcR3-1 140.28±3.38 17.87±2.86 0.13±0.02*pSUPER-hDcR3-2 149.70±6.21 24.02±1.29 0.16±0.03*
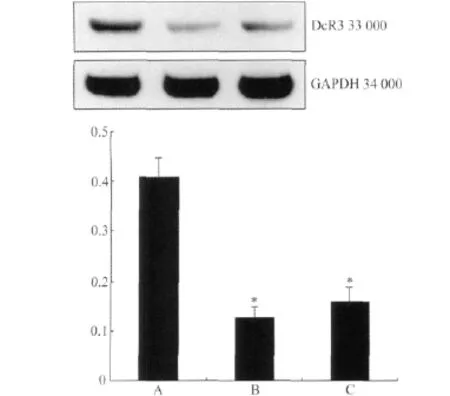
图3 Western blotting检测SW480中DcR3的表达Fig.3 Western blotting method for detection DcR3 expression in SW480
3 讨论
TNFR超家族新成员DcR3与TNFR基因超家族成员有同源性的EST,从人胚胎肺中分离出一条新的全长 cDNA,DcR3 mRNA全长1.2 kb,加工成熟的DcR3蛋白由271个氨基酸组成,其相对分子质量约35 000[4]。
研究[5-6]表明,DcR3表达于某些人类正常组织包括脑、肝、肺及成人脾、胃肠道和脐带静脉内皮细胞中,在肺癌、胃肠道肿瘤、脑恶性胶质瘤、胰腺癌和肝癌等恶性肿瘤组织中都有不同程度的高度表达。DcR3通过和肿瘤坏死因子超家族成员配体LIGHT、Fas/FasL和 TL1A竞争性结合,从而抑制 LIGHT、FasL、TL1A介导的细胞凋亡、T细胞增生等,并呈剂量依赖性,使肿瘤细胞逃逸肌体免疫系统的清除及细胞凋亡,促进了肿瘤的发生和发展,与某些肿瘤的发病有关。并且,DcR3还通过阻断TL1A的作用而诱导肿瘤血管形成,促进肿瘤的发生[7]。因此,DcR3在抗凋亡和免疫调节中的独特作用以及在许多人类恶性肿瘤中的高度表达决定了其与恶性肿瘤的发生、发展及预后密切相关。
鉴于DcR3在结肠癌细胞中高表达,本课题组构建了表达DcR3 siRNA的重组质粒pSUPER-hDcR3,以细胞转染技术将包含特异性DcR3 siRNA的质粒成功转染人结肠癌细胞系SW480后,通过阻断与其特异性互补的mRNA表达,阻止其翻译成蛋白质,用RTPCR、Western blotting实验证实结肠癌细胞DcR3的分泌量明显减少,MTT实验结果显示siRNA各组对细胞增生有不同程度的抑制效,说明本文所构建pSUPER-hDcR3重组质粒在结肠癌细胞中能与DcR3的mRNA特异性结合,从而使其翻译程序停止。siRNA可作为一种调控特定基因表达的手段,并且可按剂量来调节特定基因的表达或功能,具有安全性高、特异性强、作用确切的特点。尽管目前存在siRNA专一性转移、在体内进入靶细胞前降解等诸多问题尚不能完全解决,但具有强效抑制作用的siRNA可解除DcR3对FasL、LIGHT及TL1A三大调节系统的抑制,从而使机体正常发挥清除肿瘤细胞及活化免疫细胞的功能,对肿瘤基因治疗仍具有很大价值。有研究[8-9]证实通过封闭DcR3的基因表达可能使肿瘤细胞趋向凋亡。抑制后生物学效应对于siRNA来说,意义更为显著,本研究为进一步探讨封闭DcR3基因表达可否使肿瘤细胞凋亡而起到治疗肿瘤的作用、是否与抗癌药物具有协同作用奠定了实验基础。
总之,应用DcR3的特异性SiRNA抑制DcR3基因表达,通过测定DCR3的mRNA及蛋白表达量,为进一步深入了解DcR3在体内作用的相关机制,以及对肿瘤患者病情进展的检测、复发转移及预后的估计提供体外实验基础,并对开发相关生物制剂逆转肿瘤细胞对肌体免疫的逃避,开辟肿瘤预防与治疗的新领域,具有重要理论和实际意义。
[1]Pitti R M,Marsters S A,Lawrence D A,et al.Genomic amplification of adecoy receptor for Fas ligand in lung and colon cancer[J].Nature,1998,396(6712):699-703.
[2]Chang Y H,Hsieh S L,Chao Y,et al.Proinflammatory effects of LIGHT through HVEM and LTβR interactions in cultured human umbilical vein endothelial cells[J].J Biomed Sci,2005,12(2):363-375.
[3]Brummelkamp T R,Bernards R,Agami R.A system for stable expression of short interfering RNAs in mammalian cells[J].Science,2002,296(5567):550-553.
[4]Yu K Y,Kwon B,Ni J,et al.A newly identified member of tumor necrosis factor receptor superfamily(TR6)suppresses LIGHT-mediated apoptosis[J].J Biol Chem,1999,274(20):13733-13436.
[5]Shi G,Mao J,Zhang J,et al.Tumor vaccine based on cell surface expression of DcR3/TR6[J].J Immunol,2005,174(8):4727-4735.
[6]Zhou J,Song S D,Li D C,et al.Clinical significance of expression and amplification of the DcR3 gene in pancreatic carcinomas[J].Asian Pac J Cancer Prev,2012,13(2):719-724.
[7]Yang C R,Hsieh S L,Teng C M,et al.Soluble decoy receptor 3 induces angiogenesis by neutralization of TL1A,a cytokine belonging to tumor necrosis factor superfamily and exhibiting angiostatic action[J].Cancer Res,2004,64(3):1122-1129.
[8]Ohshima K,Haraoka S,Sugihara M,et al.Amplification and expression of a decoy receptor for Fas ligand in virus(EBV or HTLV2Ⅰ)associated lymphomas[J].Cancer Lett,2000,160(1):89-97.
[9]Fedorov Y,Anderson E M,Birmingham A,et al.Off-target effects by siRNA can induce toxic phenotype[J].RNA,2006,12(7):1188-1196.