中国人群中VEGF基因启动子区-460T/C与-634G/C单倍型与结肠癌的易感性研究
2012-09-05孙秀静朱圣韬
张 莹 孙秀静 朱圣韬
(1.首都医科大学附属北京天坛医院消化内科,北京100050;2.首都医科大学附属北京友谊医院消化内科,北京100050)
血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)基因定位于人染色体6p21.3,其编码的蛋白由2条类似的肽链组成的糖蛋白二聚体所构成。目前对肿瘤的研究[1]表明,VEGF能够特异性地刺激血管内皮细胞增生、促进其迁移,并参与新生血管的形成,也是目前已知的最强血管生成因子和内皮细胞选择性促有丝分裂因子,因而被认为是与恶性肿瘤新生血管形成、促进肿瘤细胞增生联系最紧密的一个细胞因子。当前在对于恶性肿瘤的研究中,肺癌、宫颈癌、胃癌、以及肾细胞癌等的发生风险与VEGF的基因多态性密切相关[2-5],但截止到目前,尚未有研究涉及VEGF基因多态性、尤其是单倍型与结肠癌易感性关联报道。在以往基因功能表达的实验研究[6]中,已证实VEGF基因中存在若干个多态性位点,其中一些多态性位点的改变能够调节或者改变VEGF基因的蛋白表达。本研究采用病例-对照研究方法,运用PCR-RFLP技术检测VEGF基因启动子区多态性并构建其单倍型,拟探讨VEGF基因启动子区域-460(NCBI dbSNP rs833061)与-634(NCBI db-SNP rs2010963)多态性位点的单倍型在中国汉族人群中的分布,以及VEGF基因单倍型对结肠癌发生风险的易感关联。
1 材料与方法
1.1 病例与对照的选择
病例组选自2007年3月至2011年3月在首都医科大学附属北京天坛医院和附属北京友谊医院消化内科保存的临床病例资料中完整的结肠癌患者的血液样本共182例,其中男98例,女84例,平均年龄(55.13±10.26)岁。病例中腺癌125例,黏液癌38例、未分化癌19例;根据病理学诊断以及患者相应的辅助检查确定病例组结肠癌患者的TNM分期,其中Ⅰ-Ⅱ期患者 97 例(47/182,53.30%),Ⅲ-Ⅳ患者例85(85/182,46.70%);远处转移患者(M1)总计51例(51/182,28.02%)。入选标准:所有患者在血液标本采集前均未有输全血或其他成分输血记录,每例患者均经术后或内镜下组织病理学确诊;剔除标准:患者合并有第二原发恶性肿瘤或其他自身免疫系统疾病。对照组选自首都医科大学附属北京天坛医院和附属北京友谊医院体检中心的健康人群血液样本,年龄与性别等均和病例组相匹配;对照组中男117例,女99例,平均年龄(56.91±8.54)岁,共216例。两组人群中个体之间均无血缘关系,均系中国汉族人群。
1.2 基因组DNA抽提
每位研究个体均采集用乙二胺四乙酸(EDTA)抗凝的静脉全血2 mL,在蛋白酶K消化之后采用苯酚/氯仿提取全血基因组DNA,总计提取结肠癌患者、健康正常人外周血DNA 398例,提取的基因组DNA溶解于TE中,并保存于-80℃冰箱。
1.3 多态性位点的选择及引物设计
在Gene Bank中检索到VEGF基因的全长序列(GenBank Accession number:AF 095785.1),并参考国外有关文献[7]进行引物的设计与合成,本研究引物由上海申友生物技术有限公司合成。-460T/C位点:forward-CCTCTTTAGCCAGAGCCGGGG,Reverse-TGGCCTTCTCCCCGCTCCAAC;-634G/C位点:forward-TTGCTTGCCATTCCCCACTTG,Reverse-CCGAAGCGAG AACAGCCCAGAA。
1.4 PCR反应体系及反应条件
PCR扩增体系及程序如下:ddH2O 40.5 μL,10×PCR 缓冲液(含 1.5 mmol/L Mg2+)5 μL,10 mmol/L dNTP 1 μL,Taq 酶 5 U(Promega Company,USA),上、下游引物各 1 μL(20 μmol/L),DNA 模板 1 μL(500 ng)。扩增采用程序:94℃预变性2 min后,94℃变性40 s,退火40 s,退火温度分别为60.0℃(-460T/C)、54.5 ℃(-634G/C),之后72 ℃延伸40 s,共35个循环,最后在72℃条件下延伸10 min(PE Biosystems,USA)。PCR产物的纯化采用Millipore公司的Multiscreen-PCR纯化板进行纯化(Millipore Company,USA)。
1.5 RFLP方法检测-460T/C与-634G/C位点基因型
PCR产物经纯化后,分别采用限制性内切酶Bsa-HI和 BsmFI(New England Biolabs Beverly,Ma,USA)对-460T/C、-634G/C这两个位点进行酶切基因分型。每个反应体系为20 μL,其中 DNA 约1 μg、内切酶5 U、加各自内切酶相应的10×Buffer 2 μL、最后加ddH2O至20 μL;根据NEB公司操作手册BsaHI内切酶水浴温度为37℃、BsmFI内切酶水浴温度为65℃,水浴时间均为12 h过夜。酶切结束后立即进行琼脂糖电泳并进行EB染色,在凝胶成像系统内判断每一个体-460T/C与-634G/C位点的基因型(Agarose-1000;Gibco BRL,USA,使用浓度为 2%)。
1.6 -460T/C与-634G/C多态性位点的单倍型构建
基于-460T/C与-634G/C两个多态性位点均位于VEGF基因启动子区域,并且相互毗邻,故对两个多态性位点在398个体中的基因型,采用以Bayes-ian algorithm(贝叶斯算法)为基础的 PHASE软件(PHASE 1.0)进行逐个个体单倍体的构建[8]。
1.7 统计学方法
使用统计学分析软件SPSS 13.0(SPSS 13.0 for Windows,Chicago,IL),利用 Chi-square Test验证基因型频率是否符合Hardy-Weinberg平衡定律,并检验两组之间性别、吸烟、饮酒、肿瘤家族史、等位基因位点等的分布差异;利用Mann Whitney-U检验比较两组人群之间年龄分布的差异;以OR值(odds ratio)及其95%CI(confidence intervals)甄别多态性、单倍型与结肠癌风险之间的相关性;选择非条件Logistic回归模型统计分析OR值及95%CI,其结果均经年龄、性别、吸烟、饮酒、肿瘤家族史等混杂因素校正后取得;所有的统计检验均为双侧概率检验,以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料的统计学检验
统计分析结果表明两组人群之间显示良好的匹配性,Mann Whitney-U方法比较两组之间年龄分布的差异(P=0.086),差异无统计学意义;在病例与对照组的统计分析中,Chi-square Test检验结果显示性别、吸烟、饮酒等差异均无统计学意义(P>0.05);而在肿瘤家族史的对比结果提示,结肠癌患者中其家族肿瘤史显著高于正常对照组(P=0.001)(表1),两组比较有统计学意义。

表1 病例与对照组的一般资料Tab.1 Characteristics of the colorectal cancer patients and normal controls n(%)
2.2 -460T/C与-634G/C位点多态性与结肠癌的关联分析
182例结肠癌患者与216例健康对照人群中,两个多态性位点经PCR-RFLP检测后结果显示VEGF基因-460T/C与-634G/C位点的多态性在我们检测的样本中均存在;同时分别进行两个多态性位点各自的3种基因型数据读取与统计(图1),等位基因的频率分布均符合Hardy-Weinberg平衡定律(P>0.05)。
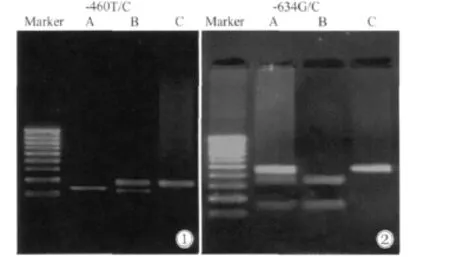
图1 VEGF基因启动子区域-460与-634多态性位点凝胶成像图Fig.1 Product of the VEGF-460 and VEGF-634 polymorphisms in the promoter region of the VEGF gene shown on agarose electrophoresis
VEGF基因中-460T/C多态性位点在检测的结肠癌患者与对照人群中,等位基因频率差异有统计学意义〔P=0.002,OR=1.67(95%CI:1.33-4.72)〕;杂合型T/C较之野生纯合型T/T在两组人群中的频率分布差异具有统计学意义〔P=0.021,OR=1.61(95%CI:2.39-9.75)〕;多态纯合型C/C较之野生纯合型T/T在两组人群中的频率分布也同样具有统计学意义〔P=0.001,OR=3.12(95%CI:5.82-11.74)〕。-634G/C位点多态性在正常人群与结肠癌患者之间等位基因频率差异无统计学意义(P=0.103);-634G/C多态性位点基因型频率在两组人群间差异也无统计学意义:杂合型(G/C P=0.082),多态纯合型(C/C P=0.051),详见表2。
2.3 -460T/C与-634G/C多态性位点单倍型频率统计分析
-460T/C与-634G/C多态性位点在VEGF基因启动子区域内相互毗邻,针对病例与对照组中-460T/C与-634G/C基因多态性位点的基因型,本课题组利用PHASE1.0软件进行每个个体单倍体的构建[8],结果共有4种单倍体组合:A=T-G、B=T-C、C=C-G、D=C-C(表3);并对每个个体(总398例)逐一进行了--/-- 、--/Haplotype、Haplotype/Haplotype 3种单倍型的统计,由于Haplotype/Haplotype纯合单倍型出现的频率相对较低,本课题组进行统计分析时将--/Haplotype、Haplotype/Haplotype合并。结果表明:前3种单倍型T-G、T-C、C-G在结肠癌患者与对照组人群之间均无统计学意义(分别为P=0.086,P=0.194,P=0.201);而单倍型C-C在结肠癌组与对照组人群之间的差异有统计学意义〔P<0.001,OR=4.28(95%CI:2.77-13.41)(表3)〕。
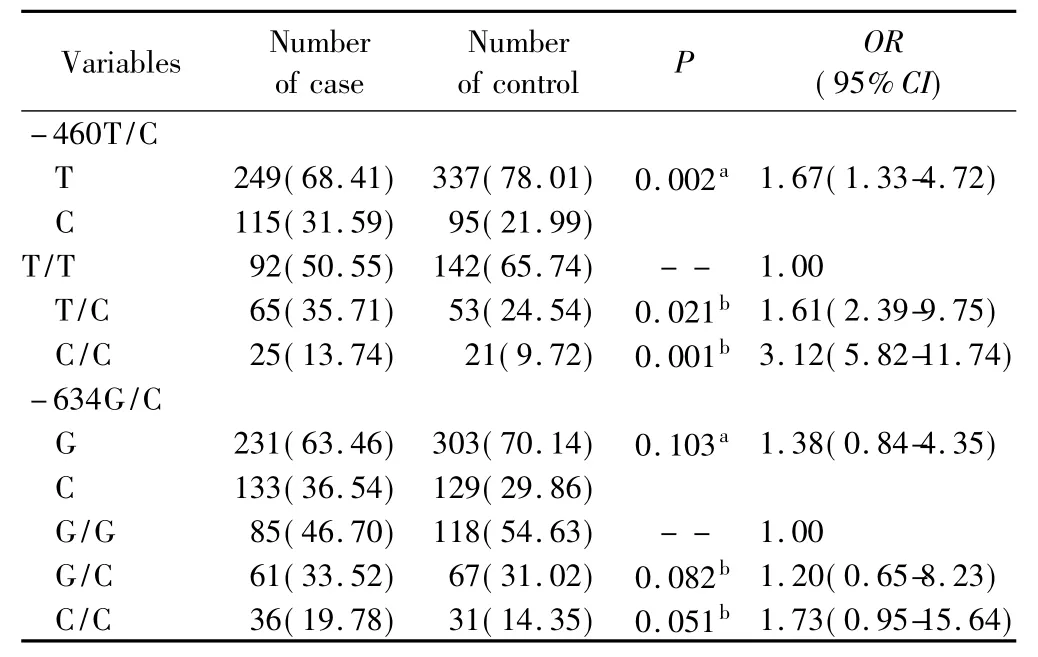
表2 VEGF基因启动子区多态性与结肠癌的关联分析Tab.2 The associated analysis between the colorectal cancer and VEGF gene promoter polymorphismsn(%)
3 讨论
Ferrara于1989年从牛垂体滤泡星状细胞体外培养液中分离纯化的血管内皮生长因子(VEGF),又称血管通透因子,是具有促血管内皮细胞有丝分裂活性的糖基化多肽分泌因子。在恶性肿瘤的生长过程中,其通过受体的作用促细胞增生作用体现于2个方面:一方面促进微血管内皮细胞增生、分化、迁延,而从另一方面则能够促使微血管形成与通透性增加,最终促进恶性肿瘤细胞的生长与远处迁移[9-10]。在VEGF促有丝分裂活性的分子机制中,2种高亲和力酪氨酸激酶受体发挥着重要的生物学效应,这2种受体即含激酶插入区受体(KDRPflk-1,VEGFR-2)和FMS-样酪氨酸激酶-1(FLT-1,VEGFR-1),两者均为跨膜蛋白,与配体结合后形成二聚体,引发一系列的连锁生化反应[12-13]。

表3 VEGF基因启动子区-460T/C与-634G/C构建的单倍型与结肠癌的关联分析Tab.3 Association analyses of the colorectal cancer and the haplotypes constituted by the-460T/C and-634G/C polymorphisms of VEGF gene promoter n(%)
结肠癌的发生发展不仅具有家族聚集性和明显的个体差异,并且也是多因素、多基因变异累积的癌变过程。近期的一系列相关研究[14-15]认为,在结肠癌的遗传易感性方面,VEGF在血浆的表达水平高低是影响结肠癌易感性的重要环节,而VEGF基因的多态性的改变,将导致相应的VEGF血浆水平表达水平或活性改变,从而引起对结肠癌易感性的个体化差异。
参与调节VEGF表达合成的因素较多,近年来的研究表明,VEGF基因多态性与其活性密切相关,Stevens A等[16]认为携带有-460/+405多态性能够显著改变VEGF基因启动子的活性和反应性,这种多态性的改变将导致启动子活性较野生型提高了71%。我们此次研究发现:在182例结肠癌患者与216例对照的人群中,VEGF基因启动子区域-460T/C与-634G/C位点多态性在中国汉族人群中不仅普遍的存在,而且-460T/C多态性位点等位基因频率在两组人群中差异有统计学意义(P=0.002),其杂合型T/C及多态纯合型C/C较之野生纯合型T/T在两组人群中的频率分布差异也具有统计学意义(P<0.05);但-634G/C多态性位点在两组人群之间差异没有统计学意义(P>0.05)。在研究疾病的遗传易感因素当中,对于疾病的发生与发展每一个SNP的存在并不只是起到一个孤立的作用,多个SNP之间存在着一定的内在关联与相互作用,单倍型则能够更好地体现这种遗传关联,因此对于揭示多个SNPs与疾病的易感关联,单倍型的研究是一种较好的手段[17]。由于VEGF基因启动子区域-460T/C与-634G/C多态性位点相互毗邻,我们进一步进行了VEGF基因单倍型与结肠癌的关联分析。研究结果显示,两个多态性位点共构建4种单倍体,其中-460位点C与-634位点C所组成的单倍型C-C在两组人群中差异具有统计学意义(P<0.001),表明具有单倍体C-C个体(与其他单倍体杂合或者本身纯合存在时)较之不含该单倍体的个体对于结肠癌的发生,能够增加其4.28倍的罹患风险。
综上所述,VEGF基因启动子区 -460T/C与-634G/C多态性位点所构成的单倍型能够影响着结肠癌的发生,成为结肠癌的易感风险因素;但关于该两个位点的多态性以及单倍型如何调控VEGF的血浆水平表达状况、以及如何参与结肠癌的发生和发展的机制仍需进一步研究探讨。
[1]Nagai Y,Ando H,Nohara E,et al.Plasma levels of vascular endothelial growth factor in patients with acromegaly[J].Horm Metab Res,2000,32(8):326-329.
[2]Dong J,Dai J,Shu Y,et al.Polymorphisms in EGFR and VEGF contribute to non-small-cell lung cancer survival in a Chinese population[J].Carcinogenesis,2010,31(6):1080-1086.
[3]Zhou Y,Li N,Zhuang W,et al.Vascular endothelial growth factor(VEGF)gene polymorphisms and gastric cancer risk in a Chinese Han population[J].Mol Carcinog,2011,50(3):184-188.
[4]Kim Y H,Kim M A,Park I A,et al.VEGF polymorphisms in early cervical cancer susceptibility,angiogenesis,and survival[J].Gynecol Oncol,2010,119(2):232-236.
[5]Bruyère F,Hovens C M,Marson M N,et al.VEGF polymorphisms are associated with an increasing risk of developing renal cell carcinoma[J].J Urol,2010,184(4):1273-1278.
[6]刘刚,李金源.血管内皮生长因子与肿瘤生长的关系[J].军医进修学院学报,2010,31(1):93-94.
[7]Lin C C,Wu H C,Tsai F J,et al.Vascular endothelial growth factor gene-460 C/T polymorphism is a biomarker for prostate cancer[J].Urology,2003,62(2):374-377.
[8]Stephens M,Donnelly P.A comparison of bayesian methods for haplotype reconstruction from population genotype data[J].Am J Hum Genet,2003,73(5):1162-1169.
[9]Li M,Chen H,Diao L,et al.Caveolin-1 and VEGF-C promote lymph node metastasis in the absence of intratumoral lymphangiogenesis in non-small cell lung cancer[J].Tumori,2010,96(5):734-743.
[10]马俊伟,常楚,战杰,等.血管内皮细胞生长因子165在诱导骨髓间光质干细胞内皮化中的作用[J].中国医科大学学报,2010,39(10):812-814.
[11]范仲凯,谷艳婷,曹阳,等.VEGF121转染时对诱导后血管内皮细胞增殖的影响[J].中国医科大学学报,2010,39(8):628-631.
[12]Salva E,Akbuga J.In vitro silencing effect of chitosan nanoplexes containing siRNA expressing vector targeting VEGF in breast cancer cell lines[J].Pharmazie,2010,65(12):896-902.
[13]Oommen S,Gupta S K,Vlahakis N E.Vascular endothelial growth factor A(VEGF-A)induces endothelial and cancer cell migration through direct binding to integrin{alpha}9{beta}1:identification of a specific{alpha}9{beta}1 binding site[J].J Biol Chem,2011,286(2):1083-1092.
[14]史继敏,范卫,叶宣光,等.大肠癌组织c-met与VEGF的表达及意义[J].肿瘤学杂志,2010,16(2):90-92.
[15]Horton J K,Watson M,Stefanick D F,et al.VEGF and DNA polymerase beta in cellular protection against cytotoxic DNA single-strand breaks[J].Cell Res,2008,18(1):48-63.
[16]Stevens A,Soden J,Brenchley P E,et al.Haplotype analysis of the polymorphic human vascular endothelial growth factor gene promoter[J].Cancer Res,2003,63(4):812-816.
[17]Salisbury B A,Pungliya M,Choi J Y,et al.SNP and haplotype variation in the human genome[J].Mutat Res,2003,526(1-2):53-61.