每搏输出量变异度在液体复苏治疗中的指导价值
2012-09-04陈阵刘亚凤胡念丹苏薇薇李文强
陈阵,刘亚凤,胡念丹,苏薇薇,李文强
(武汉大学人民医院急诊科,湖北武汉430060)
每搏输出量变异度在液体复苏治疗中的指导价值
陈阵,刘亚凤,胡念丹,苏薇薇,李文强*
(武汉大学人民医院急诊科,湖北武汉430060)
早期液体复苏在脓毒症休克治疗中占据重要的地位,因而治疗中监测血流动力学和容量的变化极为重要。每搏输出量变异度比传统监测指标能更精准指导快速液体复苏,维持最佳前负荷,改善容量管理,防止由于低血容量导致的低灌注和过度复苏,并进一步干预多器官功能障碍的发生。本文将从每搏输出量变异的特点、机理、研究进展、局限性等方面进行综述。
液体复苏;脓毒症休克;每搏输出量变异度
虽然近年来对于脓毒症休克(Sepsis shock)的研究取得了长足进展,但该病的死亡率仍高达30%~70%[1]。脓毒症休克起势凶猛,进展迅速,如不及时救治,往往预后极差,给急诊工作带来极大困难。因此,早期预测脓毒症的发生发展,从而有效地实施干预措施,是降低脓毒症发病及其病死率的关键。
近年来对脓毒症休克患者进行早期液体复苏从而恢复有效循环血容量已得到广泛重视[2]。其主要目的在于保持血管内有效容积、增加心脏前负荷、增加心排量,从而恢复有效的循环灌注。2008年《拯救脓毒症休克指南》的提出确立了早期液体复苏治疗的重要地位,目的是通过快速扩容,增加心排量和输送氧能力。尽可能于6 h内恢复患者的血管内容量,改善血流动力学状态、逆转器官功能损害,以便及早纠正血流动力学异常和全身性组织缺氧,防止发生更严重的炎症反应和急性心血管功能衰竭,以期降低病死率[3]。
1 通过监测容量及血流动力学变化的指标来指导液体复苏治疗
1.1 监测容量及血流动力学的重要意义早期液体复苏虽然是治疗脓毒症休克的重要干预措施,但并不意味着可以盲目补液,否则将加重心肺负荷,极易引发心力衰竭、肺水肿[4]。这一现象可以通过Frank-Starling机制解释:当心功能位于该曲线的上升阶段时,通过补充液体增加心脏的前负荷,从而增加心输出量;但是当心功能位于该曲线的平台阶段时,补充液体无法进一步增加心输出量,反而可导致心脏负荷过重。因此在液体复苏治疗中,机体对液体的反应性应当得到足够的重视,该反应性受心脏前负荷、心功能状况影响,是一种动态、功能性的血流动力学变化,故早期进行容量和血流动力学监测极为重要。
1.2 各种传统监测指标的缺陷寻求能够精准反映容量及血流动力学变化的监测指标是目前液体复苏治疗研究的主要方向。近年来先后采用过多种监测指标:曾采取监测患者的心率、血压,因不能客观反映血容量等指标而遭到淘汰[5];后采取监测中心静脉压、肺动脉楔压等指标评估患者的前负荷及容量状态,但该指标易受到血管充盈、血管顺应性、心脏收缩力、胸腔内压力等多种因素的影响,灵敏度和特异性均不尽人意[6],对治疗的指导作用有限;而经肺动脉导管测定容量指标虽敏感性较高,但该手段的创伤性较大,给患者增加较大经济负担,且极易引发严重室性心律失常、肺动脉栓塞等并发症[7],限制了其临床应用。
2 每搏输出量变异度的优势和原理
2.1 每搏输出量相比传统指标的优势鉴于上述诸多监测指标的种种缺陷,近年来基于动脉轮廓法技术(Pulse indicator continuous cardiac output,PICCO)测定每搏输出量变异度(Stroke volume variation,SVV)成为判断机体对液体复苏治疗反应性的新兴指标。监测SVV时,从中心静脉穿刺置管注射冷盐水,于股动脉穿刺置管监测温度变化,绘制热稀释曲线,通过分析曲线下面积而获得即时心输出量,实现由动脉脉搏获得心输出量的连续监测[8-9]。与传统测定指标相比,SVV具有以下优点:①操作简便,无需专门培训,容易上手,且对患者造成的经济负担较小;②创伤性小,可显著减轻对肺血管的创伤,避免了肺动脉导管置入时的并发症[10];③相比传统指标更加准确、及时,可实时动态反应容量及血流动力学参数的变化,顺应了医学发展的需求[11]。
2.2每搏输出量变异度的机理SVV是在机械通气期间,最高的每搏输出量(SVmax)与最低的每搏输出量(SVmin)的差值与每搏输出量平均值(SVmean)的比值,其计算公式为SVV=(SVmax-SVmin)/SVmean×100%[12]。机械通气时,吸气致胸腔内压升高,主动脉、肺动脉血流增加,静脉回心血量减少,右室后负荷升高,在吸气末达最低值;胸腔内压力增高对肺静脉的挤压作用致使左室回心血量增加,左室每搏输出量增加。而呼气时,上述过程恰好相反[13]。根据Frank-Starling原理,低血容量时,左心前负荷较低,Frank-Starling曲线处于上升阶段,左心前负荷变化的波动对于每博量的变化较大,容量负荷和心肌初长度未达到最佳结合度之前,心肌的收缩力、做功能力与前负荷增加呈正相关,心肌通过调控初长度去适应回心血量的变化,从而达到动态平衡。而高容状态下,当心肌初长度超过最佳长度或心室充盈压超过最佳容量负荷时,心室搏出量和收缩功能不再随前负荷的增加而增加。如图1所示:Frank-Starling曲线处于平台阶段,左心前负荷变化的波动对于每搏量的变化较小,SVV值较小。所以SVV升高时提示有效循环容量不足,即SVV与有效血容量呈负相关[14]。由此可根据SVV来判断心功能处于Frank-Starling曲线的哪个阶段,从而精准预测机体对液体复苏的反应性[15]。因此,持续监测SVV可早期干预液体复苏治疗的效果,维持最佳前负荷,防止由于有效循环血量不足导致的低灌注,以维持循环稳定和组织氧供,是一种简便、有效的实时监测手段。
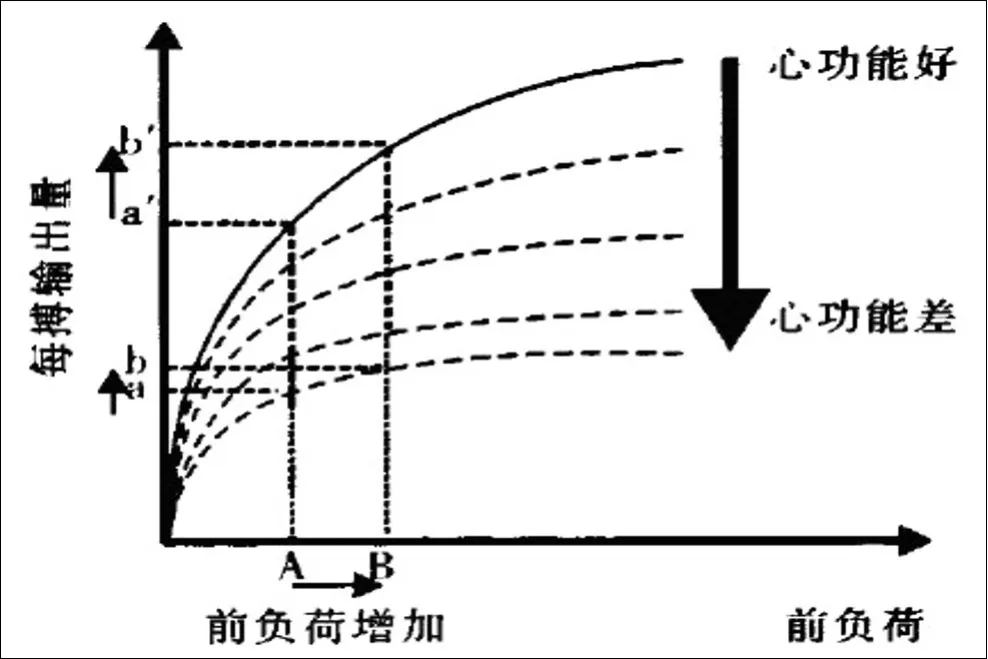
图1 Frank-Starling曲线
3 每搏输出量变异度的研究进展
SVV已被证实是一个判断脓毒症患者血管容积和液体反应性的有效指标[16]。Hofer等[17]证实:当SVV>9.5%时,每增加100 ml补液量可使每搏量增加5%,其敏感度为79%、特异度为93%。Loupec等[18]报道,SVV可以准确的预测机械通气下心功能不全:10%的临界值就可以区分是否对前负荷增加有反应性,且特异性达到95%、敏感性达到100%。Reuter等[19]亦报道:SVV可很好地预测心功能不全时液体复苏治疗的反应性,射血分数低于35%的患者,SVV≥9.5%,预测的敏感度为71%,特异度为80%。近来达成共识的研究结果是,以SVV≥10%表示机体容量不足的分水岭,超过此限需立即进行适量的液体复苏治疗[20]。
4 每搏输出量变异度的使用局限
4.1 潮气量对每搏输出量变异度的影响机械通气时,SVV受到肺容量变化、胸腔内压力变化的影响,因此SVV与潮气量息息相关。有研究显示[21]:潮气量≤5 ml/kg或≥15 ml/kg时,SVV均未精准的反应前负荷的变化。Maguire等[22]的实验也表明,潮气量过高或过低都会造成SVV的准确性下降。因此,现今研究一致认定[23],当人体潮气量设为8~10 ml/kg时,对SVV评估液体复苏效果的干扰性最小。
4.2 通气模式对每搏输出量变异度影响Heenen等[24]研究结果显示,SVV虽能评估容量控制模式下对液体复苏治疗的反应性,但在压力支持通气或面罩吸氧患者对液体治疗的反应性方面则稍显不足。因为压力支持通气引起的胸腔压力变化不足以使前负荷产生变化,且压力支持通气时,呼吸周期和潮气量等参数均非固定,这些因素导致了该评估的不稳定性。因此,在临床监测中不推荐在压力支持通气模式下使用SVV指导液体复苏治疗。
4.3 气道压力对每搏输出量变异度影响Breukers等[25]通过临床试验证实,PEEP在10 cmH2O(1 cmH2O=0.098 kPa)时VV与PEEP呈正相关,超出此限度后,每搏输出量的变化将异常敏感,影响到SVV对液体复苏疗效的评估。其原因为高PEEP使吸气相右心室充盈致射血减少,呼气相时左心室前负荷降低,降低了左心室每搏输出量。因此高PEEP状态极易导致对容量状态的错误评估,故建议将PEEP值尽可能控制在10 cmH2O以内[26]。
4.4 心率失常对每搏输出量变异度的影响脓毒症休克合并有房颤、室上速、频发室早等心律失常的患者不适宜使用SVV监测[27],因为心律失常本身使心搏量的变异程度增大,由此SVV也相应大大增加。近年来虽开发出针对频发室早的SVV软件,并在动物实验上得到应用,但房颤依然是悬而未决的难题[28]。
5 小结
SVV作为一种新型监测指标,对预测液体复苏的效果无疑具有良好的指导意义和广阔的应用前景。但液体复苏治疗的最终目标是维持循环的稳定及组织的氧供,因此评价液体复苏成功与否的最终标志并非这一单独的指标变化,而是患者的整体转归情况。因此还需要结合病史、体征、辅助检查及其他血流动力学参数做出综合判断,由此才能最大程度上体现出SVV在液体复苏中的指导价值。
[1]Shapiro NI,Howell M,Talmor D.A blueprint for a sepsis protocol [J].Acad Emerg Med,2005,12(4):352-359.
[2]Zandstra DF,van der Voort PH.Surviving sepsis campaign guidelines for management of severe sepsis arid septic shock[J].Crit Care Med,2004,32(3):858-873.
[3]Dellinger RP,Levy MM,Cadet JM,et a1.Surviving Sepsis Campaign:international guidelines for management of severe sepsis and septic shock:2008[J].Crit Care Med,2008,36(1):296-327.
[4]Broch O,Renner J,Gruenewald M,et al.Variation of left ventricular outflow tract velocity and global end-diastolic volume index reliably predict fluid responsiveness in cardiac surgery patients[J].Crit Care,2011,32(6):256-263.
[5]Feng ZY,Xu X,Zhu SM,et al.Effects of low central venous pressure during preanhepatic phase on blood loss and liver and renal function in liver transplantation[J].World J Surg,2010,34(8):1864-1873.
[6]Marik PE,Baran M,Vallid B.Does central venous pressure predict fluid responsiveness?[J].Chest,2008,134(1):172-178.
[7]Chakravarthy M,Patil TA,Jayaprakash K,et al.Comparison of simultaneous estimation of cardiac output by four techniques in patients undergoing off-pump coronary artery bypass surgery--a prospective observational study[J].Ann Card Anaesth,2007,10(2):121-126.
[8]Scheeren TW,Wiesenack C,Compton FD,et al.Performance of a minimally invasive cardiac output monitoring system(Flotrac/Vigileo)[J].Br JAnaesth,2008,101(2):279-280.
[9]Mehta Y,Chand RK,Sawhney R,et al.Cardiac output monitoring:comparison of a new arterial pressure waveform analysis to the bolus thermodilution technique in patients undergoing off-pump coronary artery bypass surgery[J].J Cardiothorac Vasc Anesth,2008,22 (3):394-399.
[10]Cavallaro F,Sandroni C,Antonelli M.Functional hemodynamic monitoring and dynamic indices of fluid responsiveness[J].MinervaAnestesiol,2008,74(4):123-135.
[11]Monnet X,Teboul JL.Volume responsiveness[J].Crit Care,2007, 13:549-553.
[12]Mc Gee WT,Horswell JL,Calderon J,et al.Validation of a continuous,arterial pressure-based cardiac output measurement:a multicenter,prospective clinical trial[J].Crit Care,2007,11(5):105.
[13]Michard F.Stroke volume variation:from applied physiology to improved outcomes[J].Crit Care Med,2011,39(2):294-299.
[14]Suehiro K,Okutani R.Influence of tidal volume for stroke volume variation to predict fluid responsiveness in patients undergoing one-lung ventilation[J].JAnesth,2011,9(4):104-111.
[15]Zimmermann M,Feibicke T,Keyl C,et al.Accuracy of stroke volume variation compared with Pleth variability index to predict fluid responsiveness in mechanically ventilated patients undergoing major surgery[J].Eur JAnaesthesiol,2010,27(6):555-561.
[16]Cannesson M,Attof Y,Rosamel P,et al.Respiratory variations in pulse oximetry plethysmographic waveform amplitude to predict fluid responsiveness in the operating room[J].Anesthesiology, 2007,106(6):1105-1111.
[17]Hofer CK,Senn A,Weibel L,et al.Assessment of stroke volume variation for prediction of fluid responsiveness using the modified FloTrac and PiCCO plus system[J].Crit Care,2008,12(3):82.
[18]Loupec T,Nanadoumgar H,Frasca D,et al.Pleth variability index predicts fluid responsiveness in critically ill patients[J].Crit Care Med,2011,39(2):402-403.
[19]Reuter DA,Kirchner A,Felbinger TW,et al.Usefulness of left ventricular stroke volume variation to assess fluid responsiveness in patients with reduced cardiac function Volume[J].Crit Care Med, 2003,31(5):1399-1404.
[20]De Blasi RA,Palmisani S,Cigognetti L,et al.Effects of sternotomy on heart-lung interaction in patients undergoing cardiac surgery receiving pressure-controlled mechanical ventilation[J].Acta Anaesthesiol Scand,2007,51(4):441-446.
[21]Renner J,Cavus E,Meybohm P,et al.Stroke volume variation during hemorrhage and after fluid loading:impact of different tidal volumes[J].ActaAnaesthesiol Scand,2007,51(5):538-544.
[22]Maguire S,Rinehart J,Vakharia S,et al.Technical communication:Respiratory variation in pulse pressure and plethysmographic waveforms:Intraoperative applicability in a north american academic center[J].AnesthAnalg,2011,12(1):94-96.
[23]Sakka SG,Becher L,Kozieras J,et al.Effects of changes in blood pressure and airway pressures on parameters of fluid responsiveness [J].Eur JAnaesthesiol,2009,26(4):322-327.
[24]Heenen S,De Backer D,Vincent JL.How can the response to volume expansion in patients with spontaneous respiratory movements be predicted?[J].Crit Care,2006,10(4):102.
[25]Breukers RM,Willems JH,de Wilde R,et al.Less invasive indicators of changes in thermodilution cardiac output by ventilatory changes after cardiac surgery[J].Eur J Anaesthesiol,2009,26(10):863-867.
[26]Kubitz JC,Annecke T,Kemming GI,et al.The influence of positive end-expiratory pressure on stroke volume variation and central blood volume during open and closed chest conditions[J].Eur J Cardiothorac Surg,2006,30(1):90-95.
[27]Rex S,Brose S,Metzelder S,et al.Prediction of fluid responsiveness in patients during cardiac surgery[J].Br J Anaesth,2004,93 (6):782-788.
[28]Cannesson M,Cho M,Hatib F,et al.Predicting fluid responsiveness with stroke volume variation during cardiac arrhythmia[J].Anesthesiology,2010,113:642.
R45
A
1003—6350(2012)04—114—03
10.3969/j.issn.1003-6350.2012.04.052
2011-09-14)
陈阵(1982—),男,山东省青岛市人,医师,硕士。
*通讯作者:李文强。E-mail:wenqiang67@sohu.com
