清开灵注射液细菌内毒素检查法的建立
2012-09-03王欣放
王欣放

[摘要] 目的 建立清开灵注射液的细菌内毒素检查方法。 方法 采用《中华人民共和国药典》(2010年版)附录细菌内毒素检查法,考察清开灵注射液对细菌内毒素检查的干扰作用,确定其最大不干扰浓度。 结果 清开灵注射液稀释至60倍后可消除干扰作用,使用灵敏度为0.125 EU/mL的鲎试剂进行细菌内毒素检查,无干扰因素的影响。 结论 使用鲎试剂检查清开灵注射液的细菌内毒素是可行的,可以用细菌内毒素检查法取代热原检查法。
[关键词] 清开灵注射液;细菌内毒素检查;鲎试剂;干扰试验
[中图分类号] R285.1[文献标识码] B[文章编号] 1674-4721(2012)07(c)-0081-03
The establish of Bacterial Endotoxin test method for Qingkailing injection
WANGXinfang
The Food and Drug Safety Supervision of Chaoyang City in Liaoning Province, Chaoyang 122000, China
[Abstract] Objective To establish the bacterial endotoxin test method for Qingkailing injection. Methods The bacterial endotoxins test of appendix in China Pharmacopoeia (2010 version) was used to investigate the interference effect of Qingkailing injection in the bacterial endotoxin test method, and the maximum noninterference concentration was confirmed. Results The interference effect could be eliminated when Qingkailing injection was diluted 60 times. When the sensitive of tachypleus amebocyte lysate with 0.125 EU/mL to do the bacterial endotoxins test, the results were no interference. Conclusion It is feasible to check the bacterial enolotoxin in Qingkailing injection by using tachypleus amebocyte lysate, and the bacterial enolotoxin test method can replaced the pyrogen test method.
[Key words] Qingkailing injection; Bacterial endotoxin test; Tachypleus amebocyte lysate; Interference test
清開灵注射液是由中药复方制备而成的供静脉滴注的注射剂,具有清热解毒,化痰通络,醒神开窍之功效,已被广泛应用于多种不同临床适应症。该注射液现行标准《中华人民共和国药典》(2010年版)[1]1110规定的检查项是热原检查法,本文参考《中华人民共和国药典》(2010年版)附录“细菌内毒素检查法”等文献[1]附录88[2-4]进行试验,对清开灵注射液的细菌内毒素检查法的可行性进行探讨,为建立该品种的细菌内毒素检查法提供依据。现报道如下:
1 仪器与试剂
1.1 仪器
ZH-2型自动旋涡混合器(天津药典标准仪器厂);DR-HW-1电热恒温水浴箱(天津医疗器械厂);微量移液器50~250 μL,200~1 000 μL (上海精密仪器厂)。
1.2 试剂
鲎试剂(以下简称TAL)[批号1:1004026,灵敏度(λ):0.25 Eu/mL,0.1 mL/支;批号2:1012082,灵敏度(λ):0.125 Eu/mL,0.1 mL/支;批号3:1008125,灵敏度(λ):0.25 Eu/mL,0.1 mL/支;批号4:1010110,灵敏度(λ):0.125 Eu/mL,0.1 mL/支。其中,批号1、2由湛江安度斯生物有限公司生产,批号3、4由湛江博康海洋生物有限公司生产]。
细菌内毒素检查用水(以下简称BET水)(中国药品生物制品检定所,批号:201012,规格:10 mL/支)。
细菌内毒素工作标准品(以下简称CSE)(中国药品生物制品检定所,批号:150601-201174,160 Eu /支)。
清开灵注射液 (神威药业有限公司,批号:10050912、10081123、10042410,规格:2 mL/支;山西太行药业股份有限公司,批号:100527、100212、100610,规格:2 mL/支)。
2 方法与结果
2.1鲎试剂灵敏度(λ)的复核
按《中华人民共和国药典》(2010年版)的细菌内毒素检查法进行灵敏度复核和结果判断,用BET水将CSE按1→2等比稀释成系列浓度的细菌内毒素溶液,然后与鲎试剂混合置于37 ℃恒温水浴60 min。4批鲎试剂λc(鲎试剂灵敏度的测定值)均在0.5 λ~2.0 λ(包括0.5 λ和2.0 λ)之间。见表1。
2.2 细菌内毒素限值(L)计算
根据公式L=K/M,L为供试品细菌内毒素限值,K为人每小时最大可接受的内毒素剂量,注射剂为5.0 Eu/(kg·h)。M为人用每公斤体重每小时的最大供试品剂量,清开灵注射液最大人用剂量为40 mL/d[5],以10%葡萄糖注射液200 mL或NaCl注射液100 mL稀释后使用,1 h内静脉滴注,成人体重按60 kg计,计算L=5.0/40/60=7.5 Eu/mL。
2.3 供试品最大有效稀释倍数(MVD)[2]
根据公式MVD=C×L/λ确定供试品的最大有效释倍数范围,供试品的细菌内毒素限值L为7.5 EU/mL,C为供试品溶液的浓度,当L以Eu/mL 表示时,则C等于1.0 mL/mL,鲎试剂的灵敏度(λ)通常为0.03~0.50 EU/mL。计算出供试品的最大有效稀释倍数范围,即:MVDmin=1.0×7.5/0.5=15倍;MVDmax=1.0×7.5/0.03=250倍。
2.4 干扰试验预试验
按中国药品检验标准操作规范进行[6],用BET水分别将2个厂家的清开灵注射液依次稀释成15、30、60、120、240倍系列浓度的药液,记作“NPC系列”,另制备同样系列浓度的供试液,并使每一供试液均含有2 λ浓度(0.5 EU/mL)的内毒素溶液记作“PPC系列”。每一浓度设两管,与灵敏度为0.25 EU/mL的鲎试剂进行反应,设阴性(NC)和阳性(PC)对照管,混匀后封口,置37 ℃恒温水浴60 min,见表2。
预试验结果显示,供试品浓度在15~30倍的稀释范围内对鲎试剂与内毒素的反应有较强的抑制作用,供试品浓度在60~240倍的稀释范围内对鲎试剂与内毒素的反应无干扰。笔者选用2个厂家的鲎试剂进行比较,证明不同厂家的供试品结果一致。
2.5 供试品的干扰试验[2]
细菌内毒素标准溶液的制备:用BET水将CSE稀释成2 λ﹑1 λ﹑0.5 λ﹑0.25 λ的内毒素标准溶液。
供试品内毒素溶液的制备:分别用两个厂家的清开灵注射液的60倍稀释液将同一支CSE分别制成2 λ﹑1 λ﹑0.5 λ﹑0.25 λ的供试品内毒素溶液。使用2个厂家的鲎试剂与上述2个内毒素溶液反应,并同时做阴性对照(NC)及供试品阴性对照(NPC)。见表3。
结果显示,选用2个厂家的鲎试剂,不同厂家6个批次清开灵注射液的60倍稀释液均无干扰,其 Es(用BET水制成的内毒素标准溶液的反应终点浓度的几何平均值)在0.5~2.0 λ(包括0.5 λ和2.0 λ)且Et(用供试品稀释液制成的内毒素溶液的反应终点浓度的几何平均值)均在0.5 Es~2.0 Es之间,符合药典规定。说明供试品在60倍稀释后对试验无干扰作用。
2.6 供试品内毒素的检查
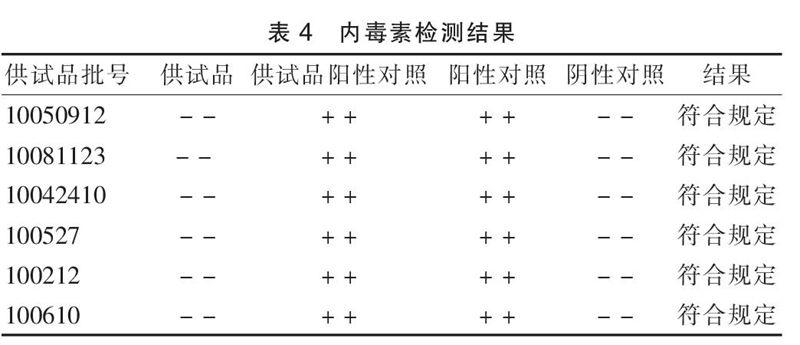
将6批供試品用BET水制成60倍稀释液,用此浓度稀释液将CSE稀释为2 λ浓度的溶液,作为供试品阳性对照,取灵敏度(λ):0.125 Eu/mLTAL进行细菌内毒素检测,见表4。
3 讨论
(1)通过干扰预试验初步确定了清开灵注射液最小不干扰稀释倍数,这样既可以减少做干扰试验的盲目性,又可以减少试剂消耗及节省时间;(2)清开灵注射液对细菌内毒素检查有干扰作用,但其干扰作用可通过对样品溶液进行适当的稀释得以排除[7]。应用2个厂家的TAL,不同厂家6个批次清开灵注射液的60倍稀释液做干扰实验,结果证明均无干扰作用,且供试品的细菌内毒素常规检查结果为阴性,此时可建立该品种的细菌内毒素检查方法[8]。说明清开灵注射液可以由细菌内毒素检查法取代热原检查法。
[参考文献]
[1]国家药典委员会. 中华人民共和国药典[S]. 一部. 北京:中国医药科技出版社,2010.
[2]施震,尹银嘉,李华. 注射用头孢替唑中细菌内毒素的检测[J]. 中国药学杂志,2003,38(5):337-339.
[3]宋晓坤,李丽娟. 注射用美罗培南细菌内毒素的检测[J]. 中国药师,2005,8(1):77.
[4]庞邦斌,焦爱军. 糖盐钾注射液细菌内毒素检查法的探讨[J]. 广西医学,2006,28(7):1107.
[5]国家药典委员会. 临床用药须知[M]. 北京:中国医药科技出版社,2010:806.
[6]中国药品生物制品检定所. 中国药品检验标准操作规范[S]. 北京:中国医药科技出版社,2010:313.
[7]何进,高军,陈金旺. 凝胶法细菌内毒素检查的干扰因素及消除[J]. 中国药师,2010,13(2):284-287.
[8]肖贵南,许姿敏,盛英美. 亚甲蓝注射液细菌内毒素定量法研究[J]. 中国药房,2008,19(34):2698.
(收稿日期:2012-04-28本文编辑:魏玉坡)
