阴离子交换树脂分离提取发酵液中的乳酸
2012-09-02迟国达黄臣勇
迟国达,王 鹏,徐 伟,2,黄臣勇
(1.哈尔滨工业大学城市水资源与水环境国家重点实验室,150090哈尔滨;2.哈尔滨商业大学食品工程学院,150076哈尔滨)
工业上生产乳酸[1]主要采用微生物发酵法,本实验室利用微波诱变选育出的乳酸高产菌株干酪乳杆菌鼠李糖亚种(Lactobacillus casei subsp rhamnosus)W4-3-9菌株对玉米淀粉生产废水进行发酵制备乳酸[2].成熟的发酵液中通常还含有菌体、蛋白质、色素、残糖和无机盐等杂质,如何将乳酸从发酵体系中提取出来是制约乳酸工业发展的重要因素,也是关注的热点[3-4].乳酸的提取过程是整个工艺中最耗费成本的[5],研究者采用不同的分离技术对乳酸进行分离,如反应萃取、膜技术、离子交换、电渗析和蒸馏等[6-11].其中,离子交换法因具有选择性高、交换容量大、操作简便、易于自动控制等优点而受到关注[12],广泛应用于生物制品分离领域[13-14].Cao Xunjun等[15]在pH高于和低于pKa(3.86)的情况下,分别研究了阴离子交换树脂Amberlite IRA-4从发酵液中分离提取L-乳酸的情况,研究表明,与钙盐法相比,离子交换法有一定的优势,产品的收率亦大大提高.Kulprothipanja等[16]在专利中用具有叔胺功能基或吡啶功能基的弱碱性阴离子交换树脂(Amberlite IRA-35)或一个季胺功能基的强碱性阴离子交换树脂(Amberlile IRA-958)进行了离子交换提取乳酸的工艺研究,该工艺的优点是:选择性强;一种树脂即可完成,没有转型工艺;整个工艺采用连续逆流多级流动床系统.王子镐等[17]研究了从“葡萄糖-乳酸”溶液中提取乳酸的离子交换工艺,筛选了一种树脂为201X4,吸附量为0.25 g/mL,而对葡萄糖基本不吸附.利用该树脂参与乳酸的发酵,可以连续将发酵液中的乳酸分离出来,从而维持发酵所需的pH值,未参加的葡萄糖则返回发酵罐继续参与发酵,便可能实现乳酸的连续发酵.但树脂201X4对乳酸的交换容量不令人满意,需进一步研究.
采用离子交换树脂法分离提取玉米淀粉发酵液中的乳酸,以乙酸、丙酮酸、柠檬酸和乳酸为研究对象,探讨315型阴离子交换树脂对这几种有机酸的静态吸附等温线及吸附动力学特性,考察不同操作条件及洗脱条件对发酵液中乳酸分离纯化效果的影响.
1 实验
1.1 材料与仪器
PS系大孔弱碱性阴离子交换树脂(德国朗盛Lewatit树脂公司)、PS系大孔吸附树脂和国产弱碱性阴离子交换树脂(蚌埠辽源新材料有限公司)、乙酸(分析纯,丹东市胜利化工厂)、乳酸(分析纯,北京化学试剂公司)、丙酮酸(生化试剂,天津光复精细化工研究所)、柠檬酸(分析纯,哈尔滨市化工试剂厂)、葡萄糖酶试剂盒(生化试剂,吉林省惠强生物技术有限公司).
恒温振荡仪(哈尔滨东联电子技术开发有限公司,HZQ-QG)、蠕动泵(郑州南北仪器设备有限公司)、高效液相色谱仪(SHIMADZU LG-10A).
1.2 分析方法
乳酸等有机酸质量浓度采用高效液相色谱法测定[18],葡萄糖采用酶-比色法测定(食品中葡萄糖的测定方法GB/T 16285—96).
1.3 发酵液中主要成分的测定
废水发酵液先经离心机以转速4 000 r/min离心20 min,后稀释100倍,并通过0.45 μm滤膜过滤.参照相关文献研究,选取乳酸(Lactic acid)、甲酸(Formic acid)、乙酸(Acetic acid)、丙酸(Propionic acid)、正丁酸(n-Butyric acid)、丙酮酸(Pyruvic acid)、草酸(Oxalic acid)和柠檬酸(Citric acid)制作标准曲线.然后,采用液相色谱法对废水发酵液中有机成分的性质与质量浓度进行测定.
1.4 树脂的筛选
分别称取1.000 g树脂(湿质量),放入4个50 mL三角瓶中,分别加入相同浓度(0.5 mol/L)的乳酸、乙酸、柠檬酸和丙酮酸溶液各20 mL,即加入45 g/L乳酸、30 g/L乙酸、96.07 g/L柠檬酸、44.03 g/L丙酮酸溶液各20 mL,用盐酸调节pH至1.88(未经pH调节时的发酵液pH原始值).25℃下摇床振荡24 h,测定上层溶液中各有机酸质量浓度ρe(g/L),按下式计算平衡吸附量:式中:Qe为平衡吸附量(mg/g);ρ0为吸附体系中所加有机酸溶液的初始质量浓度(g/L);ρe为吸附体系中吸附平衡后上清液中有机酸质量浓度(g/L);V为吸附体系中所加有机酸溶液体积(L);m为吸附体系中所加树脂质量(g).
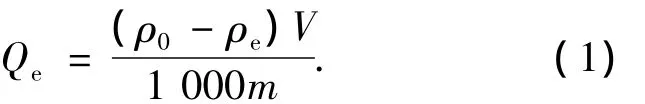
1.5 吸附等温线的测定
称取1.000 g树脂放入若干0.05 L三角瓶中,再分别加入不同质量浓度的乳酸(10、20、40、60、80 g/L)各0.015 L,分别于25、30和40℃下吸附24 h.吸附平衡后测定残液中有机酸质量浓度,根据式(1)计算平衡吸附量Qe,绘制吸附等温线.
1.6 吸附动力学
称取2.000 g树脂放入两个0.10 L三角瓶中,分别加入40 g/L乳酸、丙酮酸、柠檬酸和20 g/L乙酸各0.030 L,25℃下于摇床上吸附.不同时间取样测定各有机酸质量浓度,直至吸附平衡,计算t时刻的吸附量Qt,并绘制吸附曲线.
1.7 动态实验
动态实验所用的色谱柱内径2.0 cm,柱长60.0 cm.取已预处理的315型树脂装入已标好刻度的玻璃色谱柱中,湿法装柱至0.10 L.使发酵液和洗脱剂以不同流量通过吸附柱,每0.050 L柱底流出液收集为一个样,测定其有机酸质量浓度,并绘制流出曲线.
2 结果与讨论
2.1 发酵液中主要成分分析
实验所用废水为玉米淀粉生产废水,微生物代谢过程的多途径性使得发酵液中的有机成分相对复杂,这些有机物将影响离子交换树脂法分离提取乳酸的效果.参考相关文献采用高效液相色谱法对发酵液中的有机成分进行分析测定.根据液相色谱的结果选取质量浓度较大且与乳酸性质相近的有机酸作为考查对象.
所得液相色谱图见图1,发酵液中各主要成分质量浓度见表1.

图1 发酵液的液相色谱图

表1 实际废水发酵液中主要有机物质量浓度g·L-1
因为原水是玉米淀粉生产废水发酵液,含有一定量的残糖,从表1可以看出:有机酸中的乙酸、柠檬酸和丙酮酸质量浓度相对较大,且其性质与乳酸接近,故后续实验选择葡萄糖、乙酸、柠檬酸和丙酮酸配置模拟发酵液用于考察不同树脂分离提取乳酸的效果,并进行树脂的选择以及动态吸附、洗脱实验.后续实验采用的均为模拟发酵液.
2.2 树脂的筛选
本实验使用的树脂有弱碱性阴离子交换树脂(MP64、S4528、339型、315型、318型)和大孔吸附树脂(CAD-40、D101及BS-65),通过其对乳酸、乙酸、柠檬酸和丙酮酸的静态交换容量确定用于乳酸分离提取的最佳树脂,每种有机酸的静态交换容量实验均用盐酸调节pH至1.88,这是发酵液的原始pH值,同动态实验pH值环境相同,在此条件下探求树脂对几种有机酸的静态交换容量,结果见表2.
由表2可以看出:在pH为1.88条件下,对有机酸的吸附能力,阴离子交换树脂比大孔吸附树脂强.原因在于弱碱性树脂主要吸附未离解的有机酸分子,而低pH利于有机酸以分子状态存在,同时大孔吸附树脂不具备高度专一性,而阴离子交换树脂交换基团为弱碱性,使其对有机酸的吸附更具选择性.5种阴离子交换树脂中,315型和S4528型对乳酸的静态交换容量较其他几种大,而315型对乙酸、柠檬酸及丙酮酸的静态交换容量均较S4528型小.实验选取315型阴离子交换树脂用于乳酸的分离提取.本实验选用的315型阴离子交换树脂对乳酸的静态交换容量可达274.9 mg/g,显著高于郑辉杰等[12]选用的D301G对发酵液中乳酸的静态交换容量234 mg/g.
2.3 吸附等温线实验
在25、30和40℃下315型树脂对乳酸的吸附等温曲线见图2.可以看出,随着乳酸质量浓度的增加,315型树脂对乳酸的吸附量也逐渐增加,并且随温度的增加,其吸附量减少.说明乳酸在315型树脂上的吸附过程是放热反应,低温利于其进行,故乳酸的提取过程在室温进行即可.此实验结果同郑辉杰等[12]选用的D301G树脂对乳酸的吸附作用相反.

图2 315 型阴离子交换树脂对乳酸的吸附等温线
根据Freundlich经验等温式(2)对上述数据进行拟合:

式中:k为平衡吸附常数,n为特征常数,其他常数定义同式(1).结果见表3.

表3 315 型树脂吸附乳酸的Freundlich经验方程拟合参数
由表3可以看出,315型树脂对乳酸的吸附等温线符合Freundlich方程.方程的特征参数n>1,表明是优惠吸附[19].
进一步在25℃下测定了315型阴离子交换树脂对乙酸、乳酸、丙酮酸及柠檬酸的吸附等温线,见图3.并对其数据进行Freundlich经验式拟合,结果见表4.可以看出,n值大小关系为:乙酸<乳酸<丙酮酸<柠檬酸,说明柠檬酸、丙酮酸比乳酸更易于吸附在315型树脂上,而乙酸相对乳酸而言,被315型树脂吸附的能力较弱.这与4种酸的酸性相关(见表5),酸性强的有机酸更易于被315型阴离子交换树脂吸附.
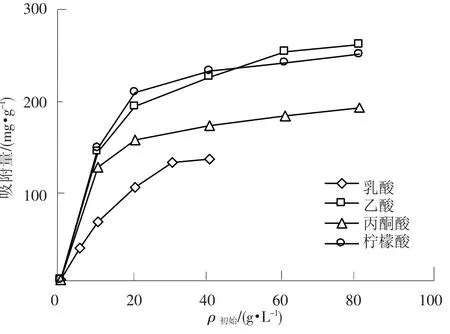
图3 315 型树脂对几种有机酸的吸附等温线

表4 Freundlich经验方程拟合参数

表5 主要有机酸成分的保留时间及Ka值
2.4 吸附动力学实验
图4 为25℃下,有机酸在315型树脂上的吸附量Qt随吸附时间t的变化曲线.可以看出,315型树脂对有机酸的吸附速率较慢,60 min时的吸附量为平衡吸附量的90%,达到平衡吸附的时间为120 min.

图4 25 ℃下有机酸在315型树脂上的吸附曲线
液相吸附由3个基本过程组成:吸附质在吸附剂粒子表面液膜内扩散、粒子内的细孔扩散和表面扩散、在细孔表面的吸附,其中慢者为吸附速率的控制步骤.分别采用Boyd液膜扩散方程[20]和Kannan-Sundaram粒内扩散模型[21]讨论315型树脂对几种有机酸的吸附.
Boyd液膜扩散方程:

Kannan-Sundaram粒内扩散模型:

式中:F=Qt/Qe表示吸附剂的吸附交换率;k'表示膜扩散速率常数;kp为粒内扩散速率常数;C为方程的截距.
分别以-ln(1-F)对t作图和Qt对t0.5作图,对应关系见图5、6,拟合得到的方程及相关系数见表6.可以看出,-ln(1-F)对t拟合方程的相关系数均大于Qt对t0.5拟合方程的相关系数,前者的线性关系相关性好于后者,说明315型树脂对有机酸吸附的主要控制步骤是液膜扩散,其吸附动力学符合Boyd液膜扩散模型.另外,图6的直线不经过原点,表明颗粒内扩散过程对有机酸在315型树脂上的吸附有一定的影响,液膜扩散过程并不是该过程的唯一控制步骤.

图5 25 ℃时315型树脂吸附有机酸的Qt-t0.5曲线

图6 25 ℃时315型树脂吸附有机酸的-ln(1-F)-t曲线

表6 25℃下有机酸的静态吸附动力学拟合结果
2.5 动态吸附实验
2.5.1 上柱流速的确定
在pH=1.88条件下,发酵液分别以流速1、1.5、2、3 BV/h上柱,乳酸及乙酸的流出曲线分别见图7、8.

图7 不同上柱流速下流出液中乳酸质量浓度变化

图8 不同上柱流速下流出液中乙酸质量浓度变化
以流出液中乳酸含量达5%作为穿透点,由图7可知,在pH值1.88条件下,随流速的增加乳酸穿透点的总流量不断提前,其中流速为1.5 BV/h时乳酸的穿透点与1 BV/h时相同,均在300 mL处,即吸附相同量的乳酸用时更短,在乳酸分离提取过程中更具有效率.由图8可知,乙酸穿透点的规律与乳酸相近,与乳酸相比其更早达到穿透点.同时,在乙酸的流出曲线中存在其质量浓度大于进样质量浓度的情况(达110%).初步分析认为,当乳酸和乙酸同时存在时,乳酸将与其竞争吸附到315型阴离子交换树脂上,并因树脂对乳酸的吸附作用更强而替换吸附到树脂上的乙酸,从而使得流出液的瞬时质量浓度大于其进样质量浓度.在流出液中一直未检出丙酮酸和柠檬酸,其全部吸附于树脂上.丙酮酸和柠檬酸因其酸性强于乳酸[22],能够优先吸附于弱碱性树脂上,并能对乳酸进行替换,形成竞争吸附.实验还发现,葡萄糖在树脂上能很快达到吸附饱和,流出液中葡萄糖质量浓度快速与进样中质量浓度相同,315型阴离子交换树脂对葡萄糖基本无吸附作用.
综上,最佳上柱流速选为1.5 BV/h,并在此基础上确定最佳上柱pH值.
2.5.2 上柱pH的确定
在上柱流速1.5 BV/h条件下,发酵液分别以pH1.88、3、4上柱,收集流出液,测定其有机酸质量浓度随时间的变化,结果见图9、10.可以看出,随pH的升高,乳酸的穿透体积越来越小,由pH 1.88的300 mL减少到100 mL左右,而乙酸的流出曲线趋于一致.同时发现柠檬酸、丙酮酸和葡萄糖的流出质量浓度与之前无变化.分析知弱碱性树脂主要吸附未离解的有机酸分子,而低pH利于有机酸以分子状态存在.故选取上柱pH值1.88、上柱流速1.5 BV/h作为315型树脂分离提取乳酸的最佳上柱条件.

图9 不同上柱pH下流出液中乳酸质量浓度变化

图10 不同上柱pH下流出液中乙酸质量浓度变化
2.6 动态洗脱实验
由表7可知,实验选取的5种洗脱剂均有很好的洗脱效果[12],相对于有机洗脱剂乙醇,无机的酸、碱洗脱剂效果更好.去离子水作为洗脱剂能很好地解吸树脂上吸附的乳酸,同时考虑到乳酸纯度及提取成本问题,选取去离子水作为乳酸的洗脱剂.

表7 洗脱剂洗脱效果
离子交换柱以最佳上柱条件(pH 1.88、1.5 BV/h)上柱300 mL模拟发酵液,然后用20 mL去离子水快速淋洗树脂层,再分别用去离子水以0.5、1及1.5 BV/h的流速进行洗脱,结果见图11.

图11 去离子水作为洗脱剂情况下有机酸流出曲线
由图11可以看出,在用去离子水洗脱过程中,只有乙酸和乳酸被淋洗下来,丙酮酸和柠檬酸均未在流出液中检出,同时乙酸的流出质量浓度峰值出现较乳酸早.对比不同流速下的乳酸流出曲线可知,随流速的降低,乳酸峰值质量浓度增加,洗脱峰逐渐变窄,但是拖尾现象较高流速严重.出现此种结果与乳酸、乙酸、丙酮酸以及柠檬酸之间竞争吸附过程相关,酸性强的物质便不易于被洗脱.由此洗脱下来的溶液中只存在乳酸、乙酸以及少量的葡萄糖.
通过动态吸附及洗脱实验,分析流出液及树脂中有机酸质量浓度,见表8.可以看出,提取液中乳酸质量浓度为19.5 g/L,是上柱液中乳酸质量浓度(40 g/L)的1/2,而纯度由72.4%提高到83.6%,所含有机酸种类减少,提取液经浓缩结晶后可以提取出纯度较高的乳酸产品.从吸附到洗脱全过程中乳酸提取率为72.4%(吸附99.0%,洗脱73.0%).

表8 有机酸的分离提取效率
3 结论
1)温度升高,315型阴离子交换树脂对乳酸等有机酸的吸附量减少,吸附过程为放热过程,故吸附实验在室温下进行即可.
2)315 型阴离子交换树脂对乳酸等有机酸的吸附过程符合Freundlich吸附等温方程,方程的特征参数n>1,是一种“优惠吸附”,315型树脂对有机酸的吸附能力由强到弱为:柠檬酸、丙酮酸、乳酸、乙酸.
3)315 型阴离子交换树脂对乳酸等有机酸吸附过程的主要控制步骤是液膜扩散,其吸附动力学符合Boyd液膜扩散模型.同时,粒内扩散并不是该过程唯一的控制步骤.
4)25℃下的动态吸附及洗脱实验表明,上柱流速及pH值均影响乳酸在315型阴离子交换树脂上的吸附效果.以1.5 BV/h、pH 1.88上柱吸附,再用1 BV/h的去离子水洗脱,可实现发酵液中乳酸的良好分离.
[1]TONG Wangyu,FU Xiangyang,LEE S M,et al.Purification of L(+)-lactic acid from fermentation broth with paper sludge as a cellulosic feedstock using weak anion exchanger Amberlite IRA-92[J].Biochemical Engineering Journal,2004,18(2):89-96.
[2]张兴,王鹏,徐伟.微波辐照选育L-乳酸高产菌的生物学特性研究[J].哈尔滨商业大学学报:自然科学版,2008,24(3):305-308.
[3]吴宇琼,李定或.发酵法生产乳酸的提取与精制研究进展[J].食品工业科技,2003,24(1):106-108.
[4]曾炜,陈丰秋,詹晓力.乳酸的生产技术及其研究进展[J].化工进展,2006,25(7):744-749.
[5]GONZALEZ M I,ALVAREZ S,RIERA F A,et al.Purification of lactic acid from fermentation broths by ion-exchange resins[J].Industrial&Engineering Chemistry Research,2006,45(9):3243-3247.
[6]DATTA R.Recovery and purification of lactate salts from whole fermentation broth by electrodialysis[R].U.S.Patent 4,885,257,1989.
[7]KULPRATHIPANJA S.Separation of lactic acid from fermentation broth with an anionic polymeric absorbent[R].U.S.Patent 5,068,418,1991.
[8]NISPEN van J G M,JONKER R.Process for the fermentative preparation of organic acids[R].U.S.Patent 5,002,881,1999.
[9]RUSSO L J,KIM H.Membrane-based process for the recovery of lactic acid by fermentation of carbohydrate substrates containing sugars[R].U.S.Patent 5,503,750,1996.
[10]BANIEL A M,EYAL A M,MIZARAHI J,et al.Lactic acid production,separation and recovery process[R].U.S.Patent 6,187,951,2001.
[11]EYAL A M,STARR J N,FISHER R,et al.Lactic acid processing methods arrangements and products[R].U.S.Patent 6,229,046,2001.
[12]郑辉杰,李志强,何姗,等.离子交换法提取发酵液中乳酸的工艺研究[J].食品科学,2009,30(6):84-88.
[13]HOUWING J,BILLIET H A H,WIELEN van der L A M.Optimization of azeotropic protein separations in gradient and isocratic ion-exchange simulated moving bed chromatography[J].J Chromatogr,2002,944(1/2):189-201.
[14]TONG Wangyu,YAO Shanjing,ZHU Ziqiang.Separation characteristics of human epidermal growth factor in ion exchange chromatography with STREAMLINE DEAE resin[J].Chem Eng Sci,2001,56(24):6959-6965.
[15]CAO Xunjun,YUN H S,KOO Y M.Recovery of LLactic acid by anion exchange resin Amberlite IRA-400[J].Biochemical Engineering Journal,2002,11(2/3):189-196.
[16]曹本昌,费克晖,匡群.我国发酵乳酸提取方法的现状及新技术[J].江苏食品与发酵,1997(1):22-28.
[17]王子镐.离子交换法分离乳酸的研究[J].离子交换吸附,1991,7(4):26 6-271.
[18]李友元,陶萍.高效液相色谱法测定螺旋霉素发酵液中的有机酸[J].色谱,2002,20(1):46-48.
[19]杨鹏波,张晓燕,丛威,等.大孔吸附树脂吸附乳酸及乳酸与谷氨酸的分离[J].过程工程学报,2007,7(4):767-772.
[20]李明愉,曾庆轩,冯长根,等.离子交换纤维对阿魏酸的吸附和解吸研究[J].中国药学杂志,2005,40(1):40-43.
[21]王学江,张全兴.NDA-100大孔树脂对水溶液中水杨酸的吸附行为研究[J].环境科学学报,2002,22(5):658-660.
[22]马翠卿,李景晨,邱建华,等.离子交换法分离乳酸转化液中的丙酮酸[J].离子交换与吸附,2005,21(3):241-247.
