中重度烧伤合并脓毒血症患者TFPI、TF、TNF-α 的变化
2012-08-24闵定宏余绍青陈国安李国辉
闵定宏,余绍青,陈国安,郭 菲 ,李国辉
(南昌大学第一附属医院a.烧伤中心;b.干部病房;c.血液科,南昌 330006)
由于烧伤创面炎症、肠道细菌移位等原因,中重度烧伤易发生脓毒血症,进一步可发展为脓毒性休克、DIC、多器官功能障碍综合征(MODS)。近年来的研究[1-3]发现,在脓毒血症发病过程中,凝血系统异常是与炎症反应相互影响、相互促进的,凝血系统紊乱可导致脓毒血症进一步恶化,脓毒血症者发生凝血功能紊乱成为当今研究的热点。本研究通过测定中重烧伤合并脓毒血症患者血浆组织因子途径抑制物(TFPI)、组织因子(TF)和肿瘤坏死因子-α(TNF-α)、血常规,并行血培养、创面分泌物细菌培养,以了解 TFPI、TF、TNF-α 与脓毒血症的关系,探讨TFPI变化对脓毒血症患者预后的影响,为重组组织因子途径抑制物(rTFPI)、抗凝等治疗脓毒血症提供临床依据。
1 材料与方法
1.1 材料
IMUBIND截短形式TFPI ELISA检测试剂盒为American Diagnostic Inc产品,编号850。 IMUBIND TF ELISA检测试剂盒为ASSAY Pro USA产品,编号ET1002-1。人TNF-α ELISA检测试剂盒由上海森雄科技有限公司提供。
1.2 病例入选标准
参考盛志勇等[4]提出的脓毒血症临床诊断标准,当高度怀疑细菌感染且出现符合下述前4条中2条以上,再加上第5条中任何一项时抽取患者周围静脉血。1)体温>39℃或<35.5℃,连续3 d以上。2)心率>120 次·min-1。 3)白细胞总数>12.0×109L-1或<4.0×109L-1,其中中性粒细胞大于 80%,或幼稚粒细胞百分比大于 10%。4)呼吸频率>28 次·min-1。 5)临床表现:精神抑郁;烦躁或谵语;腹胀、腹泻或消化道出血。
1.3 研究对象及分组
1)对照组:健康献血员 20例,男 16例、女 4例,年龄 21~53(31.23±8.74)岁,无心、肝、肾等器质性疾病,近期内无服药史。
2)烧伤组:选取2004年10月至2011年10月在南昌大学第一附属医院烧伤中心住院治疗超过半个月的30例脓毒血症患者(烧伤组),取得标本56 份。 男 21 例,女 9 例,年龄 21~57(35.31±11.23)岁,烧伤最大面积50%,烧伤最小面积26%。其中深Ⅱ度烧伤面积(29.65±21.08)%,Ⅲ度烧伤面积(21.5±9.58)%。白细胞数(11.52±3.17)×109L-1,其中最高达26.5×109L-1、最低达 7.9×109L-1。 血培养阳性 12 例(为铜绿假单胞菌、肺炎克雷伯菌、鲍曼不动杆菌),其余血培养均阴性。创面分泌物细菌培养27例阳性,以G-杆菌为主。有烦躁或谵语或精神抑郁症状者18例,腹胀、腹泻13例。烧伤组按病程的前后分为:感染前期组(烧伤后72 h~7 d内);感染后期组(烧伤后 10~14 d 内)。
1.4 观察指标
对照组抽血查 TFPI、TF、TNF-α、血常规。烧伤组于烧伤后 72h~7d内、10~14 d内分别抽血查TFPI、TF、TNF-α、血常规,并进行血培养、创面分泌物细菌培养。
1.5 TFPI、TF、TNF-α 的测定
所有入选者空腹8 h,清晨取静脉血3 mL,按9∶1收集血液于3.8%柠檬酸三钠溶液中。离心6 000 r·min-1×10 s,-80 ℃冰箱冻存备检。 标本复溶后严格按照试剂盒使用说明操作,用ELISA检测法分别测定血浆TFPI、TF、TNF-α抗原含量。
1.6 统计学方法
应用SPSS 17.0统计软件处理。各组数据以均数±标准差表示,组间比较采用t检验,采用Spearman等级相关进行相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 TFPI、TF 及 TNF-α 的变化
与对照组比较,感染前期组患者 TFPI、TF、TNF-α抗原含量明显升高(P<0.01);感染后期组TF、TNF-α 抗原含量明显升高(P<0.01),但 TFPI抗原含量差异无统计学意义(P>0.05)。与感染前期组比较,感染后期组患者TF、TNF-α抗原含量差异无统计学意义(P>0.05),但TFPI抗原含量降低,差异有统计学意义(P<0.05)。见表 1。
表1 烧伤病人TF、TFPI、TNF-α 的检测结果 ±s
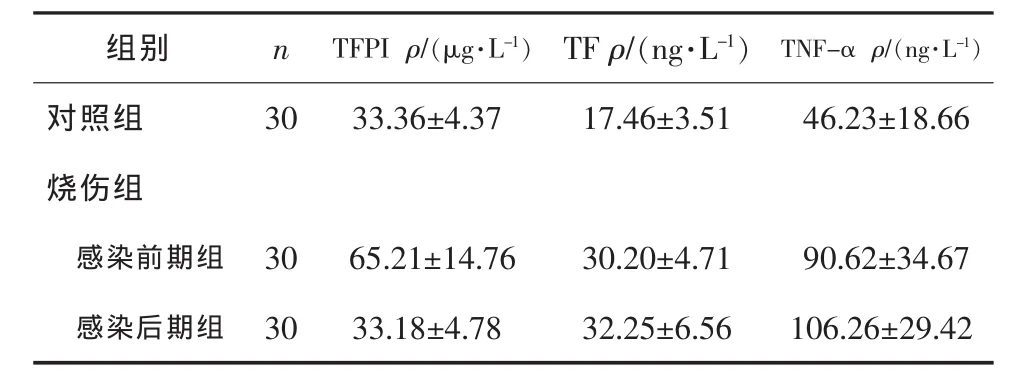
表1 烧伤病人TF、TFPI、TNF-α 的检测结果 ±s
组别 n TNF-α ρ/(ng·L-1)对照组 30 46.23±18.66烧伤组TFPI ρ/(μg·L-1)33.36±4.37 TF ρ/(ng·L-1)17.46±3.51感染前期组 30 90.62±34.67感染后期组 30 106.26±29.42 65.21±14.76 33.18±4.78 30.20±4.71 32.25±6.56
2.2 TFPI、TF 与 TNF-α 的关系
感染前期组 TFPI与TF、TNF-α呈正相关(r=0.763、r=0.835,P<0.05)。 感染后期组 TFPI与 TF、TNF-α 呈负相关(r=-0.873、r=-0.363,P<0.05)。
3 讨论
新近研究[1]发现,脓毒血症主要是由凝血活化、炎症反应及纤溶抑制相互作用形成的级联反应过程,其中凝血活化是脓毒血症发病的重要环节[1]。抑制凝血系统的活化可有效抑制失控的炎症反应,并可改善脓毒血症患者的预后[3]。目前认为,在MODS的发病过程中,凝血系统紊乱是造成机体器官功能衰竭的直接原因;参与凝血的许多凝血因子本身也是炎症介质,在炎症反应的过程中,它们既被其他炎症介质所激活,同时也激活其他的炎症介质[5]。TFPI又称外源性凝血途径抑制物,是组织因子途径中重要的生理抑制物,它可以抑制纤维蛋白原的形成 , 抑 制 血 小 板 的 聚 集[6-7];E.de Jonge 等[8]指 出 ,TFPI在内毒素引起的脓毒血症中具有很强的抗凝作用,可改善患者凝血功能紊乱;TFPI还能显著改善脓毒血症动物模型的肺功能及氧合指数[9],因此,血浆中TFPI抗原含量的变化对脓毒血症病情发展的影响和预后的判断具有重要的意义。
中重度烧伤72 h后毛细血管通透性大多逐渐恢复正常,因皮肤的屏障作用被破坏,细菌等病原微生物易侵入机体;加上应激反应和组织缺血、缺氧,肠道黏膜屏障失控,细菌和内毒素可经淋巴液、血液迁移至全身,从而引起脓毒血症,多以革兰阴性杆菌感染为主。本研究结果显示,与对照组TFPI(33.36±4.37)μg·L-1比较,中重度烧伤合并脓毒血症患者在感染前期 TFPI[(65.21±14.76)μg·L-1]明显升高(P<0.01);感染后期 TFPI[(33.18±4.78)μg·L-1]下降(P<0.05)。与 T.M.Ravindranath 等[10]报道烧伤面积在30%、合并脓毒血症的老鼠动物模型中TFPI动态变化的研究一致。TFPI升高的原因可能是:1)对TF增加的代偿反应;2)血管内皮细胞受损时,其对TFPI的结合能力下降,引起TFPI升高;3)疾病发作时机体出现应激反应,白细胞释放一些活性酶使TFPI从内皮细胞表面脱落入血;4)血小板和巨核细胞被激活,释放TFPI[11]。中重度烧伤合并脓毒血症患者在感染后期TFPI下降,TF/TFPI水平失衡,可能是因为机体对TFPI的持续消耗、血管内皮细胞受损引起TFPI的合成下降[12],从而提示严重持续的感染可能会引起TFPI的耗竭。由此笔者认为,TFPI的升高可作为判断早期脓毒血症的一项指标;TFPI的降低又可作为脓毒血症晚期的一项监测指标,对TFPI动态观察有利于了解烧伤患者脓毒血症的发生与发展。
TF作为外源性凝血系统的启始因子,在某些诱发因素作用下从内皮细胞释放,与凝血因子Ⅶ或Ⅶa结合成复合物,进而活化凝血酶原为凝血酶,诱发血液高凝状态。TFPI是体内可直接特异性抑制TF的Kunitz性蛋白酶,首先通过K2区与凝血因子FXa结合,继而在钙离子存在条件下,通过K1区与FⅦa/TF结合,进而灭活TF,从而抑制外源性凝血途径。TF和TFPI的平衡对维持血液正常的流动状态极为重要[13]。本研究也表明,与对照组TF抗原含量[(17.46±3.51)ng·L-1] 比较, 感染前期组[(30.20±4.71)ng·L-1]和感染后期组[(32.25±6.56)ng·L-1]明显升高(P<0.01),提示TF与烧伤并脓毒血症的发生、发展有关。
在研究中同时检测了血浆中TNF-α水平,发现感染前期组 TFPI、TF、TNF-α 呈正相关(r=0.763、r=0.835,P<0.05)、感染后期组 TFPI与 TF、TNF-α 呈负相关(r=-0.873、r=-0.363,P<0.05)。TNF-α 是机体炎症和免疫应答的重要调节因子,具有抗感染作用。但TNF-α持续明显升高则会导致机体发热、休克、恶液质、组织器官坏死。有学者认为烧伤并脓毒血症病人TNF-α检出率和平均水平显著高于未并发脓毒血症的患者,TNF-α水平与烧伤面积及感染程度成正相关[14]。本研究中,感染前期组患者TFPI与TF、TNF-α呈正相关,可能是由于内毒素和激活的补体成分通过直接和间接方式促进单核细胞与血管内皮细胞表达TNF-α、TF、TFPI。感染后期组患者TFPI与TF、TNF-α呈负相关,可能与脂多糖(LPS)的持续刺激引起 TNF-α、TF升高而TFPI的耗竭有关,因此TFPI/TNF-α的持续下降、TF/TFPI的不断升高提示病情加重、预后差。
[1] 姚永明,盛志勇.脓毒症防治学[M].北京:科学技术文献出版社,2008:460-480.
[2] 姚永明,柴家科,林洪远.现代脓毒症理论与实践[M].北京:科技出版社,2005:544-594.
[3] 姚永明,孟海东.严重脓毒症抗凝治疗的新认识[J].中华儿科杂志,2006,44(8):569-572.
[4] 盛志勇,姚咏明.脓毒症研究的现状与展望[J].解放军医学杂志,1999,24(2):79-82.
[5] Galligan L,Livingstone W,Volkov Y,et al.Coagulation dysfunction in sepsis and multiple organ system failure[J].Crit Care Clin,2003,19(3):441-458.
[6] Ndonwi M,Broze G Jr.Protein S enhances the tissue factor pathway inhibitor of factor Xa but not its inhibition of factorⅦ atissue factor[J].J Thromb Haemost,2008,6(6):1044-1046.
[7] Crawley J T,Lane D A.The haemostatic role of tissue factor pathway inhibitor[J].Arterioscler Thromb Vasc Biol,2008,28(2):233-242.
[8] de Jonge E,Dekkers P E,Creasey A A,et al.Tissue factor pathway inhibitor does not influence inflammatory pathways during human endotoxemia[J].J Infect Dis,2001,183(12):1815-1818.
[9] Maclaren R,Stringer K A.Emerging role of anticoagulants and fibrinolytics in the treatment of acute respiratory distress syndrome[J].Pharmacotherapy,2007,27(6):860-873.
[10] Ravindranath T M,Goto M,Demir M,et al.Tissue factor pathway inhibitor and thrombin activatable fibrinolytic inhibitor plasma levels following burn and septic injuries inrats[J].ClinApplThrombHemost,2004,10(4):379-385.
[11] 刘伟.组织因子途径抑制物-1与临床疾病的相关性研究[J].国外医学:输血及血液学分册,2004,27(3):216-219.
[12] Hansen J B,Svensson B,Olsen R,et al.Heparin induces synthesis and secretion of tissue factor pathway inhibitor from endothelial cells in vitro [J].Thromb Haemost,2000,83(6):937-943.
[13] Lwaleed B A,Bass P S.Tissue factor pathway inhibitor:structure,biology and involvement in disease[J].J Pathol,2006,208(3):327-339.
[14] 仇刚.TNF、IL-1、IL-6在烧伤和感染中的研究进展[J].国外医学:创伤与外科基本问题分册,1995,16(4):218-221.
