膈下逐瘀汤对大鼠纤维化肝组织α-SMA和TGF-β1表达的影响*
2012-08-22代巧妹王亚贤肖佳音
杨 婧,贾 彦,刘 宏,代巧妹,王 蔚,王亚贤,冯 涛,华 东,肖佳音
(黑龙江中医药大学基础医学院病理教研室,哈尔滨 150040)
膈下逐瘀汤对大鼠纤维化肝组织α-SMA和TGF-β1表达的影响*
杨 婧,贾 彦△,刘 宏,代巧妹,王 蔚,王亚贤,冯 涛,华 东,肖佳音
(黑龙江中医药大学基础医学院病理教研室,哈尔滨 150040)
目的:观察膈下逐瘀汤抗猪血清诱导的大鼠肝纤维化作用及其可能的作用机制。方法:采用猪血清腹腔注射诱导大鼠免疫性肝纤维化模型,VG染色法检测肝组织病理学改变,ELISA检测肝组织TGF-β1含量,定量RT-PCR检测肝组织TGF-β1和α-SMA mRNA表达。结果:与模型组大鼠比较,膈下逐瘀汤可显著降低猪血清诱导的肝纤维化程度,减少肝组织 TGF-β1蛋白和mRNA表达,降低肝组织α-SMA mRNA表达。结论:膈下逐瘀汤可有效地逆转实验性大鼠肝纤维化,其机制可能与抑制肝星状细胞活化有关。
肝纤维化;膈下逐瘀汤;转化生长因子-β1;α-平滑肌肌动蛋白
肝纤维化是慢性肝病中常见的一种病理生理过程,若不积极控制将发展成肝硬化甚至肝癌。目前越来越多的基础和临床研究证实,肝纤维化可以逆转[1]。肝纤维化动物模型在去除损伤因素后可自动恢复,且慢性肝病患者在去除病因或给予抗病毒治疗后肝纤维化可能逆转[2]。学者们普遍认为,肝星状细胞(hepatic stellate cells,HSC)的活化、增殖是肝纤维化形成和发展的中心环节,对HSC的干预已成为防治肝纤维化的核心措施之一[3]。目前,肝纤维化的治疗以中药复方制剂为主[4]。膈下逐瘀汤为清代医家王清任创制的名方,载于《医林改错》中,主治膈膜以下、上腹部瘀血积块等病证,与肝硬化的发病机制和病变位置可谓药证合拍。本实验旨在通过观察实验动物肝脏病理改变和HSC激活相关指标,明确膈下逐瘀汤防治猪血清诱导的免疫损伤性肝纤维化的效果,初步探讨其抗肝纤维化的机制,为临床用药提供可靠依据。
1 材料
1.1 动物
健康成年雄性,Sprague-Dawley大鼠60只,体重200g±10g,由北京维通利华实验动物技术有限公司提供(许可证编号SCXK京2002-0003)。
1.2 药品与试剂
膈下逐瘀汤由五灵脂6g、当归9g、川芎6g、桃仁9g、丹皮 6g、赤芍 6g、乌药 6g、玄胡索 3g、甘草 9g、香附 4.5g、红花 9g、枳壳 4.5g 等 12 味中药组成,生药购自齐齐哈尔市中医医院中药房,经齐齐哈尔医学院药物研究所鉴定无伪劣品。水煎2次合并药液,过滤浓缩,以蒸馏水稀释至生药1.5 g/ml贮存,4℃保存备用。大鼠转化生长因子 β1(transforming growth factor β1, TGF-β1)酶 联 免 疫 吸 附 测 定(enzyme-linked immunosorbent assay,ELISA)试剂盒(美国Promega公司,批号 G7590)、猪血清(上海纬群生物技术有限公司,批号20081214)、总 RNA提取试剂 RNAiso Reagent(批号 B13031)及 SYBR ExScriptTMRT-PCR Kit试剂盒(大连宝生物工程有限公司,批号DRR031A)。
1.3 仪器
MultiskanMk3型酶标仪(芬兰 Thermo Labsystems公司)、ABI7300型实时荧光定量PCR仪(美国ABI公司)、UV-2550型紫外分光光度计(日本岛津公司)、AH-22万能研究显微镜(日本SANOY公司)、WELL wash 4MK2洗板机(芬兰 Thermo Labsystems公司)、Motic Med 6.0数码医学图像分析系统(北京麦克奥迪图像技术有限公司)。
2 方法
2.1 模型制备及给药
取大鼠60只,适应性喂养1周后随机分为空白对照组(Con)、膈下逐瘀汤组(GD)、猪血清组(PS)、猪血清 +膈下逐瘀汤组(PS+GD)4组。Con组和GD组以NaCl注射液腹腔注射(0.5 ml/只,2次/w),其余PS组和PS+GD组均以猪血清腹腔注射(0.5 ml/只,2次/w),连续12周。各组大鼠于分组后2d开始连续灌胃生理盐水或膈下逐瘀汤(生药7.37g/kg·d),连续给药 12 周。
2.2 肝组织学检查
最后1次给药后,大鼠用2%戊巴比妥钠以2 ml/kg腹腔注射麻醉后,仰卧位固定,打开腹腔,取肝右叶小块用10%甲醛液固定,石蜡包埋,5 μm厚连续切片并进行胶原VG染色。胶原面密度计算采用Motic Med 6.0数码医学图像分析系统进行图像分析,根据胶原占视野中肝脏的面积比间接估计胶原含量,每张切片计算其面密度(面密度 =胶原面积/肝组织视野面积×100%)。
2.3 ELISA法检测肝脏组织中TGF-β1含量
按照 TGF-β1定量检测试剂盒说明操作,用Multiskan Mk3型酶标仪450 nm波长测量样品的光密度,通过标准曲线直线回归方程式计算样品中TGF-β1 含量。
2.4 实时定量 PCR检测肝脏组织中 TGF-β1和α-SMA mRNA表达
肝脏组织加入RNAiso,按说明书提取总RNA,1 μl总RNA在20 μl体系中按照标准程序进行反转录,反转录反应配液为:5 × ExScriptTMBuffer 2 μl,dNTP 0.5 μl,100 μM Random 6 mers 0.5 μl,ExScriptTTMRTase 0.25μl,RNase inhibitor 0.25 μl,Total RNA 0.5 μg,RNase Free dH2O 补到 10 μl。42℃反应15 min,95℃加热 2 min。实时 PCR反应的配液为:SYBR Premix Ex TaqTM25.0 μl,上游引物 1.0 μl,下游引物 1.0 μl,Dye 1.0 μl,模板 cDNA溶液 4.0 μl,dH2O 20.0 μl。反应条件设置为:95℃10s,然后95℃5s、60℃31s进行 40个循环。反应完成后得出Ct(Threshold cycle)值。参照文献将Ct值转化为相对倍数,基因表达量采用实验组/对照组=2-ΔΔCt进行计算[5],其中 ΔΔCt=(Ct目的 - Ct对照)实验-(Ct目的 -Ct对照)对照。引物序列:α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)上游 5’-CCG AGA TCT CAC CGA CTA CC-3’,下游5’-TCC AGA GCG ACA TAG CAC AG-3’;TGF-β1上游5’-TGC CCT CTA CAA CCA ACA CA-3’,下游5’-GTT GGA CAA CTG CTC CAC CT-3’;3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上游 5’-GAC AAC TTT GGC ATC GTG GA-3’,下游 5’-ATG CAG GGA TGA TGT TCT GG-3’(大连宝生物工程有限公司合成)。
2.5 统计学分析
3 结果
3.1 膈下逐瘀汤抗肝纤维化的作用
图1表1显示,VG染色结果光镜下可见细胞核呈蓝黑色或灰黑色,胶原纤维呈红色,肌纤维、细胞浆、红细胞呈黄色。PS组大鼠肝组织胶原面积较Con组显著增加(P<0.05),PS+GD组大鼠肝组织胶原面积较PS组显著减少(P<0.05)。
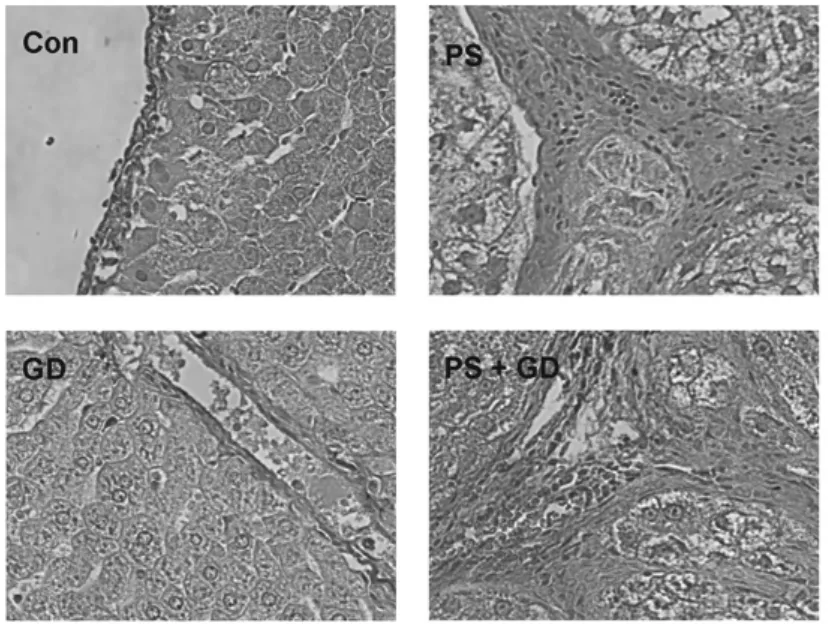
图1 VG染色法观察膈下逐瘀汤对肝纤维化的影响(×200)
表1 膈下逐瘀汤对大鼠纤维化肝组织胶原含量的影响(±s)

表1 膈下逐瘀汤对大鼠纤维化肝组织胶原含量的影响(±s)
注:与Con组比较:*P <0.05;与PS组比较:#P <0.05(Con:空白对照,GD:膈下逐瘀汤,PS:猪血清)
组 别 例数 胶原面积(%)Con 15 0.71 ± 0.27 GD 15 0.73 ± 0.28 PS 13 9.37 ± 2.91*PS+GD 14 5.90 ± 1.37*#
3.2 膈下逐瘀汤对 TGF-β1表达的影响
表2图2显示,与 Con组比较,PS组大鼠肝组织匀浆中 TGF-β1含量显著升高(P <0.05)。与PS组比较,PS+GD组大鼠肝组织匀浆中 TGF-β1含量显著降低(P<0.05)。我们进一步采用实时定量PCR法检测肝组织 TGF-β1 mRNA表达,肝组织TGF-β1 mRNA表达与蛋白表达结果相符合。
3.3 膈下逐瘀汤对α-SMA mRNA表达的影响
图2表2显示,与 Con组相比,PS组大鼠肝组织中α-SMA mRNA表达显著升高(P <0.05)。与PS组比较,PS+GD组大鼠肝组织 α-SMA mRNA表达显著降低(P<0.05)。
4 讨论
膈下逐瘀汤方出自清代著名医家王清任所著《医林改错》,由五灵脂、当归、川芎、桃仁、丹皮、赤芍、乌药、玄胡索、甘草、香附、红花、枳壳等12味药物组成,具有活血祛瘀、行气止痛之功效。本方以逐瘀活血和行气药物居多,使气帅血行,更好地发挥其活血逐瘀作用,在临床上治疗肝硬化有确切疗效[6]。本实验病理学结果显示,在致病因素未祛除、猪血清持续作用的条件下,PS+GD组大鼠肝组织病理组织学改变明显好于PS组,表明膈下逐瘀汤对PS诱导大鼠肝纤维化的发生和发展均有治疗和延缓作用。
图2 各组样本TGF-β1和α-SMA mRNA的扩增曲线
表2 膈下逐瘀汤对大鼠纤维化肝组织TGF-β1和α-SMA基因表达的影响(±s)
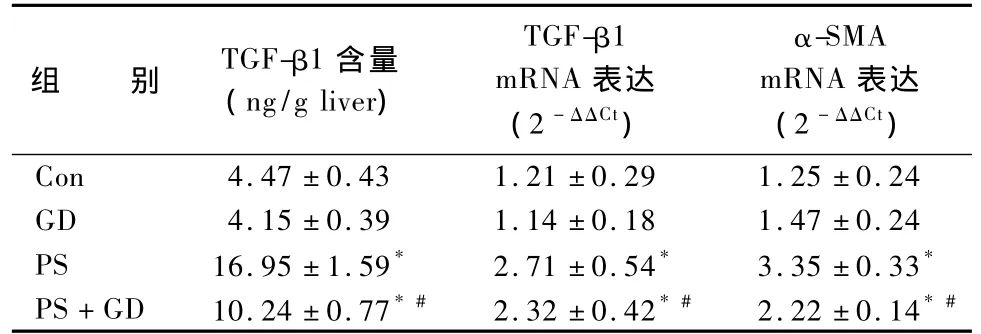
表2 膈下逐瘀汤对大鼠纤维化肝组织TGF-β1和α-SMA基因表达的影响(±s)
注:与Con组比较:*P <0.05;与PS组比较:#P <0.05(Con:空白对照,GD:膈下逐瘀汤,PS:猪血清)
组 别 TGF-β1含量(ng/g liver)TGF-β1 mRNA表达(2 -ΔΔCt)α-SMA mRNA表达(2 -ΔΔCt )Con 4.47 ±0.43 1.21 ±0.29 1.25 ±0.24 GD 4.15 ±0.39 1.14 ±0.18 1.47 ±0.24 PS 16.95 ±1.59* 2.71 ±0.54* 3.35 ±0.33*PS+GD 10.24 ±0.77*# 2.32 ±0.42*# 2.22 ±0.14*#
肝纤维化发生发展的主要原因在于肝损伤期间ECM的沉积和降解的动态平衡被打破。HSC活化合成大量ECM是肝纤维化形成的直接原因,也是肝纤维化发生的核心环节[7]。HSC活化也是肝纤维化的细胞学基础[8],因此抑制HSC活化在防治慢性肝病和抗肝纤维化中具有重要意义。TGF-β1是组织损伤后的强效致纤维化因子[9]。肝脏中 TGF-β1是各种TGF-β异构体中最主要的存在形式,TGF-β1含量较 TGF-β2、TGF-β3多约 10倍,肝实质细胞受损后释放的TGF-β1是启动邻近静息态HSC激活和转化的初始信号之一[10]。研究表明,将编码活性TGF-β的基因载体转入裸鼠肝脏后,可导致所有主要器官纤维化,提示TGF-β具有使组织发生纤维化的病理作用[11]。TGF-β1可以上调 HSC表达 I型、III型、IV型胶原、纤维连接蛋白、层黏蛋白透明质酸、硫酸软骨素、释放细胞因子及炎症介质,包括TGF-β1自身形成 TGF-β1的自分泌环路,从而促进静息HSC激活[12]。病理情况下,细胞外基质的主要细胞来源是HSC,其激活和增生在肝纤维化过程中起主要作用[13],是肝纤维化发生发展的核心环节。激活的HSC的特点之一是表达α-SMA,α-SMA常作为 HSC激活的标志物[14]。本研究 ELISA和PCR结果显示,大鼠肝纤维化模型肝组织中TGF-β1 mRNA表达和蛋白含量明显增加,给予膈下逐瘀汤干预后,TGF-β1 mRNA表达和蛋白含量明显降低。α-SMA mRNA在PS组大鼠肝组织表达上调,在 PS+GD组大鼠肝组织表达明显减少,表明膈下逐瘀汤可抑制 HSC的活化、增殖和产生 TGF-β1。本研究结果提示,膈下逐瘀汤抗肝纤维化的作用机理可能是阻止星状细胞活化,进而抑制星状细胞自分泌TGF-β1这一主要的肝纤维化促进因子,减缓星状细胞活化的维持和持续放大,发挥抗肝纤维化的作用。
[1]Li X,Shen J,Zhong Z,et al.Paeoniflorin:a monomer from traditional Chinese medical herb ameliorates Schistosoma japonicum egg-induced hepatic fibrosis in mice[J].J Parasitol,2009,95(6):1520-1524.
[2]Maclean KN,Sikora J,Koich V,et al.A novel transgenic mouse model of CBS-deficient homocystinuria does not incur hepatic steatosis or fibrosis and exhibits a hypercoagulative phenotype that is ameliorated by betaine treatment[J].Mol Genet Metab,2010,101(2-3):153-162.
[3]Foo NP,Lin SH,Lee YH,et al.α-Lipoic acid inhibits liver fibrosis through the attenuation of ROS-triggered signaling in hepatic stellate cells activated by PDGF and TGF-β [J].Toxicology,2011,282(1-2):39-46.
[4]李 季,叶 军,薛冬英.中药复方抗肝纤维化作用机制研究概况[J].中医杂志,2011,52(3):253-256.
[5]Duran EM,Shapshak P,Worley J,et al.Presenilin-1 detection in brain neurons and FOXP3 in peripheral blood mononuclear cells:normalizer gene selection for real time reverse transcriptase pcr using the deltadeltaCt method[J].Front Biosci,2005,10(9):2955-2965.
[6]沈龙柱,高 虹,吴兆洪,等.辨病辨证治疗肝硬化腹水47例[J].辽宁中医杂志,2004,31(6):473-474.
[7]Priya S,Sudhakaran PR.Cell survival,activation and apoptosis of hepatic stellate cells:modulation by extracellular matrix proteins[J].Hepatol Res,2008,38(12):1221-1232.
[8]Ghatak S,Biswas A,Dhali GK,et al.Oxidative stress and hepatic stellate cell activation are key events in arsenic induced liver fibrosis in mice[J].Toxicol Appl Pharmacol,2011,251(1):59-69.
[9]Song SL,Gong ZJ,Huang YQ,et al.JinSanE decoction,a chinese herbal medicine,inhibits expression of TGF-beta1/Smads in experimental hepatic fibrosis in rats[J].Am J Chin Med,2006,34(6):1047-1061.
[10]Andreola F,Calvisi DF,Elizondo G,et al.Reversal of liver fibrosis in aryl hydrocarbon receptor null mice by dietary vitamin A depletion[J].Hepatology,2004,39(1):157-166.
[11]Barry-Hamilton V,Spangler R,Marshall D,et al.Allosteric inhibition of lysyl oxidase-like-2 impedes the development of a pathologic microenvironment[J].Nat Med,2010,16(9):1009-1017.
[12]Cao S,Yaqoob U,Das A,et al.Neuropilin-1 promotes cirrhosis of the rodent and human liver by enhancing PDGF/TGF-beta signaling in hepatic stellate cells[J].J Clin Invest,2010,120(7):2379-2394.
[13]Wang P,Liu T,Cong M,et al.Expression of extracellular matrix genes in cultured hepatic oval cells:an origin of hepatic stellate cells through transforming growth factor beta[J].Liver Int,2009,29(4):575-584.
[14]Lindert S,Wickert L,Sawitza I,et al.Transdifferentiationdependent expression of alpha-SMA in hepatic stellate cells does not involve TGF-beta pathways leading to coinduction of collagen type I and thrombospondin-2[J].Matrix Biol,2005,24(3):198-207.
Effects of Gexia Zhuyu Tang on expressions of α-SMA and TGF-β1 in fibrous liver tissues of rats
YANG Jing,JIA Yan,LIU Hong△,DAI Qiao-mei,WANG Wei,WANG Ya-xian,FENG Tao,HUA Dong,XIAO Jia-yin
(Department of Pathology,School of Basic Medical Science,Heilongjiang University of Chinese Medicine,Harbin150040,China)
Objective:To investigate the inhibitory effect and possible mechanism of Gexiazhuyu decoction on hepatic fibrosis induced by porcine serum in rats.Methods:Sixty male Sprague-Dawley rats were randomly divided into four groups as follows:blank control group,Gexiazhuyu decoction group,porcine serum group,porcine serum plus Gexiazhuyu decoction group.The fibrosis model of rats was achieved by intraperitoneal injection of porcine serum twice weekly for 12 weeks,simultaneously Gexiazhuyu decoction administered daily by gavage for 12 weeks.All rats were sacrificed at the end of experiment,and liver were collected for analysis.The liver histopathology was examined by van Gieson's stain,and the content of TGF-β1 in the liver were detected by enzyme linked immunosorbent assay.Real-time reverse transcriptase polymerase chain reaction was used to analyze α-SMA and TGF-β1 mRNA expression in the liver.Results:Compared with the porcine serum group,the histopathology of rats given Gexiazhuyu decoction improved significantly.α-SMA mRNA expressions were decreased significantly,and TGF-β1 mRNA expressions and content in liver were decreased significantly in porcine serum plus Gexiazhuyu decoction group(P< 0.05).Conclusions:Gexiazhuyu decoction may exert antihepatic fibrosis effect in rats via inhibition of HSC activation
Gexiazhuyu decoction;liver fibrosis;transforming growth factor β1;α-smooth muscle actin
R287.5
B
1006-3250(2012)02-0158-03
黑龙江省自然科学基金资助项目(D200820);黑龙江省教育厅科学技术研究面上项目(11541344);黑龙江省中医药科研指导项目(ZHY08-W04)
杨 婧(1981-),女,黑龙江大庆人,讲师,医学硕士,从事中医药防治消化系统疾病的基础研究。
△通讯作者:贾 彦,教授,医学硕士,从事中医药防治肝纤维化的基础研究,Tel:0451-82195940,E-mail:jy570@sohu.com。
2011-08-12
