岷山红三叶茎叶水浸液对3种植物种子萌发及幼苗生长的影响
2012-08-20安培坤王引权窦莉莉张金林康生福
安培坤,王引权,窦莉莉,张金林,康生福
(1.甘肃中医学院药学系,甘肃 兰州730000;2.甘肃中医学院中医系,甘肃 兰州730000;
3.兰州大学草地农业科技学院,甘肃 兰州730020;4.甘肃岷归中药材科技有限公司,甘肃 定西748400)
红三叶(Trifolium pratense),又叫红荷兰翘摇、红车轴草,为车轴草属丛生型短期多年生豆科牧草,原产于小亚细亚及南欧,是全世界栽培最早和最多的重要牧草之一,我国新疆、湖北和西南地区有野生种分布[1-2]。早在1944年,甘肃岷县从美国引进栽培红三叶,经过多年栽培驯化,经全国饲料牧草品种审定委员会审定登记,定名为岷山红三叶(T.pratense cv.Minshan)[3]。岷山红三叶是集草、药为一体的优良豆科牧草和药用植物[4],不仅抗寒耐湿、病虫害少,而且优质高产,其鲜草产量3万~9万kg·hm-2,开花期干物质粗蛋白质含量19%~75%,同时岷山红三叶茎叶中含有0.7%~1.0%异黄酮类化合物[4]。许多研究证明,异黄酮类物质在土壤中被微生物分解形成的衍生物,对其他植物有明显的化感抑制作用[5-6]。异黄酮等酚类物质可通过抑制受体植物细胞内酶活性,促使细胞内自由基失衡,从而导致细胞原生质膜遭到破坏[7]。同时异黄酮类化感物质能影响线粒体中腺嘌呤核苷三磷酸(ATP)的形成,从而抑制幼苗根的呼吸作用[8],进一步抑制根的伸长。岷山红三叶以种子播种繁殖生产,在种植当年种植户通常套种一年生牧草或当季蔬菜以增加收入。然而,有关红三叶对这些作物的化感抑制作用尚不明确。本研究选用岷山红三叶茎叶水浸液为供体,以燕麦(Avena sativa)、披碱草(Elymus dahuricus)和小白菜(Brassica chinensis)为受体,对3种受体种子萌发及幼苗生长进行生物测定,以明确其化感效应,为减轻和防治作物连作障碍提供依据。
1 材料与方法
1.1 供试材料 供体岷山红三叶植株采自岷县红三叶种植基地,受体植物燕麦和披碱草种子由兰州大学草地农业科技学院江小雷副教授提供,小白菜种子由甘肃省武威市陇盛种业有限公司提供。燕麦、披碱草和小白菜的种子千粒重分别为28.4、4.1和3.7g。
1.2 试验方法 供体水浸液制备:于2011年5月下旬采集初花期岷山红三叶健康植株,立即带回实验室,摘除枯黄叶片,洗净,沥干后,剪成2cm长的小段备用。称取80g剪碎样,材料与水按1∶5比例,加入蒸馏水400mL,置于室温下浸泡48h,300 W超声仪,25℃超声35min,用定性滤纸和0.45 μm的滤膜进行二重抽滤,即得质量浓度为0.20 g·mL-1的水浸液,储于4℃冰箱中备用。使用时再与蒸馏水按3∶1、1∶1、1∶3比例混合,分别稀释成0.05、0.10和0.15g·mL-1浓度的水浸液[9-11]。
供体茎叶水浸液对受体植物的生物测定:采用改进的平皿法[9]。将经0.1%HgCl消毒10min的饱满种子各20粒,均匀播种于放有两层灭菌滤纸的种子发芽盒中,各试验组分别加入10mL的0.05、0.10、0.15和0.20g·mL-1的岷山红三叶茎叶水浸液(对照组加10mL蒸馏水)后,置于(25±1)℃恒温箱中培养,每处理重复3次。以胚根突破种皮1~2mm时记录发芽数,小白菜处理组2d后开始记录发芽数,4d后测量根长和芽长;燕麦和披碱草处理组分别于3、4d后开始记录发芽数,6d后测量根长和芽长。发芽率的计算公式如下:

酚类化感物质的测定:取岷山红三叶滤液20 mL,分别加入2%FeCl3和2%K3Fe(CN)6(体积比15∶1)混合液5mL,再加入4~5滴10%HCl溶液,调至酸性。根据溶液颜色变化判断是否含有酚类化感物质[12-13]。
数据处理:用Excel对种子的发芽率及幼苗的根长和芽长试验数据进行整理,用SPSS 16.0对同一植物不同浓度的岷山红三叶水浸液处理的各试验组指标数据进行单因素方差分析。
2 结果
2.1 岷山红三叶茎叶水浸液中化感物质的测定 0.20g·mL-1的水浸液(A)呈黄褐色,反应液(B)呈黄色,蒸馏水加反应液(C)呈浅黄色。当在0.20g·mL-1的水浸液中加入反应液(D)时,颜色由最初的黄褐色迅速变为墨蓝色(图1)。

图1 岷山红三叶茎叶水浸液中酚类物质的显色反应Fig.1 Coloring reaction between reaction liquid and phenolic compounds in aqueous extract from the stems and leaves of Trifolium pratense cv.Minshan
2.2 岷山红三叶茎叶水浸液对植物种子萌发的影响 4种浓度的岷山红三叶茎叶水浸液对3种受体植物种子的发芽率均无显著影响(P>0.05)(表1)。说明浓度小于0.20g·mL-1的岷山红三叶茎叶水浸液对燕麦、披碱草、小白菜种子的发芽影响不显著。
2.3 岷山红三叶茎叶水浸液对植物幼苗生长的影响 岷山红三叶茎叶水浸液浓度在0.10~0.20g·mL-1时,对3种受体植物幼苗根生长有显著影响(P<0.05),且抑制作用随水浸液浓度的增加而增强,当水浸液浓度为0.20g·mL-1时,燕麦、披碱草和小白菜根生长抑制率分别比对照降低23.76%、35.73%和62.50%(表2)。
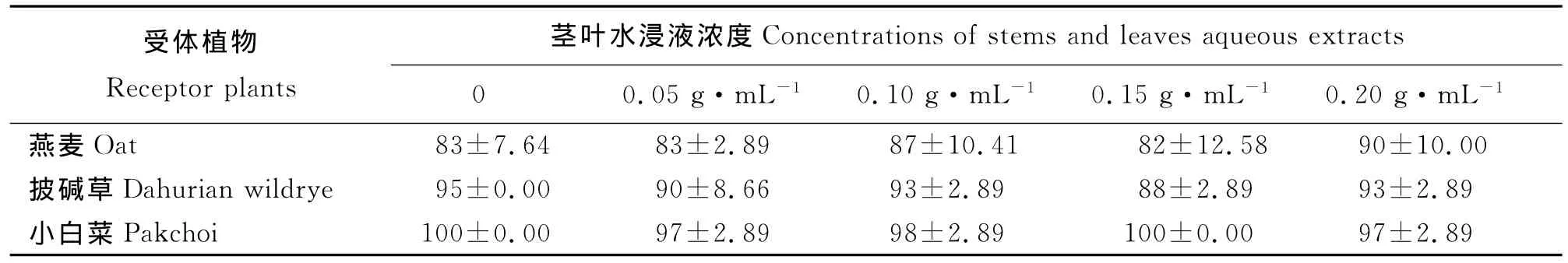
表1 岷山红三叶茎叶水浸液对3种植物种子发芽率的影响Table 1 Effects of aqueous extract from the stems and leaves of Trifolium pratense cv.Minshan on seed germination rate of 3plant species %

表2 岷山红三叶茎叶水浸液对3种植物幼苗根及胚芽长的影响Table 2 Effects of aqueous extract from the stems and leaves of Trifolium pratense cv.Minshan on the radicle and plumule length of 3plant species
不同浓度水浸液对燕麦的胚芽长无显著影响(P>0.05),对披碱草和小白菜芽的生长表现出不同的效应。0.05g·mL-1水浸液浓度显著促进披碱草的胚芽生长(P<0.05),较对照增加了11.97%,其他处理与对照相比无显著影响。所有的处理浓度均显著促进小白菜的胚芽生长,尤其是0.15g·mL-1时,较对照增长63.64%。
3 讨论与结论
高等植物的化感物质主要是酚类、类萜、含氮化合物、聚乙炔和香豆素等次生代谢物质,其中酚类物质为重要的水溶性化感物质[12]。根据酚类物质的特性,向含酚类物质溶液中加入2%FeCl3和2%K3Fe(CN)6(体积比15∶1)试剂后,邻位羟基酚与Fe3+生成绿色络合物,间位羟基酚与Fe3+生成蓝色络合物,且溶液中酚类物质浓度越高,其与Fe3+结合形成的络合物量就越多,溶液颜色就越深[13]。由此可推测,岷山红三叶化感物质中含有较多的间位酚类物质。本研究尽管定性测定出岷山红三叶茎叶中含有较多的间位酚类物质,表明其可能为主要化感抑制物质,但岷山红三叶中除了含有异黄酮类物质之外,还含有槲皮素(Quercetin)、水杨酸(Salicylic Acid)等酚类物质[14],这些物质是否也有化感抑制作用,还有待于进一步明确。
本研究表明,不同植物幼苗芽的生长受岷山红三叶茎叶水浸液的化感效应不同。各浓度对小白菜幼苗根伸长均有显著的抑制作用,且抑制作用随水浸液浓度的增加而增强,浓度低于0.20g·mL-1的水浸液对燕麦、披碱草、小白菜种子的萌发均无显著影响。李志华和沈益新[11]的研究表明,红三叶水浸液明显降低了高羊茅种子的发芽率,对多花黑麦草(Lolium multiflorum)、白三叶(T.repeus)、紫苜蓿(Medicago sativa)和萝卜(Raphanus sativus)的根伸长生长有明显的抑制作用。这说明岷山红三叶的化感作用在受体植物种属之间存在一定的差异。当0.05g·mL-1岷山红三叶茎叶水浸液对双子叶植物小白菜的化感作用要比对单子叶植物燕麦、披碱草的作用更强,这可能与不同类型植物对化感物质的敏感程度不同有关,也可能因为水浸液抑制了小白菜的幼根伸长,从而导致了营养物质较多转向幼芽,为幼芽的生长提供了更多的物质基础,产生了幼芽生长受到促进的现象。
岷山红三叶可多年生长,且水溶性的酚类化感物质易成盐,所以这种酚类化感物质在自然条件下易被土壤吸收[8]。这样是否会导致岷山红三叶连作障碍的发生以及影响程度也有待进一步探索,此外岷山红三叶植物中化感物质的产生、释放及作用机制也需要进一步明确。
[1] 杜占池,樊江文,钟华平.营养元素在红三叶叶片分解过程中的释放动态[J].草业科学,2003,20(7):12-15.
[2] 颜亮东,张国胜,李风霞.我国北方牧区天然牧草产量形成的气候模式[J].草业科学,2003,20(7):8-11.
[3] 王志明,岳民勤,杜文华,等.集饲用和药用价值于一体的牧草新秀——岷山红三叶[J].草业科学,2005,22(4):33-35.
[4] 俞联平,李发弟,程文定,等.钼、播种量和行距对岷山红三叶产量及异黄酮含量的影响[J].中国草地学报,2009,31(1):52-57.
[5] Tsanuo M K,Hassanali A,Hooper A M,et al.Isoflavanones from the allelopathic aqueous root exudate of Desmodium uncinatum [J].Phytochemistry,2003,64(1):265-273.
[6] 李寿田,周健民,王火焰,等.化感作用在杂草控制中的应用[J].中国生态农业学报,2003,11(1):104-106.
[7] Romagni J G,Allen S N,Dayan F E.Allelopathic effects of volatile cineoles on two weedy plant species[J].Journal of Chemical Ecology,2000,26(1):303-313.
[8] 赵福庚,何龙飞,罗庆云.植物逆境生理生态学[M].北京:化学工业出版社,2004:9-39.
[9] 中华人民共和国农业部农药检定所.NY/T1155.1-2006农药室内生物测定试验准则除草剂第1部分:活性试验平皿法[S].北京:中国标准出版社,2006.
[10] 李志华,沈益新.紫花苜蓿化感作用的研究[J].草业科学,2005,22(12):33-36.
[11] 李志华,沈益新.红三叶茎叶对几种牧草种子及幼苗的化感作用[J].中国草地,2005,27(3):41-43.
[12] 朱旺生,沈益新.白三叶和高羊茅对青菜幼苗生长的化感抑制效应[J].草业学报,2004,13(5):106-111.
[13] 石碧,狄莹.植物多酚[M].北京:科学出版社,2000:50-51.
[14] 彭静波,杨文菊,李占林,等.红车轴草的化学成分[J].沈阳药科大学学报,2008(11):875-879.
