生物杀虫剂甲氨基阿维菌素苯甲酸盐与牛血清白蛋白相互作用的荧光光谱研究
2012-08-16张国平刘培培訾言勤
高 燕,张国平,刘培培,訾言勤
(淮北师范大学 化学与材料科学学院,安徽 淮北 235000)
血清白蛋白是血浆中含量最丰富的重要载体蛋白,可与很多内源和外源物质结合,研究药物与血清蛋白的相互作用,对于了解药物的作用机理具有重要的生物学及临床意义,是一个引人注目的课题[1-5].而农药分子与蛋白分子作用特征的荧光法研究的有关报道相对较少.
甲氨基阿维菌素苯甲酸盐又称甲维盐,是从发酵产品阿维菌素B1开始合成的一种新型高效半合成抗生素杀虫剂[6],其原药按中国毒性标准分类为中等毒,制剂为微毒或低毒[7].本文首次采用荧光光谱法研究了甲氨基阿维菌素苯甲酸盐与牛血清白蛋白(BSA)间的相互作用,探讨了它们的作用机制及结合常数、结合位点数、结合作用力类型.这对了解生物杀虫剂甲氨基阿维菌素苯甲酸盐在动物体内的代谢过程等方面具有重要的意义.
1 实验部分
1.1 试剂与仪器
RF-5301PC荧光光度计(日本岛津公司);pHS-23型精密pH计(上海虹益仪器仪表有限公司);501型超级恒温器(上海市实验仪器厂).
称取适量的 BSA(分析纯,美国 Amersco公司)溶于 pH 7.4 B.R 缓冲溶液,配制 1.0×10-5mol·L-1储备液.称取适量的EB(分析纯)溶于乙醇(分析纯)配制5.0×10-4mol·L-1的储备液,均在0-4℃下保存.pH 7.4的B.R缓冲溶液,其他试剂均为分析纯,实验用水均为二次蒸馏水.
1.2 实验方法
在 10 mL 比色管中依次加入 pH 7.40的 B.R 缓冲溶液 1 mL,1.0×10-5mol·L-1BSA 溶液 0.5 mL 以及一定量5.0×10-4mol·L-1甲氨基阿维菌素苯甲酸盐溶液,用蒸馏水稀释至刻线后混匀,在一定温度下恒温30 min,然后该溶液用1 cm石英比色皿,在激发波长为277 nm,绘制300~440 nm的荧光光谱,激发和发射狭缝宽度分别为5 nm和5 nm,扫描速度为 Low.并分别以 Δλ=15 nm和 Δλ=60 nm扫描其同步荧光光谱.
2 结果与讨论
2.1 甲维盐与BSA的荧光猝灭类型

甲维盐与BSA作用的荧光光谱图如图1.由图1可见随着甲维盐的加入,BSA的内源荧光强度逐渐降低.说明甲维盐与BSA发生了相互作用,这种作用可能引起BSA中荧光发色团的微环境及蛋白质分子构象行为的变化[8].
判断药物小分子猝灭BSA荧光的机制是动态猝灭还是静态猝灭,主要根据荧光猝灭常数随温度的变化关系来确定,若荧光物质的猝灭常数随温度升高而增大即为动态猝灭,反之,即为静态猝灭[9-11].根据不同温度下甲维盐猝灭BSA的Stern-Volmer曲线图[12](见图2),求相应Stern-Volmer方程的猝灭常数,数据见表1.


表1 不同温度下甲维盐对BSA的猝灭常数
从表1结果来看,猝灭常数 Kq随温度的升高而增大,因此甲维盐猝灭BSA荧光的机制是动态猝灭.
2.2 甲维盐与BSA的表观结合常数 Kb以及结合位点数 n
分别在290 K,300 K,310 K温度下作lg(Fo-F)/F-lg[Q]的双对数图[13-14],由图3的线性方程求得不同温度的表观结合常数 Kb和结合位点数 n,数据见表2.由表2可知,甲维盐与BSA的结合位点数随温度300 K升高到310 K,增大较明显,从290 K到300 K增加较平缓,由于温度升高,分子运动加剧,导致表观结合常数 Kb以及结合位点数 n增加,进一步说明它们的作用机制为动态猝灭.从表2中还可看出甲维盐与BSA表观结合常数 Kb值约为103数量级,说明甲氨基阿维菌素结合作用的强度一般.
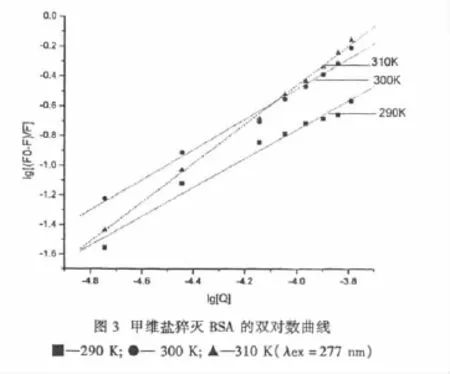
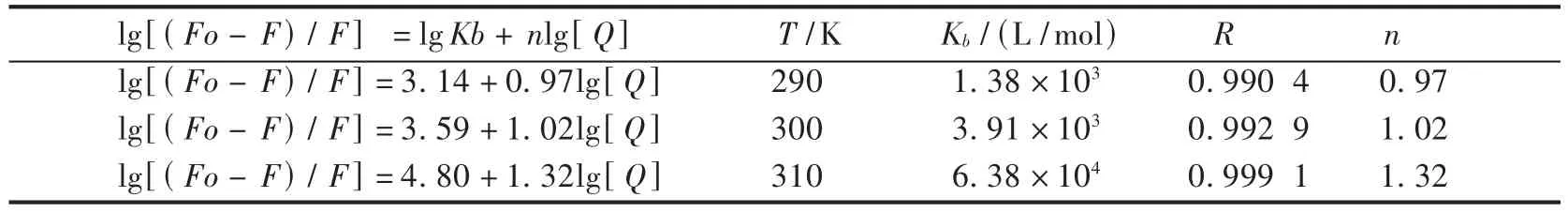
表2 不同温度下甲维盐与BSA的表观结合常数 Kb以及结合位点数 n
2.3 甲维盐与BSA结合反应的热力学性质及作用力
由甲维盐与BSA结合常数,计算出温度分别为290 K,300 K,310 K时,甲维盐与BSA作用的自由能变ΔG 分别为 - 17.432 kJ·mol-1, -20.630 kJ·mol-1, - 28.514 kJ·mol-1,焓变 ΔH 为 144.83 kJ·mol-1(反应的焓变视为常数),熵变 ΔS 分别为 559.52 J·mol-1·K-1、551.53 J·mol-1·K-1、559.17 J·mol-1·K-1.根据Ross等总结出的判断生物大分子与小分子结合力性质的热力学规律[15]推断出甲维盐与BSA之间的主要作用力是疏水作用.
2.4 同步荧光光谱
甲维盐与BSA作用的同步荧光光谱图见图4,由图4可知色氨酸残基特征荧光光谱峰随着甲维盐浓度增加产生猝灭效果较酪氨酸大[16],说明甲维盐主要与色氨酸残基结合,而两者峰位值未发生改变,进一步说明甲维盐对BSA的猝灭方式为动态猝灭,且甲维盐加入几乎没有使牛血清白蛋白的构象发生变化[17].
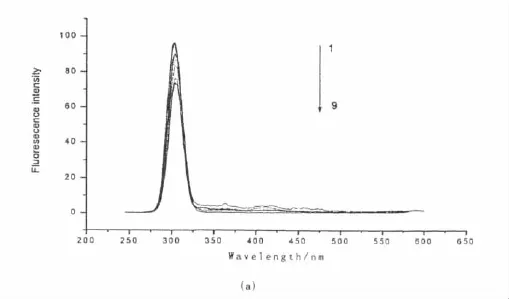
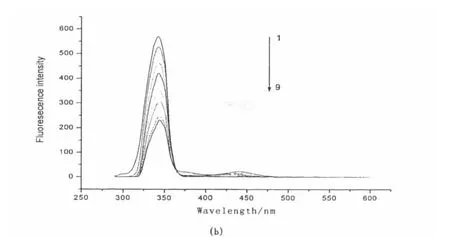
图4 同步荧光光谱(a):Δλ=15 nm;(b)Δλ=60 nmc甲维盐 =5.00 × 10 -5mol·L-1From 1 to 9:0.00,0.30,0.60,0.90,1.20,1.50,1.80,2.10,2.40
3 结论
本实验主要研究甲维盐与牛血清白蛋白BSA之间的相互作用,通过实验以及结果分析可以得出:甲维盐对牛血清蛋白具有荧光猝灭效应,通过对荧光猝灭速率常数的计算可以知道随着温度的升高,猝灭速率常数呈现上升的趋势,所以可以判定此荧光猝灭过程是一个动态的荧光猝灭过程.通过对荧光猝灭过程中热力学函数的计算可以知道,此复合过程是自发进行的,甲维盐与BSA之间的结合主要是靠疏水作用力.通过对加入药物的BSA进行同步荧光扫描可以知道,甲维盐对BSA的构象没有影响.
[1]KANDAGAL P B,ASHOKA S,SEETHARMAPPA J.Study of the interaction of an anticancer drug with human and bovine serum albumin:Spectroscopic approach[J].J Pharmaceut Biomed,2006,41:393 - 399.
[2]CHENG Zhengjun,ZHANG Yuntao.Spectroscopic investigation on the interaction of salidroside with bovine serum albumin[J].J Mol Struct,2008,889:20 - 27.
[3]NI Yongnian,LIU Genlan,KOKOT Serge.Fluorescence spectrometric study on the interactions of Isoprocarb and sodium 2 -isopropylphenate with bovine serum albumin[J].Talanta,2008,76:513 - 521.
[4]TIMEBAEV A R, HARTINGER C G, ALEKSENKO S S,et.al.Interactions of antitumor metallodrugs with serum proteins:Advances in characterization using modern analytical methodology[J].Chem Rev,2006,106:2 224 - 2 248.
[5]GENTILI P L,ORTICA F,FAVARO G.Static and dynamic interaction of a naturally occurring photochromic molecule with bovine serum albumin studied by UV - visible absorption and fluorescence spectroscopy[J].J Phys Chem B,2008,112:16 793 - 16 801.
[6]BURG R W,MILLER B M,BAKER E E,et.al.Avermectins,new family of potent anthelmintic agents:producing organism and fermentation[J].Antimicrobial Agents Chemotherapy,1979,15:361 -367.
[7]孙娟,孟水强,刘幽良.甲氨基阿维菌素苯甲酸盐的产业史和发展前景[J].世界农药,2010,32(S1):50-51.
[8]LIU Jiaqin,TIAN Jian - niao, ZHANG Jiyou,et al.Interaction of magnolol with bovine serum albumin:a fluorescence - quenching study[J].Anal Bioanal Chem,2003,376:864 - 867.
[9]LAKOWICZ J R.Principles of fluorescence spectroscopy[M].3th ed.New York:Plenum Press,2006.
[10]DEWEY T G.Biophysical and Biochemical Aspects of Fluorescence Spectroscopy[M].New York:Plenum Press,1991.
[11]WARE W R.Oxygen quenching of fluorescence in solution:an experimental study of the diffusion process[J].J Phys Chem,1962,66:455 -458.
[12]MOTE U S,BHATTAR S L,PATIL S R,et al.Interaction between felodipine and bovine serum albumin:fluorescence quenching study[J].Luminescence,2010,25(1):1 - 8.
[13]BANK A, PRIYADARSINI K I, MOHAN H.Photophysical studies on binding of curcumin to bovine serum albumins[J].Photochem Photobiol,2003,77:597 - 603.
[14]TIAN Jianniao,LIU Jiaqin,ZHANG Jiyou,et al.Fluorescence studies on the interactions of barbaloin with bovine serum albumin[J].Chem Pharm Bull(Tokyo),2003,51:579 -582.
[15]ROSS P D,SUBRAMANIAN S.The modynamics of protein association reactions forces contributing to stability[J].Biochem,1981,20(11):3 096 - 3 102.
[16]Lu Jianquan, JIN Fen, SUN Tingquan, et al.Multi- spectroscopic study on interaction of bovine serum albumin with lomefloxacin - copper(II)complex Int[J].J Biol Macromol,2007,40:299 - 304.
[17]WANG Yanqing, ZHANG Hongmei, WANG Ronghua.Investigation of the interaction between colloidal TiO2and bovine hemoglobinusing spectral methods[J].Colloids Surf B Biointerfaces,2008,65:190 - 196.
