肠侵袭性大肠杆菌致病机制的研究进展
2012-08-16温建军徐雪芳
温建军,徐雪芳
(1.江西省赣州市人民医院消化内科,江西赣州 341000;2.中国疾病预防控制中心传染病预防控制所,北京 102206)
1 EIEC的危害
肠侵袭性大肠杆菌(Enteroinvasive E.coli,EIEC)是一种能引起较大儿童和成年人腹泻的重要病原菌,最早是由DuPont于1971年首先发现[1]。EIEC的致病毒力强,只要10~100个细菌即可发病。临床上EIEC的症状主要是水样腹泻,少数人出现痢疾症状,暴发的感染源通常是食物源性或水源性的,也可以接触传播,形成散发病例[2]。本文主要就目前国内外EIEC的致病因子和致病分子机制研究进展情况进行了介绍。
2 致病菌EIEC的血清鉴定研究
致病菌EIEC引发疾病,首先对其进行血清分型鉴定,以确认是EIEC引起的。EIEC血清分型系统最早由Kauffman scheme在1947年创立[3]。 大肠杆菌的血清分型根据三种表面抗原。包括O性表面抗原(外膜O特异性脂多糖),鞭毛抗原(H)和被膜抗原(K)[4-5]。到目前为止,一共分离到170种O抗原,每一种都代表一个血清组。每个血清型都由特异的O和H抗原组成。表1中列举了目前分离到的大部分肠侵袭性大肠杆菌的血清型。
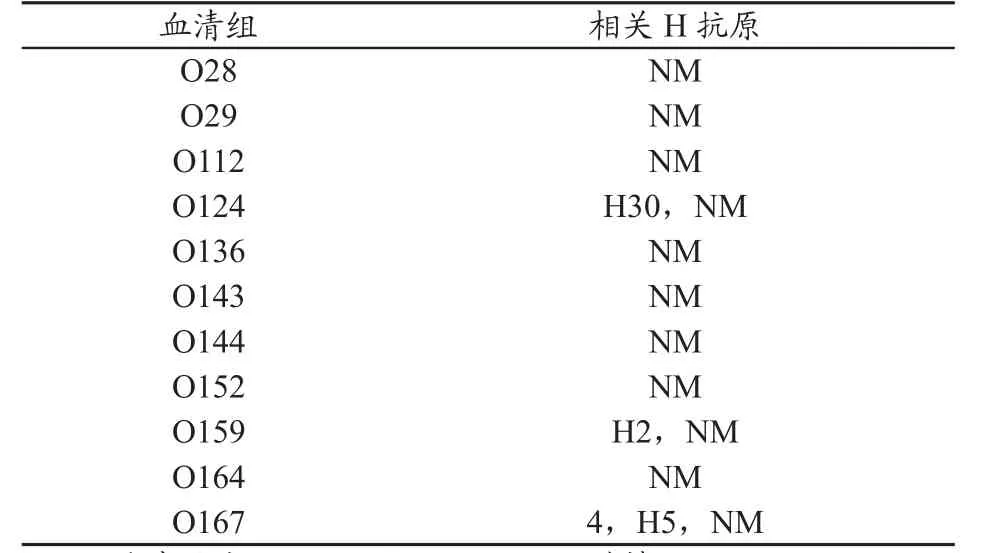
表1 目前分离到的EIEC血清型
3 EIEC的致病机制研究
大肠杆菌致病性主要决定于毒力因子,致病性大肠杆菌上存在很多致病因子,主要有菌毛、毒素、粘附素、侵袭因子、溶血素等,这些毒力因子通常是由染色体上成簇存在的一组基因所编码,称之为毒力岛(pathogenicity island,PAI)[6]。目前有关EIEC毒力岛与致病性的关系、致病的分子机制已经成为当今的研究热点。
3.1 EIEC的毒力因子研究
根据目前国外的相关研究,与EIEC致病相关的毒力因子已经被鉴定出来,主要有如下几类:粘附素系统[7](菌毛、非菌毛黏附素、F1、P、F17、)、铁离子摄取系统[8-9](气杆菌素、肠杆菌素)、抗机体杀菌因子[10](外膜蛋白A、脂多糖、KI荚膜、耶尔森菌素、增强血清中生存蛋白)。
3.1.1 粘附素系统
黏附素是一类表达与细胞膜表面长约0.5~3微米,在电镜下呈丝状的蛋白质结构,通常多达100个相同的结构亚单位和各种不同的微小辅助蛋白构成,因而在体内外试验中能接到细菌吸附于有些细胞上而得名。EIEC拥有特异的粘附因子,这些粘附因子促使杆菌完成对宿主粘膜细胞起始的定居[7]。大部分情况下,这些粘附因子会形成叫作菌毛的明显的形态学结构,菌毛有好几类。有的菌毛为杆状结构,直径为5~10 nm,与鞭毛有明显不同。而有些菌毛直径大部分为2~4 nm,呈长的丝状或卷曲有弹性型。
3.1.2 铁离子摄取系统
铁离子对所有生存着的微生物来说是必需的营养成分,并且作为基本酶反应体系的成分,参与有氧代谢、电子专用过程、DNA或RNA的合成。但环境中的铁是以不溶的矿物质形式存在的,动物体内的铁则与铁结合蛋白紧密结合,因此,细菌环境中游离铁的浓度非常低(10-12mol/L)不能满足细菌生长繁殖的需求10-7mol/L)。为了在一个限铁的环境中生存和繁殖,大肠杆菌特异性的建立起高亲和性的铁摄取系统,通过释放称作铁载体的小分子物质来应对许多缺铁性的生长环境,然后他们能利用特异性的转运系统再摄取这些螯合了铁的铁载体[8]。大肠杆菌的摄取铁离子系统的机制主要包括产生铁结合性复合物和溶血素。铁结合性复合物包括羟偶基/气杆菌素(Hydroxymate/aerobactin)和酚盐/肠杆菌素(phenolate/enterobactin)。气杆菌素为含一个或多个氧化型肽键的复合蛋白,由质粒编码。肠杆菌素为含一个或多个2,3-二羟基苯基团的复合物,由染色体编码。相较而言,气杆菌素比肠杆菌素更适合于从血清中摄取铁。而且与肠杆菌素不同的是,气杆菌素在将运载的铁释放入细胞内后,还可循环利用。溶血素可能是一种辅助毒力因子。细菌的溶血性往往与其毒力平行,有溶血性的毒株毒力较强,溶血后产生足够的铁离子以供细菌生产,有利于侵入性感染[9]。
3.1.3 抗机体杀菌因子
由质粒编码的外膜蛋白(OMP)有助于细菌对宿主细胞的吸附并有助于细菌逃逸机体免疫防御,最后外膜蛋白可作为运铁产气杆菌素的受体协助将铁摄入细胞内,有利于细菌在低铁环境下生长、繁殖。脂多糖(LPS)与OMP存在一定的关系,研究表明,LPS是OMP A蛋白作为TuⅡ受体所必需的,OMP免疫伴随LPS抗体的产生同时产生[10]。
3.2 分子致病机制(遗传基因学)
EIEC的毒力因子通常都由可变性的、可以用来重组形成新菌株的基因原件或曾经为可变性的基因元件而已被重组为基因组的基因元件所编码,并且在宿主内能将致病性毒力因子与基因组重组产生突异性的致病性菌株才能成功存活下来,而控制这些毒力因子的基因可以由染色体以外的基因(如质粒)编码,也可以是染色体上的某些特殊片段[11]。因此,完整的EIEC毒力涉及到一套编码在质粒和染色体上的基因,主要有由毒力质粒和编码在染色体上his(组氨酸)、kcp(豚鼠角膜结膜炎)、ha-xyl(鼠李糖-木糖)、ldc(赖氪酸脱援酶)等基因片段。
3.2.1 编码在染色体以外的毒力因子基因
EIEC的侵袭力是由质粒控制的,质粒可转移给无毒力菌株,消除质粒,杆菌即丧失其侵袭力[11]。侵袭包括原发和扩散两个过程。Sansonetti和Harris等先后证实EIEC的侵袭性质粒分子量为120~140 Md[12-13],该质粒可编码15种以上外膜蛋白,可控制多种毒力因子,其中有6~7种是与侵袭力有关的外膜蛋白,并可产生完全抗体。组侵袭性外膜蛋白(Ipa)为大质粒所共有.它们是IpaA(78 kd)、IpaB(57 kd)、lpaC(43 kd)、lpaD(57 kd), 受 质 粒DNA37 kd的EcoRI酶切点控制.该序列中尚有二个EcoRI酶切点.产生76、118和17 kd三个攻级片断段.而这三个次级片段均不能单独表达对Hela细胞的侵入功能,只有按固定顺序结合在一起方可表现侵入特性,进而证明这三个片段与侵袭基因相关。
组侵袭性外膜蛋白Ipa由EIEC复杂针管状组织的III型分泌系统所产生,起介导上皮细胞信号传导、改变细胞膜结构、溶解细胞内空泡等作用[14]。III型分泌装置能使带有微孔结构的IpaB和IpaC插入到宿主细胞膜。IpaA则能诱导肌动蛋白脱聚合,与IpaC协同作用,共同促使EIEC侵入宿主细胞。IpaB除形成微孔外,还能结合信号蛋白,改变细胞结构,并能与巨噬细胞caspase-1结合,诱导细胞凋亡和IL-1的释放。IpaC具有诱导肌动蛋白聚合功能,引起细胞延长。IpaD是转移效应因子,有4-肌醇磷酸激酶活性,通过打开细胞浆膜与细胞骨架肌动蛋白连接,在细胞膜上形成泡状结构,从而改变宿主细胞的形态。Ipa抗体有被动免疫保护性作用,可阻断EIEC侵入上皮细胞.而E1EC脂多糖抗体没有上述的阻断作用,说明lpa在抗感染过程中起重要作用。
此外,EIEC的毒力质粒上还编码一种E蛋白,它能结合刚果红染料(copgo red),为刚果红试验阳性(Cr+),无毒株则为Cr-。Cr基因和质粒上的毒力基因VirF片段椰注。Cr基因转给E.coil,E.coil可以变成Cr。Cr基因位于BamHI和EcoRI的45 kb片段内。它的表达也受培养温度的调节。除此之外,140 Md质粒上还能编码细胞结合溶血素或称接触性溶血素。其功能还不十分清楚,仅知它与细菌在细胞内逃避胞内空泡的吞噬和向邻近细胞扩散有关。EIEC的毒力与志贺菌毒力一样不稳定,主要是质粒易丢失,一旦丢失EIEC就丧失致病力。
3.2.2 编码在染色体上的毒力因子基因
毒力岛是位于细菌染色体上成簇分布的编码毒力相关基因的片段,该片段是一大的具有流动性的特定区域,可能是通过噬菌体介导的水平转移所获,是赋予细菌致病性和毒力的重要因素之一,它最初是由德国微生物学家Hacker及其同事在研究泌尿道大肠杆菌UPEC536与J96菌株遗传基础时提出来的,随后人们发现许多病原微生物中存在毒力岛。
毒力岛相对分子质量大、编码许多与毒力相关的基因,其两侧具有重复序列、整合酶位点和插入元件,G+C mol%和密码使用与其宿主菌有明显差异、具有不稳定性;毒力岛常位于染色体的tRNA位点内或附近,或者位于与质粒、噬菌体整合有关的位点,毒力岛编码的基因产物多为分泌性蛋白和细胞表面蛋白,如溶血素、菌毛、血红素结合因子等;一些毒力岛编码细菌的分泌系统(如III型分泌系统)、信号传导系统和调节系统等[10]。目前在致病性大肠杆菌中发现的毒力岛主要有:耶尔森菌强毒力岛(The Yersinia High-pathogeniticity island,HPI)、肠细胞脱落位点(Locus of enterocyte effacement,LEE)毒力岛和OI毒力岛等。耶尔森菌HPI广泛分布于肠道致病菌中,主要含有与铁摄取有关的毒力基因簇,编码参与合成及摄取铁载体耶尔森杆菌素( yersini-abactin) 的铁抑制蛋白irp (iron-repressible protein) 基因及其调控基因,行使铁摄取功能[8-9]。Schubert等[15]1998年发现93 %的肠凝集性大肠杆菌、27 %的肠侵袭性大肠杆菌、5%的肠致病性大肠杆菌和肠产毒性大肠杆菌具有irp2-fyuA 基因簇。目前多数研究表明,耶尔森菌HPI的相对不稳定性与其在肠道杆菌不同种属间的广泛分布,是通过毒力岛基因水平转移获得的,毒力岛的水平转移机制主要包括毒力岛的删除和整合机制。耶尔森菌HPI两侧含有整合酶、正向重复序列IS100等与同源重组有关的位点,这些基因在整合和删除时发挥重要的作用。毒力岛基因水平的转移是杆菌等致病性大肠杆菌进化的原动力之一,它参与了肠道致病菌遗传上质的飞跃的进化过程,从而促进宿主菌的新陈代谢,更能适应外周环境和宿主环境,增强其致病性。
不论毒力岛在供体菌中的结构如何完整,转移机制如何完善,毒力岛在转移到宿主菌后还是会发生基因片段的缺失,这些缺失可能是宿主菌为适应周围不同的环境而导致的。
4 EIEC的病原学检测与鉴定
通常很难把EIEC与志贺氏菌和其他非致病性大肠杆菌分离开。传统的方法是采用血清型鉴定,生化试验和Sereny试验。Sereny试验的原理是利用EIEC可以侵入上皮细胞和在细胞间传播的能力进行鉴定[16]。由于传统方法在操作上比较复杂,目前报道有两种多聚核酸探针的方法来鉴定EIEC和志贺氏菌。其中之一是pMR17,这是从志贺氏菌血清型5中分离到的pInv质粒上得大小为17 kb的ECorI片段[17-18]。另外一种多聚核酸探针是ial,这是从EIEC分离到的pInv质粒上得大小为2.5 kb的HindIII 片段。这两种探针对EIEC都有100%的敏感性和特异性。另外针对ial的21 bp的引物与多聚探针具有相似的敏感性和特异性[19]。Pal等建立了检测ipaC基因的ELISA方法,ipaC基因位于EIEC和志贺氏菌的Inv质粒上[20]。采用这种方法,实验者从由儿童粪便中分离到的菌群中检测到EIEC和志贺氏菌。这种方法由于其他检测方法的地方在于它耗费低,而且不需要精密仪器和动物。
5 小结
EIEC致病是一个多方面因素都参与的最终表现结果。但是具体的致病机制,目前仍没有研究得十分透彻和详细。随着毒力岛的深入研究,人们已经认识到是多个毒力因子相互协同作用,毒力岛不仅赋予病原体特殊的致病能力,介导感染过程的特殊阶段,而且在杆菌进化过程中扮演着重要的角色。因此,以杆菌致病过程中参与的致病因子作为突破口,解析毒力岛的进化机制和调控机制有助于对EIEC疾病进行更有效的治疗和预防,并为控制EIEC疾病提供可靠的理论依据。
[1] DuPont H L,Formal S B,Hornick R B,et al.Pathogenesis of Escherichia coli diarrhea[J].N Engl J Med,1971,285(1):1-9.
[2] Kaper J B,Nataro J P,Mobley H L,et al.Pathogenic Escherichia coli.[J].Nat Rev Microbiol,2004,2(2):123-140.
[3] Kauffmann F.The serology of the coli group[J].J Immunol,1947,57(1):71-100.
[4] Ewing W H. The nomenclature of Salmonella,its usage,and de fi nitions for the three species[J].Can J Microbiol,1972,18(11) :1629-1637.
[5] Lior L,Litt M.Vancomycin-resistant enterococci on a renal ward in an Ontario hospital[J].Can Commun Dis Rep,1996,22(15):125-128.
[6] McDaniel T K,Jarvis K G,Donnenberg M S,et al. A genetic locus of enterocyte effacement conserved among diverse enterobacterial pathogens[J]. Proc Natl Acad Sci USA,1995,92(5):1664–1668.
[7] Reddy M A,Wass C A,Kim K S,et al. Involvement of focal adhesion kinase in Escherichia coli invasion of human brain microvascular endothelial cells[J]. Infect Immun,2000,68(11):6423–6430.
[8] Khan M A,Isaacson R E. Identification of Escherichia coli genes that are specifically expressed in a murine model of septicemic infection[J]. Infect Immun,2002,70(7):3404–3412.
[9] Perna N T,Gruy D,Valeie B,et al.Genome sequence of enterohaemorrhagic Escherichia coli O157:H7[J]. Nature,2001,409:529–533.
[10] Kenny B,Devinney R,Stein M,et al. Enteropathogenic E.coli (EPEC) transfers its receptor for intimate adherence into mammalian cells[J]. Cell,1997,91:511–520.
[11] Buchrieser C,Glaser P,Rusnio K C,et al. The virulence plasmid pWR100 and the repertoire of proteins secreted by the type III secretion apparatus of Shigella fl exneri[J].Mol Microbiol,2000,38(4):760-771.
[12] Harris J R,Mariano J,Joy G,et al. Person-to-person transmission in an outbreak of enteroinvasive Escherichia coli[J].Am J Epidemiol,1985,122(2):245-252.
[13] Sansonetti P J,Phalipon A. Caspase-1 activation of IL-1beta and IL-18 are essential for Shigella flexneri-induced in fl ammation[J].Immunity,2000,12(5):581-590.
[14] Tran Van Nhieu G,Bourdet-Sicard R.Bacterial signals and cell responses during Shigella entry into epithelial cells[J].Cell Microbiol,2000,2(3):187-193.
[15] Schubert S,Rakin A. Prevalence of the “high-pathogenicity island” of Yersinia species among Escherichia coli strains that are pathogenic to humans[J].Infect Immun,1998,66(2):480-485.
[16] Oelschlaeger T A,Barrett T J.Some structures and processes of human epithelial cells involved in uptake of enterohemorrhagic Escherichia coli O157:H7 strains[J].Infect Immun,1994,62(11):5142-5150.
[17] Gomes T A,Toledo M R. DNA probes for identification of enteroinvasive Escherichia coli[J].J Clin Microbiol,1987,25(10) :2025-2027.
[18] Wright D J,Chapman P A. Immunomagnetic separation as a sensitive method for isolating Escherichia coli O157 from food samples[J].Epidemiol Infect,1994,113(1):31-39.
[19] Frankel G,Riley L. Detection of Shigella in feces using DNA ampli fi cation[J].J Infect Dis,1990,161(6):1252-1256.
[20] Pal T,Al-Sweih N A. Identification of enteroinvasive Escherichia coli and Shigella strains in pediatric patients by an IpaC-specific enzyme-linked immunosorbent assay[J].J Clin Microbiol,1997,35(7):1757-1760.
