表皮生长因子在荥经长毛兔肠道中的表达特征
2012-08-14郭红瑞
郭红瑞,何 敏,吴 雪
(四川农业大学动物医学院 动物疫病与人类健康四川省重点实验室,四川雅安625014)
表皮生长因子(epidermal growth factor,EGF)于1959年由美国生物学家Cohen S[1]首次从小鼠颌下腺中提取,并于1962年被提纯。经研究证明,EGF是一种由53个氨基酸残基组成的单链多肽类活性物质,因具有促进表皮增厚及角质化而得名,是动物体内重要的生长因子之一,其具有广泛的生物学活性[2-3]。EGF可以参与细胞内的DNA、RNA、蛋白质以及细胞外大分子的生物合成等过程。EGF通过与细胞膜上的EGF受体(EGFR)结合,从而诱导受体自身磷酸化,激活受体酪氨酸蛋白激酶活性,催化多种底物蛋白酪氨酸残基(Tyr)磷酸化,启动、催化、维持与细胞生长增殖有关的一系列生化过程[4]。在胃肠道内,表皮生长因子(EGF)能参与保持胃肠道黏膜的完整和通过刺激多种细胞的分裂增殖修复胃肠道黏膜[5],这些细胞主要是表皮细胞和内皮细胞。目前,大量相关基础和临床研究表明EGF与胃肠道疾病有密切关系。
荥经长毛兔(Yingjing Angora rabbit)属于兔形目兔科,是2005年通过四川省畜禽品种委员会审定命名的中型细毛型长毛兔新品系,由四川省荥经县畜牧局、四川农业大学、雅安市畜牧局联合培育而成,其遗传性能、产毛性能稳定,繁殖能力较强[6]。此外,兔子也是一种医学方面常用的实验动物。目前越来越多的学者将注意力集中到EGF对动物胃肠道黏膜保护作用及营养物质的吸收方面[7-8],但对EGF在健康动物肠道各部位的分布和形态研究较少。鉴于此,本研究对健康状况下荥经长毛兔肠道各部位EGF表达水平进行检测,旨在为荥经长毛兔胃肠道的研究积累资料,同时对荥经长毛兔以及其他兔类肠道疾病的治疗提供基础资料。
1 材料与方法
1.1 材 料
1.1.1 实验动物 4月龄~8月龄健康荥经长毛兔共12只,雌雄各半,体重(2.5±0.5)kg,均购自四川省雅安市荥经县长毛兔养殖场。
1.1.2 试剂 浓缩型兔抗人EGF多克隆抗体(产品编号:BA0250),DAB(产品编号:AR1022),SABC试剂盒(产品编号:SA1022)均为武汉博士德生物工程有限公司产品。
1.2 方 法
1.2.1 样本采取 荥经长毛兔进行颈动脉放血处死,迅速取出十二指肠、空肠、回肠、盲肠、结肠和直肠,每段组织0.5cm左右,以Bouin氏液固定保存。
1.2.2 组织制片和染色 固定好的组织按常规脱水透明,石蜡包埋,用LEICA RM 2135型石蜡切片机切片,厚5μm。切片贴附于经多聚赖氨酸处理的载玻片上,60℃烘烤2h,脱蜡复水后,以30mL/L H2O25min~10min灭活内源性过氧化物酶,蒸馏水洗净后,用0.01mol/L枸橼酸盐缓冲液进行热抗原修复(中火10min~15min),滴加50mL/L BSA封闭液,室温孵化20min,PBS洗,加入一抗(1∶100)4℃过夜,PBS洗,生物素化二抗37℃中孵化20min,PBS洗,SABC 37℃中孵化20min,DAB显色,苏木素复染,常规脱水、透明、封片。每个部位进行抗体反应时均以相邻切片作为对照片,对照组以PBS替代一抗,其余步骤同上。
1.2.3 显微摄像、图像分析及数据处理 将制得的切片在显微镜下观察、记录。用NIS-Elements F 3.2成像软件对每个部位随机取18个高倍(40×10)视野。对图像用形态学分析软件测定每个视野EGF的平均光密度值。对所得的数据用SPSS1 6.0软件进行显著性分析。结果用平均值±标准差(±sD)表示。
2 结果
在免疫组化染色的切片中,EGF阳性产物呈黄色和棕黄色,底色呈浅蓝色,反差明显易辨认。阴性对照呈阴性。
2.1 EGF在荥经长毛兔肠道组织的分布特征
在荥经长毛兔肠道各部位都有EGF的分布,但在各个部位的分布特点有一定差异。EGF主要分布在十二指肠固有层细胞胞质中。在空肠,EGF主要分布在固有层细胞胞质中。此外,在少量肠黏膜上皮细胞胞质中也发现EGF分布,在肠腺上皮细胞胞质中间也有发现,但极少。
EGF在回肠中主要分布在固有层细胞的胞质中。在黏膜上皮细胞细胞的胞质中有少量的EGF分布。回肠中黏膜上皮细胞中EGF的分布量比在空肠中分布的要多。在黏膜下层细胞胞质中也有一定量的EGF分布,偶尔可见有EGF分布在肠腺上皮细胞的胞质中。
盲肠、结肠、直肠中EGF的分布位置基本相同,主要分布在固有层细胞的胞质中。在黏膜上皮细胞的胞质中也有EGF分布,其分布量和空肠相近。
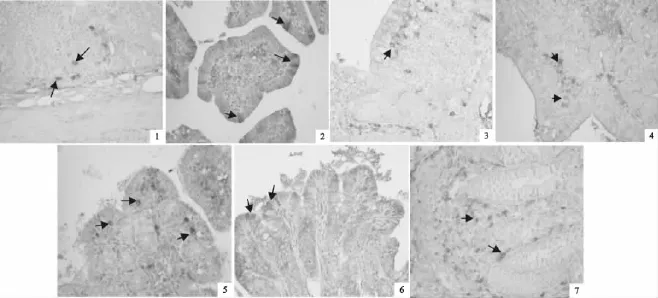
图1 EGF在荥经长毛兔肠道的分布Fig.1 Distribution of epidermal growth factor(EGF)in intestine of Yingjing Angora rabbit
在肠道各段之间EGF阳性细胞的形态略有差异,在固有层中细胞主要以圆形和不规则形为主,也有锥形、椭圆形和梭形,在肠黏膜上皮分布的EGF细胞形态主要是椭圆形和梭形,在肠腺上皮分布的EGF细胞都是圆形。
2.2 EGF阳性细胞在各部位平均光密度值及其比较
EGF在肠道各部位平均光密度值存在一定的差异其中盲肠的平均光密度值最大,其次为结肠、空肠、直肠、十二指肠、回肠。在整个肠道的EGF的分布起伏不大,只有在盲肠和结肠的分布出现升高,在其余部位无显著差异。对各个部位EGF平均光密度值用SPSS软件进行显著性分析,各部位的平均光密度值进行Duncan多重比较后的结果如表1所示,其中盲肠部位所测的平均光密度值最高(P<0.01),其次是结肠(P<0.05),在十二指肠、空肠和直肠差异不显著。
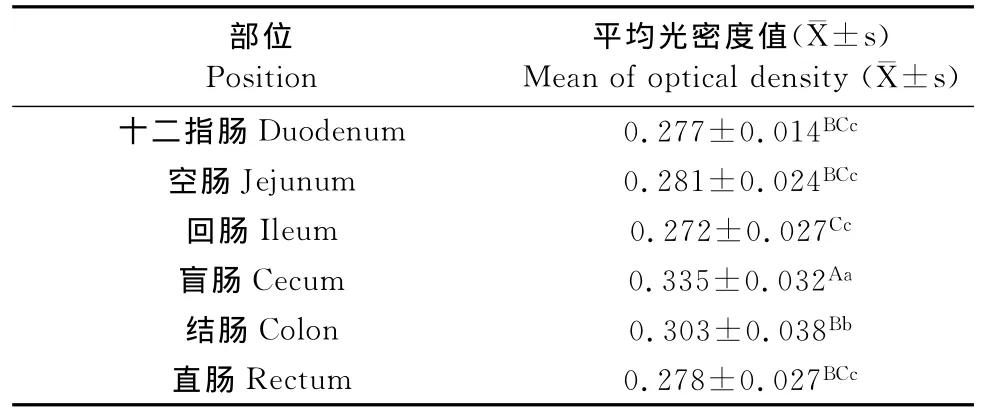
表1 肠道各部位EGF的平均光密度值Table 1 The average optical density of EGF in intestinal tract
3 讨论
3.1 EGF在荥经长毛兔肠道的分布形态特点
已有学者[9]研究认为EGF的分泌方式有:①自分泌:细胞产生EGF的同时产生EGFR,作用于自身细胞。涉及损伤的愈合,肿瘤和胚胎的发生。②旁分泌:细胞产生的EGF作用于另一种EGFR的细胞。如胃黏膜干细胞产生EGF作用于附近的黏膜细胞。③内分泌:EGF经过管道作用于一定距离的细胞。如腮腺分泌的EGF作用于口腔黏膜上皮。而在对人肠道[10]EGF的研究中认为肠绒毛上皮细胞、固有层细胞、内皮细胞和浆膜上皮细胞都能够合成并分泌EGF蛋白,而且还能表达其受体,表明内源性EGF通过自分泌和旁分泌方式与受体特异性结合发挥作用。而有研究认为肠道的肠绒毛上皮细胞、隐窝上皮细胞等许多细胞的细胞膜表面有EGFR存在[11],所以在肠道的EGF可以通过多种方式分泌与EGFR结合。目前对EGF所在细胞的形态研究较少,在对荥经长毛兔肠道EGF所在细胞的形态进行观察,可以发现有EGF分布的肠黏膜上皮细胞的形态主要是椭圆形和梭形,其突起指向肠腔和肠固有层,固有层中EGF细胞的形态为锥形或梭形,其突起指向旁边的细胞,并且可看到有EGF蛋白颗粒从突起分泌出,从形态学上可以推断这种细胞可以将EGF分泌到另一种细胞,与该细胞的EGFR结合而发挥作用,EGF的旁分泌功能。固有层内EGF细胞的形态主要是圆形,该圆形的细胞可能是产生EGF然后作用于自身,自身细胞存在EGFR并与其结合发挥作用,从而发挥EGF自分泌功能。因此本研究结果提示,在荥经长毛兔肠道的内源性EGF通过自分泌和旁分泌的方式与细胞膜上的EGFR结合发挥保护肠黏膜作用。至于在肠道的EGF是否有内分泌功能还不能确定,有待进一步深入研究。
3.2 EGF在荥经长毛兔肠道的分布特点
家兔为草食动物,其肠道特别长。肠道包括大肠和小肠,小肠有十二指肠、空肠、回肠,空肠为最长的一段,回肠肠壁上血管较少,回肠和盲肠相接处有一圆小囊为兔特有。大肠有盲肠、结肠、直肠,所有家畜中兔的盲肠比例最大,在盲肠壁上有两块明显的淋巴组织称为盲肠扁桃体结构和圆小囊相似,盲肠的游离端为蚓突,其结构也与盲肠扁桃体相似,含丰富的淋巴组织[12]。荥经长毛兔的肠道结构与其他兔类相比无明显差异。在肠道的消化作用方面,草食动物的大肠特别发达,食糜在大肠停留的时间很长,大肠在整个消化过程中占非常重要的地位,是机体能量的主要来源之一,大肠中的微生物作用促进饲料中纤维素、糖的分解吸收[13]。
肠黏膜在受到一定程度的损伤刺激后可启动修复机制,使肠黏膜迅速恢复完整性,这是肠道抵抗疾病的重要屏障能力[14]。本试验检测到EGF在荥经长毛兔消化道各段中均呈阳性反应,因此内源性EGF可能在肠道的损伤愈合过程中起重要作用,同时这一细胞因子可能是消化道上皮修复和再生的重要内源性调控因子。对荥经长毛兔肠道各部分的EGF分布的平均光密度值进行测定,在盲肠的光密度值最高,结肠其次。盲肠和结肠的平均光密度值与小肠有显著性差异。这表明在盲肠、结肠阳性反应比较强,EGF在这些部位分布较多。在盲肠阳性较强的原因可能是由于其特殊的结构和生理作用。从盲肠的生理作用可知兔子盲肠中有许多的细菌和微生物增加其动力,在小肠消化后的食糜进而运送到盲肠经行微生物发酵[15]。EGF对肠道有保护作用,有研究表明[16-17]EGF具有抑制细菌移位,通过抑制细菌在肠黏膜上的定植来实现对肠道的保护。通过上述资料推测可能是因为盲肠中细菌微生物太多对肠道组织可能有破坏作用,需要分布多量的EGF对肠道起保护作用。同时EGF又有影响营养物质的转运功能[18],或许在盲肠、结肠分布的多与其是消化吸收的重要器官有关。对于EGF在盲肠、结肠的作用机制还需进一步进行研究证明。在小肠EGF阳性细胞没有盲肠和结肠那么多可能是由于病害等刺激因素较少,而小肠的自身消化吸收能力较强,小肠中菌群较少,所以小肠组织中不需要太多的EGF分布。至于具体是什么原因还需进一步探究。
从目前众多学者对EGF的研究中表明,EGF是一种非常重要的多肽类生长因子,在维持动物肠道健康发挥着非常重要的作用。而在不同的动物肠道的分布位置有细小的区别,在对大鼠[19]和人[10]的肠道EGF的研究结果中显示,在大鼠小肠中EGF主要分布在小肠黏膜上皮细胞、固有层细胞和黏膜基层细胞胞浆中,表达强度为强阳性,在人的肠道中EGF主要分布在小肠黏膜上皮细胞、黏膜下层的血管内皮细胞和浆膜上皮细胞的胞浆和胞外基质中。在荥经长毛兔肠道中EGF主要分布在固有层细胞、肠黏膜上皮细胞胞质中,有极少数分布在肠腺上皮细胞胞质中。EGF分布的部位可能与其所起的作用有关,在观察的结果中EGF主要分布在各肠道的肠固有层细胞的胞质中,而固有层中含有肠腺、血管、淋巴管、神经等,还含有各种功能的结缔组织细胞,EGF可以通过自分泌和旁分泌的方式与EGFR结合发挥作用,EGF可提高小肠黏膜刷状缘水解酶及胰腺消化酶的活性,加强小肠和胰腺的分泌功能,加快细胞的分化和增殖,从而加快初生动物肠道的成熟,调节消化腺的分泌,刺激黏膜增生,影响营养物质的转运等[20],同时还可以防止E.coli等病菌侵入动物机体,并改善其受损肠道的消化机能[21],以预防肠道溃疡的发生,促进溃疡的愈合[22]。在陷窝中肠腺之间的固有层中也有EGF分布,而小肠黏膜上皮细胞来源于肠隐窝底部的干细胞[23],所以认为EGF具有诱导陷窝干细胞激活,快速增殖,从而修复肠道结构的作用[10]。此外,在肠绒毛上皮细胞的胞质中也发现有EGF的分布,并且在肠黏膜上皮细胞基部有梭形的EGF阳性细胞,其突起指向肠黏膜上皮细胞,推测可能是EGF阳性细胞分泌出EGF与肠黏膜上皮细胞的EGFR结合发挥作用来刺激肠道黏液的分泌,保护黏膜的机械屏障和化学屏障来减少细菌在肠黏膜上定植和移位[16-17],还能润滑食物减少粗糙食物对肠道的机械刺激[24]。总之,EGF对肠道各部分都有一定的保护和促进作用,对肠道具有重要意义。
[1] Cohen S.Isolation of a mouse submaxillary gland protein accelerating incisor eruption and eyelid opening in the newborn animal[J].J Biol Chem,1962,237(5):1555-1562.
[2] Pillai S B,Hinman C E,Luquette M H,et al.Heparin-blinding epidermal growth factor-like growth factor protects rat intestine from ischemia/reperfusion injury[J].J Surg Res,1999,87(2):225-231.
[3] Carpenter G,Cohen S.Epidermal growth factor[J].J Biol Chem,1990,265(14):7709-7712.
[4] 乐志培.表皮生长因子的受体功能与转化蛋白的关系[J].生命的化学(中国生物化学会通讯),1989,9(2):9-12.
[5] Dvorak B,Kolinska J,Mcwilliam D L,et al.The expression of epidermal growth factor and transforming growth factor-a mRNA in the small intestine of suckling rats:organ culture study[J].FEBS Lett,1998,435(1):119-124.
[6] 浦海平,邵 蓉,叶 玲.长毛兔遗传基因库的新成员-荥经长毛兔[J].中国牧业通讯,2010(7):39.
[7] Banan A,Farhadi A,Fields J Z,et al.Evidence that nuclear factor-kappa B activation is critical in inactivation is essential in epidermal growth factor-mediated protection of the monolayers of intestinal epithelia[J].J Pharmacol Exp Ther,2003,306(1):13-28.
[8] Xu H,Collins J F,Bai L Q,et al.Epidermal growth factor regulation of rat NHE2gene expression[J].Am J Physiol Cell Physiol,2001,281(2):C504-C513.
[9] 张 纲.唾液表皮生长因子在消化道黏膜损害修复中的作用[J].重庆医学,2003,32(12):1742-1744.
[10] 陈 伟,付小兵,孙同柱,等.表皮生长因子及其受体在胎儿和成年人肠道组织中的表达特征[J].中国修复重建外科杂志,2003,17(4):289-292.
[11] Dvorak B,Halpern M D,Hana H,et al.Epidermal growth factor reduce the development of necrotizing enterocolitis in a neonatal rat model[J].Am J Physiol Liver Physiol,2002,282(1):G156-G164.
[12] 董常生.家畜解剖学[M].北京:中国农业出版社,2001:339-341.
[13] 张庆茹.动物生理学[M].北京:中国农业科学技术出版社,2007:188-189.
[14] Playford R J.Peptides and gastrointestinal mucosal integrity[J].Gut,1995,37(5):595.
[15] Ian D,Hume.Disgestive strategies of mammals[J].Acta Zoologica Sinica,2002,48(1):1-19.
[16] Okuyama H,Urao M,Lee D,et al.The effect of epidermal growth factor on bacterial translocation in newborn rabbits[J].J Pediatric Surgery,1998,33(2):225-228.
[17] Elliott S N,Wallace J L,McKnight W,et al.Bacterial colonization and healing of gastric ulcers:the effects of epidermal growth factor[J].Am J Physiol Gastrointestinal Liver Physiol,2000,278(1):G105-G112.
[18] Ray E C,Avissar N E,Vukcevic D,et al.Growth hormone and epidermal growth factor together enhance amino acid transport system B0,and A in remmant small intestine after massive enterectomy[J].J Surg Res,2003,115(1):164-170.
[19] 付小兵,孙同柱,孙晓庆,等.EGF与bFGF在大鼠不同发育阶段肠道定位和表达特征的比较研究[J].中国危重病急救医学,2001,13(7):407-409.
[20] Madsen K L,Brockway P D,Johnson L R.Role of ornithine decarboxycase in enterocyte mitochondrial function and integrity[J].Am J Physiol,1996,270(5):G789-G797.
[21] Buret A,Olson M E,Gall D G,et al.Effects of orally administered epidermal growth factor on enteropathogenic Eschorichia coli infection in rabbits[J].Infection Immunity,1998,66(10):4917-4923.
[22] Tunio A M,Hobsley M.Epidermal growth factor is salive and gastric juice:response to histamine[J].Gut,1995,37(3):335-339.
[23] Slorach E M,Campbell F C,Dorin J R.A mouse model of intestinal stem cell fuction and regeneration[J].J Cell Science,1999,112(15):3029-3038.
[24] 吴秀群,王 辉,贾 刚,等.表皮生长因子对动物肠道健康的影响[J].云南农业大学学报,2011,26(1):110-116.
