空肠弯曲菌的培养及其PCR鉴定研究
2012-08-14杨胜男郑增忍张乐萃曲志娜黄秀梅李玉清
杨胜男,郑增忍,张乐萃,王 娟,曲志娜,黄秀梅,李玉清
(1.青岛农业大学,山东青岛266109;2.中国动物卫生与流行病学中心,山东青岛266032)
弯曲菌(Campylobacter)是重要的食源性人兽共患病原菌[1],可引起人和动物的各种疾病,如人类发热、急性肠炎和格林-巴利综合征[2-3]。在兽医学上,可引起家畜流产、不孕、乳房炎及幼畜禽腹泻和家禽肝炎[4]。家畜和野生鸟类是其常见宿主,人类常因为摄入被污染的食物和饮水而感染[5]。而家禽类尤其是鸡源产品更是弯曲菌感染传播的重要途径[6]。因此,研究弯曲菌具有重要的公共卫生学意义[7]。弯曲菌培养条件十分苛刻,25℃不生长,42℃生长较好,微需氧条件,普通培养基上生长不良,生长需要万古霉素、多黏菌素B等抗菌药物的血琼脂培养基[8-9]。而常规生化鉴定则耗时费力,过程复杂。本试验优化了弯曲菌的分离培养过程,以利于后续检测工作的进行,并建立空肠弯曲菌的PCR检测鉴定方法。
1 材料与方法
1.1 材料
1.1.1 菌株来源 空肠弯曲菌标准菌株ATCC 33560由中国动物卫生与流行病学中心实验室提供,大肠埃希菌ATCC25922购自中国兽药监察所,金黄色葡萄球菌标准菌株ATCC 29213购自中国药品生物制品检定所。
1.1.2 试剂及培养基 弯曲菌CCDA琼脂、哥伦比亚血琼脂基础为英国OXOID公司产品;绵羊全血为青岛海博生物科技公司产品;TTC琼脂为北京陆桥生物科技公司产品;2×Taq PCR Master Mix、PCR Marker为宝生物工程(大连)有限公司产品;厌氧罐、微需氧产气袋为日本MGC公司产品;常规试剂为国产分析纯试剂。
1.1.3 样本采集 采集青岛地区鸡盲肠包装,低温条件下运送至实验室。
1.2 方法
1.2.1 细菌培养 用接种环沾取少量鸡盲肠内容物,划线接种到CCDA选择性培养基上,置于微需氧培养罐内,42℃培养48h。进行2次传代培养,选取可疑菌落接种于TTC琼脂平板培养,阳性者为紫色菌苔并有光泽,挑取单菌落接种于哥伦比亚血琼脂培养基进行纯培养。
1.2.2 菌株API鉴定 挑选出氧化酶阳性的菌株,用接种环从哥伦比亚血琼脂培养基上选取纯培养物,制成6麦氏单位的菌悬液,根据弯曲菌API鉴定条(API20800)说明进行操作接种并培养,判读培养结果,查阅API20800鉴定标准进行菌株鉴定。
1.2.3 PCR方法的建立
1.2.3.1 PCR引物设计与合成 根据GenBank上发表和Nielsen等[10-12]报道的序列,针对空肠弯曲菌16 S rRNA基因设计引物,上游引物为5′-CATCTTCCCTAGTCAAGCCT-3′,下游引物为5′-AAGATATGGCACTAGCAAGAC-3′,扩增产物长度为773bp。引物由上海生工生物工程技术服务有限公司合成。
1.2.3.2 模板DNA的提取 用接种环从哥伦比亚血琼脂培养基上挑取适量的纯培养物置于盛有1mL PBS的Eppendorf管中,13 500r/min离心5min,去上清。重复一次离心步骤后,用200μL TE(Tris-EDTA,10∶1)重悬沉淀,放入100℃沸水中煮沸5min~10min。取出置于冰浴中冷却5min后,13 500r/min离心3min,取上清液作为PCR模板。
1.2.3.3 PCR反应体系 模板DNA 2μL,上、下游引物(20pmol/μL)各0.5μL,2×TaqGreen Mix 12.5μL,灭菌蒸馏水补足至25μL。PCR循环参数:94℃ 5min;94℃ 1min,64℃ 1min,72℃1min,2个循环;94℃ 1min,62℃ 1min,72℃ 1 min,2个循环;94℃1min,60℃1min,72℃1min,2个循环;94℃1min,58℃1min,72℃1min,2个循环;94℃1min,56℃1min,72℃1min,2个循环;94℃1min,54℃1min,72℃1min,30个循环;72℃延伸10min。
1.2.3.4 PCR扩增产物的鉴定 10g/L琼脂糖凝胶按3mg/L加溴化乙锭(EB)制胶。取8μL PCR扩增产物加样。用DNA Marker DL 2 000对照。110V电压,电泳40min,置于凝胶成像系统拍照和分析电泳结果。
PCR产物的测序鉴定,取PCR产物送上海生工生物工程技术服务有限公司进行测序。
1.2.3.5 特异性试验 用本试验建立的PCR方法,对分离获得的空肠弯曲菌以及空肠弯曲菌ATCC、大肠埃希菌ATCC、金黄色葡萄球菌ATCC等对照菌株提取DNA进行检测,从而确定其特异性。
2 结果
2.1 细菌培养
本试验根据情况采用弯曲菌CCDA选择性培养基、TTC琼脂和哥伦比亚血琼脂基础培养基,弯曲菌在血琼脂培养基上不溶血,在CCDA选择性培养基上典型菌落形态为圆形,光滑,灰色,闪金属光泽,菌落较小且容易连成串珠状。TTC琼脂上成紫色发亮菌落,单菌落较明显,易于选取进行传代培养。哥伦比亚血琼脂上菌落呈浅灰色或黄褐色。
2.2 PCR方法的特异性
选用建立的PCR方法可扩增出空肠弯曲菌的特异性片段,而金黄色葡萄球菌ATCC,大肠埃希菌ATCC均不能扩增出特异性片段。通过凝胶成像系统对该特异片段进行迁移率计算,其大小为773bp,与预期的片段相符(图1)。
2.3 方法应用
应用上述建立的弯曲菌分离培养及PCR方法,我们从100份新鲜鸡盲肠样品中分离出23株空肠弯曲菌,分离率为23%。
2.4 PCR方法的验证
对PCR鉴定的空肠弯曲菌进行API验证,其鉴定结果与PCR结果一致。证明上述空肠弯曲菌PCR方法可应用在临床菌株分离鉴定工作中。
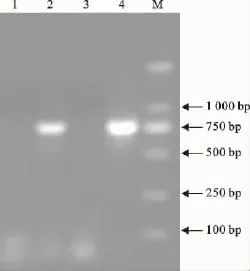
图1 PCR特异性试验Fig.1 The specificity test of PCR
3 讨论
盲肠内容物初代接种在CCDA选择性培养基上培养,容易生长出连成串珠状的菌落,对典型单菌落的选取造成干扰,不利于进行传代培养;而在TTC琼脂上进行生化鉴定,培养后长出的单菌落易于选取,利于纯化培养单菌落。结果表明,经过CCDA选择性培养,TTC琼脂培养后更容易选取典型单菌落,有利于回归接种CCDA培养基、哥伦比亚血琼脂培养基纯化菌株。为保存菌种和PCR鉴定提取模板提供有利条件。
何蕊等[13]应用mapA基因和16S基因建立的检测空肠弯曲菌、弯曲菌的PCR方法,可扩增出589bp的特异性片段和857bp的特异性片段,但部分肠道菌扩增出非特异性片段;娜仁高娃等[14]根据空肠弯曲菌hipO基因建立的PCR鉴定方法,并非所有空肠弯曲菌都能扩增出149bp特异性片段。本试验所建立的PCR方法有较强特异性,结果显示,空肠弯曲菌扩增出特异性条带,而其他参考菌株均未扩增出条带,说明该方法有较强特异性。
综上所述,经过优化的分离培养有利于纯化菌株,更有利于PCR鉴定检测及菌种的长期保存。
[1] Ekdah l K,Normann B,Andersson Y.Could flies explain the elusive epidemiology of campylobacteriosis[J].BMC Infect Dis,2005,5:11.
[2] Ang C W,van Doorn P A,Endtz H P,et al.A case of Guillain-Bajrre syndrome following a family outbreak of Campylobacter jejuni enteritis[J].Neuroimmunology,2000,(11):29-32.
[3] Prendergast M M,Moran A P.Lipopolysaccharider in the development of the guillain-barre syndroml and miller fisher syndrome forms of acute inflammatory peripheral neuropathies[J].Endotoxin Res,2000,6(5):341-359.
[4] Sandberg M,Nygard K,Meldal H.Incidence trend and risk factors for Campylobacterinfections in humans in Norway[J].BMC Public Health,2006,6:179.
[5] 吴蜀豫,张立实,冉 陆.弯曲菌及弯曲菌病的流行现状[J].中国食品卫生杂志,2004(1):58-61.
[6] Newell D.Campylobacters:epidemiology,ecology and the potential for control[J].World Poultry,2005,121(7):26-27.
[7] Allos B M.Campylobacter jejuni infections:update on emerging issues and trends[J].Clin Infect Dis,2001,32:1201-1206.
[8] 吴光先.用不同选择性平板和增菌培养基对空肠弯曲菌分离、传代和增菌的比较试验[J].中国人兽共患病杂志,1989(2):23-26.
[9] 吴 润.经济动物的空肠弯曲菌带菌调查和细菌分离培养研究[J].甘肃农业大学学报,1993,28(2):105-111.
[10] Nielsen E M,Engberg J,Madsen M.Distribution of serotypes of Campylobacter jejuni and Campylobacter coli from Danish patients,poultry,cattle and swine[J].FEMS Immunol Med Microbiol,1997,19(1):47-56.
[11] Keramas G,Bang D D,Lund M,et al.Development of a sensitive DNA microarry suitable for rapid detection of Campylo bacter spp[J].Mol Cell Probes,2003,17(4):187-196.
[12] Keramas G,Bang D D,Lund M,et al.Use of culture,PCR analysis,and DNA microarrays for detection of Campylobacter jejuni and Campylobacter coli from chicken feces[J].J Clin Microbiol,2004,42:3985-3991.
[13] 何 蕊.弯曲菌多重PCR检测方法的建立及其初步应用[J].扬州大学学报,2007,28(3):5-8.
[14] 娜仁高娃,陈 霞,吴聪明.鸡源空肠弯曲菌和结肠弯曲菌的临床分离及多重PCR鉴定[J].中国兽医杂志,2010,46(1):38-39.
