医用可降解镁合金的研究进展
2012-08-13邓国庆禹正杨
邓国庆 禹正杨
(南华大学附一医院肿瘤外科,衡阳 421001)
引言
1878年,Huse用镁丝结扎人体血管,拉开了镁合金应用于临床的序幕[1-2]。但由于镁在人体内降解速度过快、产生氢气过多等问题,一直困扰着国内外众多研究人员,限制了其应用于临床的脚步。但最近十年,由于新合金的开发、表面改性技术的完善,镁合金在耐腐蚀性、生物力学性方面有了很大的提高重新燃起了人们,对镁合金在医学领域应用研究的兴趣。
随着社会的进步,人们越来越意识到多种材料复合的发展前景可观,而如何开发新型合金材料,如何对医用金属材料进行特定的表面改性,以达到人们所预期的效果,是国内外众多学者一直所关注并努力的方向。目前应用比较广泛的医用金属合金材料如不锈钢、钴铬合金及钛合金仍存在着诸多的缺点,如不可降解性、体内腐蚀产生有毒金属离子造成局部过敏和炎症反应、再次手术取出增加患者的痛苦和医疗费用等等。相比这些金属合金材料,镁合金的可降解性能、良好生物相容性和力学性能,体现了其独特的优势。
1 合金元素在镁合金中的作用
合金元素能有效改善镁合金的力学性能和耐腐蚀性能,特别是稀土和其他金属元素的加入,如铝、锌、锂、锆、钙、硅、锰等。研究发现[3-4]:铝能起到固溶强化和沉淀强化作用;锌能提高铸件的抗蠕变性能,但其含量超过2.5%对合金的防腐蚀性能有负面影响;锰可以细化晶粒,提高镁合金的耐腐蚀性能;锂可以把镁合金的晶格结构从密排六方(HCP)改变成体心立方(BCC),以增强延展性和成型性;锆可以加强晶界,是一种有效的无铝结晶加工的镁合金剂;钙作为晶体精炼剂,可以提高合金的强度和抗蠕变性,减少微量的腐蚀速率,并且在人体中的耐受性良好;硅是有效的强化相,能与合金中其他元素形成稳定的硅化物,改善合金的蠕变性能;稀土元素具有独特的核外电子排布,在冶金、材料领域具有独特的作用,具有净化合金熔液,改善合金组织,提高合金室温及高温的力学性能,增强合金耐腐蚀性能等作用。
2 医用镁合金的研究
作为生物医用材料,保证对人体的安全性是材料的必备要求。镁有较低的血栓发生率和较好的生物相容性,是人体必需的微量元素,同时也被视为非致癌元素[5]。它既是组织的结构组成部分,也是构成生物体的基本要素,具有很高的全身中毒水平,每公升血清约 7~10 mg[6](人体内血清正常镁浓度:1.5~2.5 mmol/L相当于 3.6~6 mg),因此镁是很有潜力的可生物降解金属植入材料。
铝是众所周知的作为一种神经毒剂,与各种神经系统疾病,如老年性痴呆和阿尔茨海默病的现象相关。稀土元素如铈、镨和钇,有发生严重肝毒性的可能。显然铝和稀土似乎不是最好的合金元素。近几年,关于新型可生物降解的镁合金研究,以镁钙、镁锌[7]为多(见表 1)。
镁合金作为医用材料应用于不同部位所起的作用不同,对其耐腐蚀性能、表面形貌、生物力学强度的要求也有差别。随着新的镁合金开发,合金纯净度技术的提高,快速凝固工艺的纯熟,离子注入、激光和喷丸处理等新的表面改性技术出现,镁合金的内部结构和表面形貌有很大改进,生物力学强度和耐腐蚀性能也更高[8]。

表1 常见的生物镁合金[7]Tab.1 Common biomedical magnesium alloys[7]
2.1 骨固定材料
镁及镁合金作为潜在骨折固定材料,相比其他金属医用材料具有诸多的优势。镁及镁合金有较高的比强度和比刚度,纯镁的比强度为133 GPa/(g/cm3),是所有结构金属中最高的。骨小梁、松骨皮质分别为3~14.8 GPa和18.6~27 GPa,而镁的杨氏模量约为45 GPa,比其他金属更接近人骨的弹性模量,受外力作用时应力分布将更均匀,能有效降低应力遮挡效应,这使得镁合金作为可降解的骨植入材料应用十分吸引人。
镁合金的密度约在1.75~1.85 g/cm3之间,比纯镁(1.74 g/cm3)稍高,与人骨密度(1.75 g/cm3)接近,远低于 Ti6 A14 V的密度(4.47 g/cm3)。传统骨固定材料,虽然它们拥有较好的力学性能和生物相容性,但其弹性模量很大,对骨产生应力遮挡效应更强,持续影响最终会导致骨质疏松。有研究表明,长期植入(如钛合金)可能导致电化学腐蚀和磨损物的产生,因此可能导致炎症反应。而用镁合金作为骨固定材料,能够在骨折愈合的初期提供稳定的力学环境,逐渐而不是突然降低其应力遮挡作用,使骨折部位承受逐步增大乃至生理水平的应力刺激,从而加速愈合,防止局部骨质疏松和再骨折,符合理想接骨板的要求[9]。1938年,McBride描述了一种用Mg-Mn合金制作成的薄直角板和螺丝钉用于抗旋转接骨的手术方法[2],如图1所示,其中(a)为电锯切出一条直线骨槽,(b)为薄直角板和螺丝钉的安装。通过对合金元素的合理选取,配合涂层性能的有效改善,使合金材料降解速度达到人为可控,生物力学强度更为接近生理要求,这些一直是人们对医用合金材料的期望所在。作为骨固定材料,其降解速度与骨组织新生或者骨折愈合速度之间的匹配,是目前问题的关键。除此之外,镁合金生物力学强度、完善组织相容性的安全性分析评价系统等也有待进一步提高。

图1 手术方法。(a)切出一条直线骨槽;(b)抗旋转接骨[2]Fig.1 The operation technique.(a)Cutting out a linear bone trough;(b)Achieveing rotation-resistant osteosynthesis[2]
Rosalbino[10]对 Mg-2 Zn-0.2X(X = Ca,Mn,Si)与AZ91在林格生理溶液做对比评价发现,相比Mg-2Zn-0.2Ca、Mg-2 Zn-0.2 Si,AZ91 的初期耐腐蚀性能明显强于前两种,然而,在林格生理溶液中浸泡168小时后,由于氧化锰的形成增加了对氢氧化镁膜层的保护,使得Mg-2Zn-0.2 Mn的极化电阻比AZ91强了4倍,Mg-2 Zn-0.2Mn显示了其更好的耐腐蚀性能。另有研究表明:提高镁合金周边的 pH值从而保护防腐层,是控制镁腐蚀的适当方式,尤其是钙,增加零点几的百分比重量可以有效减少镁的腐蚀敏感性[11]。Erdmann等发现,MgCa0.8其降解率和机械完整性能保持2~3周的时间,用做骨植入材料是可行的,是一种值得期待的可生物降解植入材料[12]。可生物降解 CaMgZn大块金属玻璃可以促进新骨生成,加快骨愈合,但在某些区域由于合金快速降解能诱导骨溶解,稳定性有待进一步改善,但其作为骨固定材料显示巨大的潜力。
近年来,随着涂层技术不断改进,镁合金的降解时间和力学性能的维持时间有了很大的提高,钙磷盐是最常用的医用涂层材料[13](见表2),此前在骨科已成功用于骨水泥及其支架、钛涂料[13-14],其降解能诱导骨溶解,有待进一步改善,但其显示出作为骨固定材料的巨大潜力。具有良好的生物相容性和生物活性,对人体无毒、无害、无致癌作用,生理研究表明,钙、磷离子的释放增加,有利于促进骨结合和成骨,常用于抗磨损腐蚀和增加生物相容性,并作为涂料用于保护骨科器械性能。Witte等[15]发现:羟基磷灰石颗粒能稳定 AZ91为基体的镁合金材料,使其腐蚀更为均匀地进行;同时通过调整羟基磷灰石颗粒尺寸和分布能有效改善力学性能;与成骨细胞混合培养也具有很好的细胞相容性。体外试验表明,纳米羟基磷灰石增强镁锌锆复合材料(Mg-Zn-Zr/n-HA)比其他金属复合材料抗腐蚀性更强,细胞相容性更好[16]。Li等[17]证实含氟羟基磷灰石涂层能提高Mg-Zn合金的生物活性;细胞增殖分化功能并能降低生物降解速度.Wang等[18]发现钙缺乏羟基磷灰石涂层能与 Mg-Zn-Ca合金较好粘合,显著提高基板的耐腐蚀性。慢应变速率拉伸(SSRT)结果表明,羟基磷灰石颗粒涂层Mg-Zn-Ca合金的极限抗拉强度和断裂时间比没有涂层的Mg-Zn-Ca合金高。因此,羟基磷灰石颗粒有可能成为增强镁金属基复合材料的理想材料。

表2 钙磷盐用做骨科器械涂层[13]Tab.2 The calcium phosphate phases used to date for coatings in orthopaedic devices[13]
2.2 血管支架
传统的血管支架多为不锈钢、镍-钛合金或钴-铬合金,支架不可降解,植入后长期存在于体内易导致一系列并发症。如血管内膜功能失调;血管内皮化过程延迟;致栓塞反应;慢性炎症反应;支架处血管瘤发生;无法适应血管生长;支架内再狭窄;术后长期服用抗血小板药物造成出血等。而且极大地增加了同一病变处日后外科血管重建手术的难度。
生物可吸收支架看起来很有意义且蕴涵巨大潜力的原因是:一旦疾病治愈,支架就消失——解决了迟发性血管血栓形成和需要长期抗血小板凝聚治疗的问题,被看作是“支架的下一个前沿”。镁合金支架是可降解支架的代表,是最近几年研究的热点,很有可能取代目前临床上使用的永久性心血管支架,成为21世纪血管支架的主流。目前研究中的可降解镁合金支架有AE21(2%铝1%稀土元素)、AM60(6%铝0.3%锰)、WE43(4%钇0.6%锆3.4%稀有金属)、铼钇镁合金支架(5.2% ~9.9%铼3.7% ~5.5%钇)、镁锌锂合金支架、镁铝合金支架等。与其他不可降解材料相比具有独特的优势;良好的机械性能,植入后不易导致早期回缩;支架降解后可恢复血管正常收缩性;良好的组织相容性;植入后血管内皮化速度快;致血栓性低;支架降解后不影响血管的生长等特点。如果病人要求传统的重新介入治疗时,也不会出现需要外科医师努力去发现非金属片断的问题。尤其适合于患先天性心血管疾病的儿童。
2.2.1 支架在动物及人体的研究
图2所示是2003年德国Biotronik公司生产出第一款可吸收金属支架(absorbable metal stent,AMS),其中(a)所示重建模拟图中,一周期单位支架长4.54 mm,厚0.15 mm,由4个环连接组成。每个环由84476个8节点的线性减缩积分单元(C3 D8R)组成,每个单元长 20 μm(c)[19]。Di Mario等报告了此款血管支架(WE43镁合金制成)用于33个小型猪冠状动脉植入的实验结果[20],Peeters等报道了第一个外周支架植入治疗下肢严重缺血20例患者的的临床研究结果,初步结果显示支架没有引起任何过敏或毒性反应的症状[21]。几年前,镁合金血管支架曾成功治疗了一个左肺动脉先天性狭窄的早产婴儿,虽然婴儿体积小,但临床耐受性良好[22]。但在另一个新生患儿中,由于长时间再狭窄造成心脏功能严重受损,经复杂血管修复手术后植入可降解镁合金血管支架,患者耐受不良[23-24]。2007年对植入WE43镁合金冠脉支架的63例患者可吸收试验的一年期数据显示[25],患者无血栓形成,无其他不良反应。研究也显示支架在4个月后完全降解吸收,表明镁合金作为血管支架其降解速率仍然较快,因为过早的失去支撑作用很容易造成负性重构导致再狭窄[26]。最近在60例患者下肢动脉植入相同可降解镁支架的研究上显示,虽然可生物降解的金属支架技术有安全性保障[27],但远期看来(6个月)没有达到标准血管成形术治疗下肢缺血的效果。2009年,由中国科学院金属研究所与中国医科大学附属第一医院合作开发的可降解镁合金心血管支架动物植入实验首获成功。在长达4个月的实验中,14只实验动物(兔)存活良好,支架植入部位血流通畅,无血栓形成。该成果实现了镁合金支架的分段可控降解,有效避免在植入后期支架对血管壁的刺激而导致的内膜增生及再狭窄发生[28]。
2.2.2 支架改性
目前的研究主要集中在改进支架的涂层,使支架成为局部给药和内皮修复的媒介。支架表面进行修饰,可能改善血液接触性能;药物释放还可以减少再狭窄;加速内皮化等。PLP/PGA和聚乳酸生物可降解聚合物支架涂层加药物控释成为最近几年的研究热点。这些药物可以从支架涂层中释放,同时涂层碎裂也增加了支架的总降解时间[29-33]。Lu等报道制造的微弧氧化/聚L-乳酸(MAO/PLLA)复合涂层AZ81镁合金生物降解支架以控制涂层生物降解速度和药物释放率,对其体外评价表明,增加了耐腐蚀性和控制合金的降解速率,血液相容性较PLGA50/50(8%PTX)316 L不锈钢涂层明显要好,但其在体内的相关指标的评估有待进一步验证[28]。Biotronik公司生产的 AMS-3可降解药物涂层镁合金支架,其第一个猪模型中的动物试验表明,在安全性和有效性方面相比裸AMS镁支架有较好的效果[33-34],但仍存在诸多的不足。新研究的AMS-4旨在延长其降解时间防止内膜过早塌陷,配合药物洗脱以避免过多的内膜生长[35]。
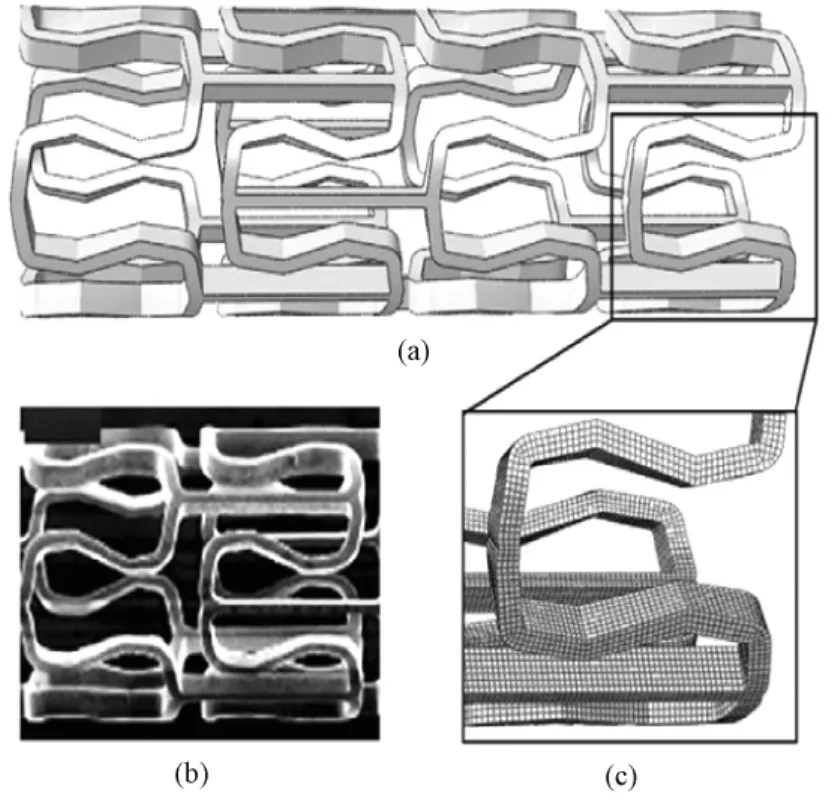
图2 镁合金支架。(a)支架模拟图;(b)支架实物图;(c)支架微观图[19]Fig.2 Magnesium Alloys.(a)The periodic unit of the stent geometry;(b)The adsorbable metal stent;(c)The detail of the mesh[19]
2.2.3 存在的问题
虽然镁合金的管腔内支架研究已经取得了较大进展,但研发尚处于起步阶段,技术略显不成熟,支架的降解时间太快仍然是目前制约临床应用的关键[3]。支架降解过程及其降解产物对靶血管和人体短期影响、长期有效性和安全性有待进一步验证。下一代的发展目标可能是生物降解金属支架的可控降解,长时间的机械稳定性和进一步减少内膜增生。这些目标主要通过设计新的合金成分和微观结构、新的支架支撑设计和使用的抗增殖药物涂层达到。
3 展望

图3 镁合金肠吻合器[2]Fig.3 Magnesium alloys used as intestinal connector[2]
镁合金用于医学领域,符合21世纪医学发展的趋势,虽其研究总体说来还处于探索起步阶段,广泛应用于临床还有待时日,但由于其诸多优点所在,使得它在医学领域的应用范围相当广泛。它在消化道重建方面也显示出惊人的应用潜力。因镁合金降解时间比胆道及肠管完全愈合时间相对较长,加之镁合金良好的生物相容性和力学性能等优点,完全能达到加压吻合所需的力度及加压吻合所维持的时间,同时可以减少异物长期存留体内所带来的一系列并发症等问题。1907年,德国学者Chlumksý报道了一种镁合金肠道吻合器的研究[2],如图3所示,包含一个子扣件和一个母扣件,同时镁合金做为弹簧片用于扣住两部分。随着技术的不断改进,其运用于胆道及肠管的加压吻合很可能再次成为21世纪胃肠外科的一个研究热点。另外,在多孔骨修复材料、牙种植材料、口腔修复材料的应用也潜力巨大。随着镁合金表面改性、表面涂层、新镁合金的开发等技术的逐步提高,新一代安全有效的镁合金作为医用材料应用于临床值得期待。
[1]Huse EC.A new ligature?[J].Chicago Med J Exam,1878:172.
[2]Witte F.The history of biodegradable magnesium implants:A review[J].Acta Biomaterialia,2010,6:1680-1692.
[3]Maryam M,Diego M.Biodegradable metals for cardiovascular stent application: interests and new opportunities [J].International Journal of Molecular Sciences,2011,12:4250-4270.
[4]黄晓峰,朱凯,曹喜娟,等.主要合金元素在镁合金中的作用[J].铸造技术,2008,29(11):1574-1578.
[5]Xu Ling,Yu Gang,Zhang Er,et al.In vivo corrosion behavior of Mg Mn Zn alloy for bone implant application [J].Biomed Mater Res A,2007,83:703-711.
[6]Peuster M,Beerbaum P,Bach F,et al.Are resorbable implants about to become a reality? [J].Cardiol Young,2006,16:107-116.
[7]Richard A,Lindtner P,Peter H,et al.Bone-implant interface strength and Osseointegration:Biodegradable magnesium alloy versus standard titanium control Christoph Castellani[J].Acta Biomaterialia,2011,7:432-440.
[8]Zeng R,Dietzel W,Witte F,et al.Progress and challenge for magnesium alloys as biomaterials[J].Adv Eng Mater,2008,10(8):B3-B14.
[9]Taki N,Tatro J,Nalepka J,et al.Polyethylene and titanium particles induce osteolysis by similar,lymphocyte independent,mechanisms[J].Orthop Res,2005,23(2):376-83.
[10]Rosalbino F, De Negri S,Saccone A, et al.Bio-corrosion characterization of Mg-Zn-X(X =Ca, Mn, Si)alloys for biomedical applications[J].Mater Med,2010,21:1091-1098.
[11]Wang Yinbing,Xie Xuhe,Li Huifan,et al.Biodegradable Ca-Mg-Zn bulk metallic glass for potential skeletal application[J].Acta Biomaterialia,2011,7:3196-3208.
[12]Nina E,Nina A,Janin R,et al.Biomechanical testing and degradation analysis of MgCa0.8 alloy screws:A comparative in vivo study in rabbits[J].Acta Biomaterialia,2011,7:1421-1428.
[13]Shadanbaz S,Dias G.Calcium phosphate coatings on magnesium alloys for biomedical applications:a review [J].Acta Biomater,2012,8(1):20-30.
[14]De J,Leeuwenburgh S,Beucken J,et al.The osteogenic effect of electrosprayed nanoscale collagen calcium phosphate coatings on titanium [J].Biomaterials,2010,31(9):2461-2469.
[15]Witte F, Feyerabend F, Maier P, et al. Biodegradable magnesium-hydroxyapatite metal matrix composites [J].Biomaterials,2007,28(13):2163-2174.
[16]Ye Xinyu,Chen Minfang,Yang Meng,et al.In vitro corrosion resistance and cytocompatibility of nano-hydroxyapatite reinforced Mg-Zn-Zr composites[J].Mater Med,2010,21:1321-1328.
[17]Li Jianan, Song Yang, Zhang Shaoxiang, et al. In vitro responses of human bone marrow stromal cells to a?uoridated hydroxyapatite coated biodegradable Mg-Zn alloy [J].Biomaterials,2010,31:5782-5788.
[18]Wang Huxing, Guan Sunkun, Wang Xu, et al. In vitro degradation and mechanical integrity of Mg-Zn-Ca alloy coated with Ca-deficient hydroxyapatite by the pulse electrodeposition processq [J].Acta Biomaterialia,2010,6:1743-1748.
[19]Gastaldi D,Sassi V,Petrinia L,et al.Continuum damage model for bioresorbable magnesium alloy devices— Application to coronary stents[J].Journal of the Mechanical Behavior of Biomedical Materials,2011,4:352-365.
[20]Di Mario C,Griffiths H,Goktekin O,et al.Drug-eluting bioabsorbable magnesium stent[J].Interv Cardiol,2004,17:391-395.
[21]Peeters P,Bosiers M,Verbist J,et al,Preliminary results after application of absorbable metal stents in patients with critical limb ischemia[J].Endovasc Ther,2005,12:1-5.
[22]Zartner P, Cesnjevar R, Singer H, et al.First successful implantation of a biodegradable metal stent into the left pulmonary artery of a preterm baby[J].Catheter Cardiovasc Interv,2005,66:590-594.
[23]Schranz D,Zartner P,Michel-Behnke I,et al.Bioabsorbable metal stents for percutaneous treatment of critical recoarctation of the aorta in a newborn[J].Catheter Cardiovasc Interv,2006,67:671-673.
[24]Mani G,Feldman Marc D,Patel D,et al.Coronary stents:a materials perspective [J].Biomaterials,2007,28:1689-1710.
[25]Erbel R,Di Mario C,Bartunek J,et al.Temporary scaffolding of coronary arteries with bioabsorbable magnesium stents:a prospective,non-randomised multicentre trial [J]. Lancet,2007,369:1869-1875.
[26]Heublein B, Rohde R, Kaese V. Biocorrosion of magnesiumalloys a new principle in cardiovascular implant technology? [J].Heart,2003,89:651-656.
[27]Bosiers M.AMS INSIGHT—absorbable metal stent implantation for treatment of below-the-knee critical limb ischemia:6-month analysis[J].Cardiovasc Interv Radiol,2009,32:424-435.
[28]秦可怡.可降解镁合金心血管支架实验获成功[N].中国知识产权报专利周刊,2009.
[29]Lu Ping,Fan Hua,Liu Yu,et al.Controllable biodegradability:drug release behavior and hemocompatibility of PTX-eluting magnesium stents[J].Colloids Surf B Biointerfaces,2010,83:23-28.
[30]Klocke B,Diener T,Fringes M,et al.Degradable metal stent having agent-containing coating[P].U S.20090030507,Jan 2008.
[31]Orlowski M,Rubben A.Bioresorbable metal stent with controlled resopption[P].WO 2008092436,Mar 2011.
[32]Asgari S.Biodegradable porous stent[P].WO.2008098922,Aug 2008.
[33]Waksman R. Current state of the absorbable metallic(magnesium)stent[J].Euro Interv Suppl.2009,5:F94-F99.
[34]Nieves G, Carlos M. Absorbable stent: focus on clinical applications and benefits[J].Vasc Health Risk Manag,2012,8:125-132.
[35]Waksman R,Erbel R,Di Mario C,et al.Early-and long-term ultrasound and angiographic findings after bioabsorbable magnesium stent implantation in human coronary arteries[J].Cardiovasc Interv,2009,2(4):312-320.
