组合型生态浮床中各生物单元对污染物去除的贡献及净化机理
2012-08-11王国芳汪祥静李先宁
王国芳,汪祥静,吴 磊,李先宁,b
(东南大学a.能源与环境学院;b.环境医学工程教育部重点实验室,南京210096)
水生植物浮床是用于净化富营养化水体如湖泊、河道的重要生态工程技术之一,具有适用条件宽、充分利用水面进行原位处理、造价低廉且运行管理容易等优点,目前已得到广泛应用[1-2]。但普通水生植物浮床仅种植水生植物,生物要素单一,构成完整生态系统的水生动物及微生物环节较为薄弱,限制了生态功能的发挥,有限的植物生物量也制约了其水质净化效能的进一步提高[3-4]。
笔者在普通水生植物浮床的基础上引入了水生动物,并增设了人工介质,构建了由水生植物单元(空心菜)、水生动物单元(三角帆蚌)及微生物强化单元(人工介质)组成的组合型生态浮床。前期研究表明,在水体交换时间为7d时,组合型生态浮床对TN、NH4+-N、TP、CODMn、Chl->a的平均去除率分别高于普通水生植物浮床15.5%、19.5%、15.1%、20.4%、26.1%,增加水生动物单元与微生物单元可提高浮床对污染物的去除效果,组合型生态浮床对富营养化水体的水质净化具有较好的应用前景。
为了进一步优化组合型生态浮床中各级生物配置、提高其净化效能,笔者通过对具有不同生物单元配置的组合浮床去除效能的比较,定量分析了组合型生态浮床中各生物单元对氮、磷、有机物及藻类去除的贡献率及净化机理。
1 材料和方法
1.1 组合型生态浮床的构造
按生物配置不同设置了A、B、C 3组组合浮床,其中组合型生态浮床C(水生植物单元+水生动物单元+微生物单元)试验装置如图1所示,整体为0.45m(长)×0.45m(宽)×1.0m(高)的长方体构造,分上、中、下3层结构,上层为水生植物区,种植水生经济植物空心菜,该区域高度为20cm;中层为水生动物区,挂养滤食性贝类三角帆蚌,该区域高度为30cm;下层为微生物强化区,悬挂兼具软性及半软性特征的人工介质,该区域高度为50cm。

图1 组合型生态浮床C结构示意图
其他2组组合浮床的生物配置如下:
组合浮床A:水生植物单元(空心菜)+水生动物单元(三角帆蚌);
组合浮床B:水生动物单元(三角帆蚌)+微生物强化单元(人工介质)。
各单元构造与组合型生态浮床C相同。
1.2 试验材料
试验中各生物单元所采用材料分别为:1)空心菜:各水生植物单元均采用空心菜。空心菜经清洗根系上附着的土壤后,原水中预培养2周,然后选取生长良好且相对均匀的植株用于试验,晾干称重后按相同重量(4 700g,湿重)、相近植株数量移植于浮床。2)三角帆蚌:各水生动物单元均采用三角帆蚌,其属于软体动物门瓣鳃纲珠蚌科帆蚌属,为滤食性贝类。试验用三角帆蚌购于安徽省某养殖基地,试验前将三角帆蚌在清水中放置2d,将脏物吐净,选取大小相近的三角帆蚌清洗晾干,称量约820g(36只)挂于浮床上,分别挂养在18个网兜中,在网兜中部打结,形成上下2层。3)人工介质:各微生物强化单元悬挂组合介质81串,每串上有盘片6片,填料盘片间隔为7cm。盘片上悬挂长度为3cm的丙纶丝束。在试验开始前,单独将人工介质在同样的进水条件下运行2个月,进行预挂膜,挂膜完成后开始试验。
1.3 试验装置
试验装置包括4个1.2m(直径)×1.6m(高)的圆形试验水槽,有效水深1.2m,其中1个不放置浮床,作为空白对照,其它3个分别放置浮床A、B、C 3种不同配置的组合浮床。原水为校区XX湖水,进水水质如表1。湖水经水泵提升进入集水桶,然后采用连续进水的方式平均输配到4个试验水槽中,试验水槽下端进水,上端出水,通过调节进出水流量,设定各试验水槽的水体交换时间为7d(试验流程如图2)。为减少生物生长周期等影响,实验周期设置为1个月,试验时间为2009年10月18日—11月18日。
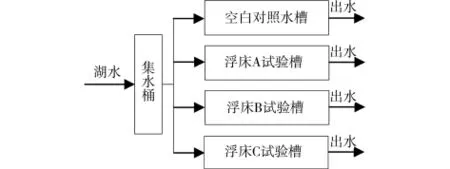
图2 试验流程图

表1 试验期间浮床进水水质
1.4 水样采集与分析方法
浮床稳定运行后,各试验水槽每2~4d采样一次,在同一时间段内取样。
水质项目包括进出水的TN、PN、TP、CODMn、TOC、DOC、Chl->a等。测定方法均采用国家标准方法[5]测定。
1.5 各生物单元去除率计算
考虑到试验条件下进水水质存在波动且水体交换时间长,水体内可能发生吸附、沉淀及降解等作用,为消除上述作用对去除效果的影响,准确评价浮床的净化效果,去除率计算扣除了空白对照水槽的去除效果,其计算方法为:

各不同生物单元对污染物去除率,通过不同生物配置浮床间对污染物去除率的差进行估算,计算方法如下:
水生植物单元的污染物去除率=浮床C的污染物去除率-浮床B的污染物去除率;
人工介质单元的污染物去除率=浮床C的污染物去除率-浮床A的污染物去除率;
水生动物单元的污染物去除率=浮床C的污染物去除率-水生动物单元的污染物去除率-水生植物单元的污染物去除率。
2 结果与讨论
试验期间,空白对照水槽及浮床A、B、C的出水各指标浓度及平均去除率如表2所示。
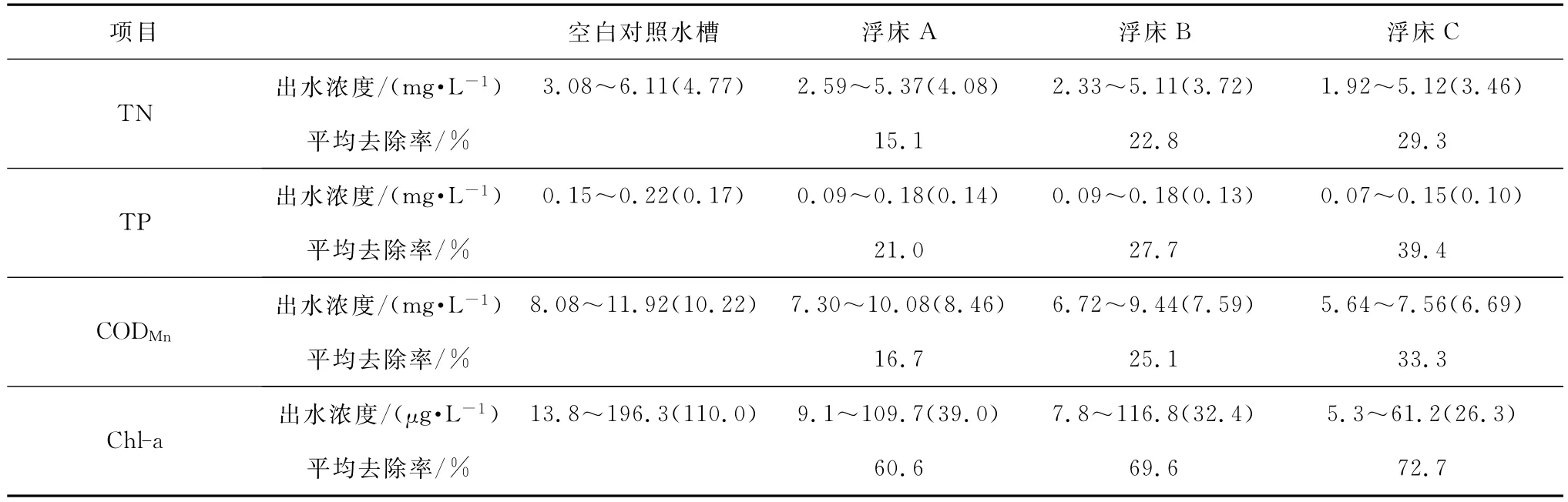
表2 试验期间浮床各指标出水浓度及平均去除率
2.1 对氮磷的去除贡献率
水体中过高的氮、磷是引起水体富营养化的主要原因,因此去除水体中氮、磷污染物对于减轻水体的富营养化程度具有重要意义。笔者研究了组合型生态浮床中各生物单元对氮磷的去除贡献率,分析了各生物单元的氮磷去除机理。
2.1.1 对氮的去除 图3表示了根据1.5节的估算方法计算得到的各生物单元对TN的平均去除率,水生植物单元对TN的去除率为6.5%,水生动物单元对TN的去除率为8.6%,人工介质单元对TN的去除率为14.2%。生态浮床各生物单元对TN的去除率表现为:人工介质单元大于水生动物单元,水生动物单元大于水生植物单元。计算组合型生态浮床中各生物单元对TN去除的贡献率(各生物单元的TN去除率/组合型生态浮床C的TN去除率)得到,水生植物单元对TN去除的贡献率为22.2%,水生动物单元为29.3%,人工介质单元为48.5%,人工介质单元对TN去除的贡献率最大,表明了人工介质单元是组合型生态浮床中TN的净化主体。对介质富集微生物的检测发现,以单位介质为基准,浮床C中的总细菌数、硝化细菌(包括亚硝酸细菌和硝酸细菌)分别达到了1.56×108cells/g、4.73×107cells/g(相关试验研究另文发表),高密度的微生物富集特别是硝化细菌的富集提高了组合型生态浮床中人工介质单元对氮的去除。
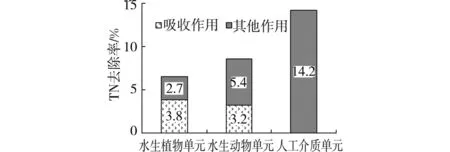
图3 各生物单元对TN的平均去除率
表3列出了试验期间空心菜、三角帆蚌的生物量变化情况。由空心菜的含氮量和生物量的增加量,计算得到在试验期间空心菜所吸收的氮量为1 135.2mg,流入浮床槽的氮为29 692.1mg,则空心菜通过吸收对氮的去除率为3.8%,低于水生植物单元对TN的去除率(6.5%),可推断剩余的2.7%的TN通过植物根系的微生物吸附与降解等作用去除。可见,吸收作用与微生物吸附与降解作用是浮床中水生植物单元对TN去除的2个主要途径。这与人工湿地不同,在同属于生态净化工程的人工湿地中,湿地基质表面富集大量的微生物,通过微生物硝化-反硝化途径将大部分氮去除,微生物作用是氮的主要去除途径,而湿地植物组织中累积的N仅占系统去除N的一小部分[6]。对于传统的水生植物浮床系统,由于其缺少富集微生物的基质条件,微生物环节较为薄弱,限制了对氮的进一步去除,因此,为改善传统浮床的净化效果,加强浮床系统微生物环节是重要的方法之一。
同样由表3可计算得到,试验期间三角帆蚌同化吸收的氮量为957.9mg,对氮的去除率为3.2%,远低于水生动物单元对TN的去除率(8.6%),仅占其去除率的37.2%,可见三角帆蚌对TN的去除途径不仅是同化吸收。
三角帆蚌为滤食性贝类,具有较强的滤水能力,对颗粒性氮(PN)有较高的去除率,如图4所示,水生动物单元对PN的去除率为30.9%,高于水生植物单元(13.9%)和人工介质单元(25.2%)。通过计算可得水生动物单元对PN的去除量占其对TN去除量的82.1%,可见,滤食性贝类三角帆蚌对氮的去除作用主要是通过滤食藻类等颗粒性有机氮产生的(详见2.3节)。同时,三角帆蚌对颗粒性物质的强滤食能力意味着它有较强的转移水体颗粒性物质的能力,水体中的颗粒物经贝类滤食后以粪便形式排出体外。对贝类排泄物的研究表明,贝类的排泄产物主要有氨、尿酸、尿素、氨基酸等,其中氨占总排泄量的70%或更高[7],因此,滤食性贝类具有较强的排氨作用。在水温为9~27℃时,1~4龄三角帆蚌的排氨率与体重成负相的幂函数关系,排氨率为2.087~5.804mg/(kg·h)[8]。三角帆蚌通过滤食一方面同化去除部分氮,更重要的是滤食及排氨作用促进了有机氮颗粒的可溶化和无机化,为组合型生态浮床中人工介质上生物膜的硝化细菌和反硝化细菌以及植物的吸收提供了有利的基质条件,促进了浮床对TN的去除。
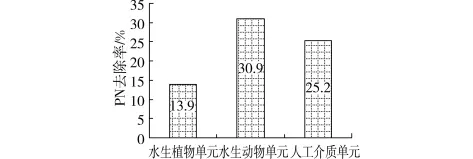
图4 各生物单元对PN的平均去除率
2.1.2 对磷的去除 图5表示了根据1.5节的计算方法得到的各生物单元对TP的平均去除率,水生植物单元、水生动物单元、人工介质单元对TP的去除率分别为11.7%、9.3%、18.4%。各生物单元对TP的去除率表现为:水生植物单元大于水生动物单元,人工介质单元大于水生植物和水生动物单元。计算组合型生态浮床中各生物单元对TP去除的贡献率(各生物单元的TP去除率/组合型生态浮床C的TP去除率)得到,水生植物单元对TP去除的贡献率为29.7%,水生动物单元为23.6%,人工介质单元为46.7%,人工介质单元对TP去除的贡献最大。
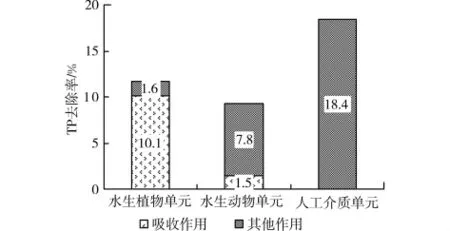
图5 各生物单元对TP的平均去除率
同2.1.1节计算,试验期间流入浮床槽的磷为1085.9mg,由表3计算得到该试验期内空心菜所吸收的磷的量为110.0mg,则空心菜通过吸收对磷的去除率为10.1%,与水生植物单元对TP的去除率为11.7%相比,可以得出空心菜对磷的吸收是水生植物单元去除磷的主要途径。三角帆蚌对磷的吸收量为16.3mg,其通过吸收同化对磷的去除率为1.5%,而水生动物单元对磷的总去除率为9.3%,吸收同化仅占水生动物单元对TP的去除率的16.1%,表明水生动物自身对磷的同化也并非是其对磷的主要去除途径。该结果与水生动物单元对TN去除的结果一致,水生动物单元对TP的去除主要表现在通过三角帆蚌的滤食作用提高了有机磷的无机化水平,从而促进了水生植物以及人工介质微生物膜对磷的同化作用等。

表3 试验期间浮床C水生动植物的生物量变化
2.2 对有机物的去除贡献率
图6表示了根据1.5节的计算方法得到的各生物单元对CODMn的平均去除率,水生植物单元、水生动物单元、人工介质单元对CODMn的去除率分别为8.2%、8.5%、16.6%。组合型生态浮床中各生物单元对CODMn的去除率表现为:人工介质单元大于水生动物单元,水生植物单元和水生动物单元相当。计算各生物单元对CODMn去除的贡献率得到,水生植物单元、水生动物单元、人工介质单元对CODMn去除的贡献率为24.6%、25.5%和49.9%,人工介质单元对CODMn去除的贡献最大,人工介质通过其较大的比表面积,为微生物的富集生长创造良好条件,形成微生物强化净化区,浮床C中单位介质的总细菌数达到了1.56×108cells/g,高密度的微生物富集使人工介质单元能够大幅度降解有机物,是组合型生态浮床中有机物的净化主体。
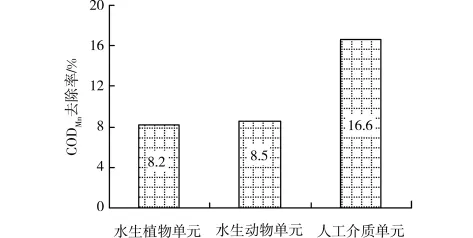
图6 各生物单元对CODMn的平均去除率
对于水生植物单元,有机物的去除主要依靠植物根系截留及根系表面微生物的降解作用;对于水生动物单元,主要依靠三角帆蚌对有机物的滤食消化作用,从图7各生物单元对颗粒性有机碳(POC)的平均去除率看出,水生动物单元对POC的去除率为32.2%,高于水生植物单元(17.0%)和人工介质单元(15.6%)表明滤食性贝类三角帆蚌对颗粒性有机物的去除作用较强,三角帆蚌通过滤食作用摄取颗粒性有机物,其消化系统完成了对有机物的持续分解,所排泄的残余代谢物也被微粒化和小分子化,促进了颗粒性难降解有机物的可溶性,提高了水中有机物的可生化性[9]。一般而言,对于停留时间较长的水库、湖泊等封闭性水体,随着易生物降解性有机物的降解,水体B/C比亦会降低,滤食性贝类的引入对加速了水体中有机物的转化与降解起到了积极的促进作用。

图7 各生物单元对POC的平均去除率
2.3 对Chl->a的去除贡献率
据1.5节的计算方法,得到各生物单元对Chl-a的平均去除率,如图8所示,水生植物单元、水生动物单元、人工介质单元对Chl->a的去除率分别为3.1%、57.5%、12.1%。其对 Chl->a的去除贡献率分别为4.3%、79.1%、16.6%。人工介质单元对Chl->a的去除率大于水生植物单元,水生动物单元Chl->a的去除率则远超过人工介质和水生植物单元,其对Chl->a去除的贡献率接近80%,与TN、TP去除相比,Chl->a的去除作用以水生动物单元为主,而非人工介质单元。
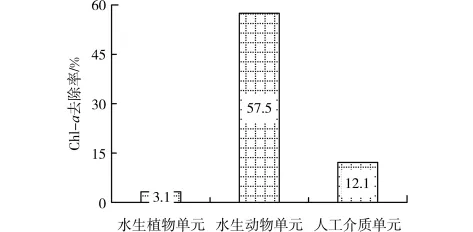
图8 各生物单元对Chl->a的平均去除率
水生动物单元对藻类的去除主要来源于滤食性贝类三角帆蚌对藻类的直接滤食,相关研究[10]表明,1龄蚌在水温17~29℃的阶段中,对叶绿素消除量为122.4~361.8μg/kg·h,叶绿素消除率在29℃达77.5%。有研究表明[11],贝类的代谢活动排泄的营养物质会间接促进水体中浮游植物的生长,但亦有研究表明[12],虽然贝类的代谢活动会促进浮游植物的生长,但仍以抑制为主。试验中,由于人工介质的引入强化了微生物的降解作用,可将贝类代谢物及时生物降解,不造成营养盐的积累以促进藻类等浮游植物的增长。因此,在组合生态浮床中由于生物配置之间的协同作用,使三角帆蚌显示出对Chl->a极强的去除能力。
水生植物对藻类的去除作用较小,其可能的途径包括水生植物的遮光效应[13-14],与藻类对营养盐的竞争抑制作用及植物根系的物理截留等。人工介质对藻类的去除作用高于水生植物,其对藻类的去除途径主要是通过细菌的降解。前期研究结果表明:在人工介质上分离出具有较强的溶解铜绿微囊藻细胞作用的芽孢杆菌,48h内溶藻率可达到96%[15]。人工介质巨大的表面积在吸附藻类的同时富集大量特异性的溶藻细菌,使藻细胞死亡溶解。
3 结论
1)组合型生态浮床中人工介质单元对TN、TP、CODMn的去除率分别为14.2%、18.4%、16.6%,对浮床去除作用的贡献率分别为48.5%、46.7%、49.9%,均高于水生植物和水生动物单元,表明组合型生态浮床中人工介质富集的微生物是氮磷等污染物的净化主体。
2)水生动物三角帆蚌同化吸收作用去除的氮量仅占水生动物单元对TN去除量的37.2%,表明同化吸收作用并非是水生动物对TN的主要去除途径。而水生动物单元对PN的去除量占其对TN去除量的82.1%,可见,滤食性贝类三角帆蚌对氮的去除作用主要通过滤食藻类等颗粒性有机氮产生的。
3)水生动物单元对Chl->a的去除贡献率为79.1%,显著高于水生植物和人工介质单元,水生动物三角帆蚌对藻类的去除作用显著。
[1]Wu Q T,Gao T,Zeng S C,et al.Plant->biofilm oxidation ditch for in situ treatment of polluted waters[J].Ecological Engineering,2006,28(2):124->130.
[2]Gao Y J,Sun C J.Purification of stream flowing into Dian LakEby ecological floating->bed system [C]//ThE2nd International ConferencEof Bioinformatics and Biomedical Engineering,May 16->18,2008.
[3]Li W,Friedrich R.In situ removal of dissolved phosphorus in irrigation drainagEwater by planted floats:preliminary results from growth chamber experiment[J].Agriculture,Ecosystems &Environment,2002,90(1):9->15.
[4]Kivaisi A K.ThEpotential for constructed wetlands for wastewater treatment and reusEin developing countries:a review[J].Ecological Engineering,2001,16(4):545->560.
[5]国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[6]曹蓉,王宝贞,彭剑锋.东营生态塘氮磷去除机理[J].中国环境科学,2005,25(1):88->91.CAO Rong,WANG Baozhen,PENG Jianfeng.Themechanism of nitrogen and phosphorus removal in Dongying eco->ponds[J].China Environmental Science,2005,25(1):88->91.
[7]王俊,姜祖辉,唐启升.栉孔扇贝耗氧率和排氨率的研究[J].应用生态学报,2002,13(9):1157->1160.WANG Jun,JIANG Zuhui,TANG Qisheng.Oxygen consumption and ammonia->N excretion rates ofChlamysfarreri[J].ChinesEJournal of Applied Ecology,2002,13(9):1157->1160.
[8]高建华,欧阳珊,吴小平.三角帆蚌的耗氧率和排氨率[J].南昌大学学报:理科版,2005,29(6):551->553.GAO Jianhua,OUYANG Shan,WU Xiaoping.Oxygen consumption and ammonia->N excretion rates ofHyriopsiscumingiiLea [J].Journal of Nanchang University:Natural Science,2005,29(6):551->553.
[9]InouET,Yamamurom.Respiration and ingestion rates of thEfilter->feeding bivalvEMusculistasenhousia:implications for water->quality control[J].Journal ofmarinESystems,2000,26(2):183->192.
[10]费志良,潘建林,徐在宽,等.三角帆蚌对水体悬浮物和叶绿素a消除量的研究[J].海洋湖沼通报,2005,2:40->45.FEI Zhiliang,PAN Jianlin,XU Zaikuan,et al.Study of thEelimination of suspented substances and chlorophyll in water byHytiopsiscumingii(Lea)[J].Transactions of Oceanology and Limnology,2005,2:40->45.
[11]Nakamura Y,Kerciku F.Effects of filter->feeding bivalves on thEdistribution of water quality and nutrient cycling in a eutrophic coastal lagoon [J].Journal ofmarinESystems,2000,26(2):209->221
[12]费志良,严维辉,赵沐子,等.三角帆蚌清除富营养化水体中叶绿素a的研究[J].南京师大学报:自然科学版,2006,29(3):99->102.FEI Zhiliang,YAN Weihui,ZHAOmuzi,et al.Studies on purification of chlorophyll->a in eutrophic water byHyriopsiscumingiiLea[J].Journal of Nanjing Normal University:Natural Science,2006,29(3):99->102.
[13]任久长,周红,孙亦彤.滇池光照强度的垂直分布与沉水植物的光补偿深度[J].北京大学学报:自然科学版,1997,33 (2):211->214.REN Jiuchang,ZHOU Hong,SUN Yitong.Vertical distribution of light intensity and light compensation depth of submergedmacrophytEin LakEDianchi[J].Acta Scientiarum Naturalium Universitatis Pekinensis,1997,33(2):211->214.
[14]Mulderij G,van Nesc EH,van DonkE.Macrophytephytoplankton interactions:ThErelativEimportancEof allelopathy versus other factors [J]. Ecologicalmodeling,2007,204(1/2):85->92.
[15]郭吉,浦跃朴,尹立红,等.太湖溶藻细菌的分离及评价[J].东南大学学报:自然科学版,2006,36(2):293->297.GUO Ji,PU Yuepu,YIN Lihong,et al.Isolation and evaluation of algicidalbacteria from Taihu Lake[J].Journal of Southeast University:Natural SciencEEdition,2006,36(2):293->297.
