植物提取物对瘤胃发酵调控的研究进展
2012-08-09赵洪波王志博张永根
赵洪波 王志博 张永根
(1.东北农业大学新农村发展研究院,黑龙江哈尔滨150030;2.东北农业大学动物科技学院,黑龙江哈尔滨150030)
反刍动物与瘤胃微生物建立了一种共生关系,宿主动物为微生物对饲料的发酵提供了营养和适宜的环境条件,而微生物降解纤维及合成微生物蛋白为反刍动物供应能量和蛋白质。然而,这种共生关系也会造成能量(甲烷的释放)与蛋白质(氨氮的流失)的损失[1]。这种损失不仅降低生产性能,而且也促使了污染物向环境的释放[2]。为了改善瘤胃能量和蛋白质的利用效率,调控不同瘤胃微生物菌群结构的研究成为反刍动物营养学家的研究热点。通过优化日粮配方和使用饲料添加剂以改变瘤胃内环境及提高或抑制特异微生物菌群可以达到上述目的[3]。离子载体抗生素在减少瘤胃能量和蛋白质损失效果显著[1]。然而,因为抗生素在畜产品中的残留及细菌耐药性问题的出现,抗生素在动物饲料中的使用引起全社会的广泛关注,2006年欧洲颁布法令禁止饲料中添加抗生素。因此,寻求抗生素替代物来调控瘤胃发酵成为科学家们研究的热点,替代物包括酵母、有机酸、植物提取物、益生菌和抗体[3]。植物可产生多种有机化合物,这些化学物质源于不直接参与植物生长和繁殖的次生代谢产物[4]。多年来,这些物质被认为是初级代谢产生的废物。然而,植物和香料的气味和颜色是由这些物质产生的,它们具有作为植物及其生存环境之间的化学信使的生物学功能,并且常常表现出抑制细菌、酵母和真菌的广谱抗生素活性[5]。近年来,发现一些植物提取物,如生物碱类、黄酮类、皂苷类、甾醇类、植物精油、单宁等具有调控反刍动物瘤胃发酵的功效,从而引起人们关注。其降低瘤胃液内氨的水平和甲烷的产量、减少原虫数量的作用效果比较明显,对其作用机制的研究已取得一些成果,本文结合国内外近年的研究结果对常见的植物提取物的特性、作用效果和机制进行综述。
1 皂苷
皂苷主要是由植物产生的次生物质,但是低等海洋动物和一些细菌也可产生[6]。它们在水溶液中可像肥皂那样产生稳定的泡沫,因此将其命名为“皂苷”。皂苷是一种高分子量的糖苷,是以三萜或甾体类的糖苷配基(皂苷元)与糖链相连而成,这些皂苷元含有一个或更多的C-C键,皂苷的化学结构见图1[7]。皂苷存在于植物的多个部位,例如根、块茎、表皮、叶、种子和果实。
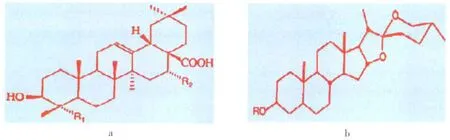
图1 皂苷的化学结构
可将皂苷的生物学效应归因于其对细胞膜的作用。事实上,其可在细胞膜上形成孔洞的特殊能力已经在生物学研究中广为应用。皂苷早已被证明对血红细胞的细胞膜具有溶解作用,这一特性已被用于对其进行检测[7]。皂苷的溶血作用被认为是其分子内的苷配基与细胞膜上的甾醇类物质,特别是胆固醇具有亲和力的缘故,并且可形成不可溶的复合物。皂苷可影响细胞膜的渗透性,对渗透性的改变是由于皂苷与胆固醇之间胶束状聚集反应的形成导致的[8]。皂苷主要在消化道发挥其生物学作用,因为其不易被吸收[9]。因此,皂苷产生的作用可能源于其对肠道微生物的影响。
王洪荣等(2011)[10]在体外培养中添加茶皂素和丝兰皂苷混合物,研究其对瘤胃发酵和瘤胃内纤维降解菌变化的影响,结果表明,添加皂苷有降低瘤胃液中原虫总数和pH值的趋势,并能够降低原虫真蛋白产量而提高细菌真蛋白产量。茶皂素和丝兰皂苷混合物对瘤胃发酵模式和瘤胃内纤维降解菌变化有一定影响,其作用效果受培养底物精粗比的显著影响。
王新峰等(2011)[11]利用体外产气量法研究添加不同水平(0、5、10、20和40mg/kg)绞股蓝皂甙对山羊瘤胃微生物体外甲烷产量及发酵特性的影响,研究发现绞股蓝皂甙剂量与甲烷浓度之间有极显著的线性效应(P<0.01),即随着皂苷添加水平的提高,甲烷产生量逐渐降低,原虫数量也随皂苷添加量的升高而下降,高剂量绞股蓝皂甙降低产气量。
Holtshausen等(2009)[12]评价了丝兰皂苷和皂树皂苷对体外瘤胃发酵的影响,研究表明随着两种皂苷体外添加水平(15、30、45 g/kg)的提高,增加了甲烷浓度和丙酸比例,降低了氨氮、乙酸及乙酸与丙酸比值,然而两种皂苷对体内试验的瘤胃发酵和甲烷产生量无影响。Nasri等(2011)[13]研究发现,羔羊日粮中添加皂树皂苷可减少瘤胃中原虫的数量。
2 植物精油
植物精油(Essential oils)是植物次生代谢产物的混合物,是通过蒸馏作用所获得的植物挥发性物质[5]。中国在5 000年前就开始使用植物进行治病,在公元前1 550年,埃及人就已经使用植物对食物进行保存及制作木乃伊。然而直到20世纪初,科学家才发现植物精油具有抗菌的特性。之后很多具有高抗生素活性的植物精油被研究。植物精油含有多种天然香料组分:熏衣草烯、麝香草酚(thymol)、丁香酚(euge⁃nol)、柠檬油精(limone)、肉桂醛(cinnamaldehyde)、辣椒素(capsaicin)、不旋松精油(terpinene)、大蒜素(alli⁃cin)、茴香脑(anethol)等。
植物精油的成分、性质及活性多样,其最重要的活性化合物主要包括2种化学基团:萜类化合物(单萜类化合物和倍半萜类化合物)和苯丙素类化合物。这两种化合物源于初级代谢的不同前体物质,并且通过不同的代谢途径进行合成。在植物次生代谢产物中,萜类化合物种类繁多,文献已记载的萜类化合物约有15 000种之多。这些化合物都具有5碳的基础结构(C5H8),通常被称为异戊二烯单元,这些化合物分类取决于它们骨架中这些单元的数量。在萜类化合物中,大多数植物精油中的最重要的属于单萜或倍半萜类化合物家族。苯丙素类化合物不是植物精油中最常见的成分,但是在某些植物中含量很高。苯丙素类化合物主要来源于莽草酸代谢途径(仅在微生物和植物才有的功能)合成的苯丙氨酸[5]。
萜类化合物和苯丙素类化合物通过作用于细胞膜来产生其抗菌作用[14]。这一特性至少部分归因于环烃的疏水性质,这种疏水性允许植物精油与细胞膜作用,并且在细菌脂质双分子层中聚集,从而占据脂肪链间的空间。这种作用引起细胞膜结构发生构象上的改变,从而导致细菌细胞流体化及膨胀[14]。细胞膜稳定性变差导致过膜离子的渗漏,从而导致膜内离子浓度的下降。在大多数情况下,细菌通过使用离子泵来抗衡这种影响,细菌虽不会死亡,但是此种作用会消耗大量的能量使细菌生长速度变慢[15]。植物精油的这种作用机制对革兰氏阳性菌更有效,因为植物精油的疏水基团可与细菌细胞膜直接作用。与之相反,革兰氏阴性菌细胞膜外存在的细胞壁是亲水的,并且不允许亲脂类物质进入。与莫能菌素相似,大多数植物精油是亲脂的,不能渗透到革兰氏阴性菌的细胞膜内。
大蒜精油(Garlic oil)是一类不同分子量的混合物,包括硫化物(硫代亚磺酸酯、烯丙基硫化物等)、酶、游离氨基酸、固醇和有机金属化合物等。其被发现于植物中,或是在油提取及加工过程中性质发生改变衍生而来。1844年,德国化学家Wertheim利用水蒸气蒸馏粉碎后的大蒜得到一些气味强烈的挥发性油状物质,即大蒜精油。Soliva等(2011)[16]使用人工瘤胃模拟装置研究了大蒜精油对瘤胃发酵的影响,结果表明,大蒜精油可降低91%的日甲烷产生量,也降低了原虫数量,增加了总细菌数,而对挥发性脂肪酸产生量无影响。陆燕等(2010)[17]采用体外培养法评价了大蒜油和脱臭大蒜油对瘤胃发酵、甲烷生成和微生物区系的影响,研究发现适宜浓度的大蒜油可以改变瘤胃发酵类型,增加丙酸摩尔浓度百分比,显著抑制甲烷生成,但对消化无影响。可见大蒜精油在不削弱瘤胃营养发酵的情况下,能够降低甲烷产生量。
Lin等(2011)[18]研究了4组植物精油混合物(丁香酚、麝香草酚、柠檬醛和肉桂醛按照不同比例混合而成)对体外培养的瘤胃发酵和甲烷产生量进行了研究,发现4组植物精油混合物均降低了甲烷产生量和氨氮浓度,同时也降低了总产气和总挥发性脂肪酸产生量。然而,Tager等(2011)[19]研究了添加肉桂醛与丁香酚混合物及辣椒素对泌乳奶牛瘤胃发酵的影响,结果表明这些植物精油对总挥发性脂肪酸及其组成、氨态氮均无影响。
Giannenas等(2011)[20]在母羊日粮中添加不同水平的植物精油(50、100、150mg/kg精料)以研究植物精油对母羊瘤胃发酵和瘤胃菌群的影响,研究表明植物精油对总活菌、纤维分解菌和原虫无影响,但是两个最高水平的植物精油组显著降低了瘤胃高效氨产生菌,最高水平的植物精油组降低瘤胃氨氮浓度,随着植物精油添加水平的提高,乙酸倾向于降低,而丙酸倾向于增加。
3 单宁
单宁是高分子量水溶性的多酚类化合物,其具有沉淀蛋白质的作用。单宁广泛分布于具有营养价值的饲用树、灌木、豆科植物和粮食作物中,单宁的存在常常限制它们作为饲料的使用。单宁主要分为两类:①可水解单宁是末食子酸的衍生物,是末食子酸部分或全部酯化到一个核心的糖醇中,例如葡萄糖、葡萄糖醇、奎宁酸、栎醇和莽草酸[21]。②缩合单宁可分为(a)原花青素(两个、三个或聚合的花青素和/或黄烷-3-醇单元组成)和(b)无色花色素(黄烷-3与4-二醇黄酮类化合物的二聚体)[21]。构成单宁的基本单元的数量不一,这决定了从两个、三个和四个黄酮类化合物到更高的低聚体的聚合程度。这种基本单元数量的不一,使得缩合单宁具有难以计数的各种化学结构,这使不同单宁产生不同的生物学特性。
一般来说,单宁可抑制瘤胃微生物的生长。这种作用是有利的,尤其是对瘤胃蛋白质分解菌的抑制。Tagari的早期研究表明,在人工瘤胃条件下,皂角树单宁能够抑制纤维分解菌和蛋白分解菌[22]。然而,栗树单宁没有被发现影响瘤胃接种微生物的纤维素酶活性[23]。据称,从皂角树荚中提取的单宁可改变细菌形态,从而产生抗菌剂活性[24]。因此,单宁对细菌的抑制活性是由于单宁具有与细菌细胞壁和细胞膜形成复合物的能力,从而引起细菌细胞壁形态的改变和胞外酶的分泌[25-26]。Bae等(1993)[27]报道,在体外条件下,产琥珀酸丝状杆菌(F.succinogenes)的细胞黏附作用和胞外内切葡聚糖酶活性被百脉根中的单宁(100~400 μg/ml)抑制。与之相似,百脉根中的单宁抑制体外培养的蛋白溶解梭菌、溶纤维丁酸弧菌、真菌、白色瘤胃球菌、产琥珀酸丝状杆菌和黄化瘤胃球菌的生长以及蛋白质的分解速度。单宁对瘤胃真菌也有影响作用。Muhammed等(1995)[28]评价了单宁酸、鞣花酸、末食子酸和儿茶酚对瘤胃真菌N.fronta⁃lis菌株RE1的影响,结果表明,这些物质抑制了这种真菌对纤维素的水解和游离孢子的黏附作用,鞣花酸、末食子酸和儿茶酚抑制纤维水解的效果比单宁酸更强。单宁对瘤胃原虫也有影响,但试验结果不一致,Animut等(2008)[29]研究发现,随着山羊采食量的增加,鸡眼草中的单宁线性降低了瘤胃原虫的数量,但总细菌数和纤维分解菌数无影响。然而,Benchaar等(2008)[30]报道,白雀树单宁对奶牛瘤胃原虫数量无影响。研究结果的不一致可能是由于不同单宁的化学结构不同造成的。
金龙(2011)[31]评价了紫色达利菊提取缩合单宁对瘤胃发酵及瘤胃微生物的影响,研究发现这种缩合单宁可提高真干物质消化率,也能够降低瘤胃氨态氮(NH3-N)浓度,同时可降低混合苜蓿中的氮转化为NH3-N,进而减少苜蓿中的含氮物质转化为NH3-N而损失掉。另外扫描电镜观察发现,当缩合单宁添加量大于150 μg/ml时,纤维分解菌的生长停滞,饲料纤维表面有大量絮状物质存在,说明紫色达利菊提取缩合单宁可造成纤维降解菌的纤维附着能力降低;而非纤维降解菌中,瘤胃普雷沃氏菌,嗜淀粉瘤胃杆菌以及瘤胃链球菌对缩合单宁比较敏感。
薛树媛等(2011)[32]评价了植物单宁酸对绵羊采食的饲料的降解、生产性能及瘤胃微生物的影响。其体外试验发现,单宁酸的添加能够显著降低日粮的消化率,除对VFA和干物质消失率有影响外,对其它发酵参数无影响;饲料中添加不同水平的单宁酸(1%、2%和3.5%)会引起绵羊瘤胃内微生物区系的变化,低水平的单宁酸有利于瘤胃微生物区系向提高日粮消化率趋势发展。
单宁提取物还能够对瘤胃的生物氢化有影响作用,包含减少瘤胃氢化细菌的活力及调控△9脱氢酶的表达。Khiaosa-Ard等(2009)[33]利用人工模拟瘤胃法探究了黑荆树提取缩合单宁对瘤胃α-亚麻酸生物氢化的影响。结果表明,黑荆树缩合单宁通过对C18∶0的生物氢化作用,进而提高了瘤胃外流物中trans 11 C18∶1的量。Vasta等(2009)[34]也采用体外培养的方法,以干草或干草加精料为发酵底物,结果表明单宁的添加使瘤胃液中微生物蛋白、挥发性脂肪酸和支链挥发性脂肪酸的浓度降低,也使由LA-I催化的CLA降低,这说明单宁可能通过抑制瘤胃溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)的生长来降低瘤胃的生物氢化作用。Patra等(2011)[35]研究发现单宁对瘤胃发酵有积极的效果,其可减少饲料蛋白质在瘤胃中的降解、预防瘤胃臌气、抑制甲烷生产及增加瘤胃共轭亚油酸浓度。
4 结语
显而易见,植物提取物具有开发作为瘤胃调控剂的潜力。经鉴定这些物质能够调控细菌、原虫、真菌和古细菌的活性和数量。植物提取物的作用各异,并且常常互相矛盾,这很可能是精料、基础日粮,尤其是植物提取物的差异造成的。因为植物提取物的活性成分的浓度和性质不同,甚至生长在不用环境的同种植物及相似植物之间的活性成分的浓度和性质也可能存在很大差异。植物提取物调控反刍动物瘤胃发酵的作用机理还需要深入研究,特别是采用分子生物学手段,如实时定量PCR技术对瘤胃微生物的定量,变形梯度凝胶电泳技术(DGGE)对瘤胃菌群组成及变化观测,有助于植物提取物作用机理的揭示。
[1]Van Nevel C,Demeyer D.Manipulation of rumen fermentation[M].Elsevier App.Sci.,London and NY.1988:387-444.
[2]Tamminga S.A review on environmental impacts of nutritional strategies in ruminants[J].Journal of Animal Science,1996,74(12):3112-3124.
[3]Calsamiglia S,Castillejos L,Busquet M.Alternatives to antimicro⁃bial growth promoters in cattle[J].Recent Advances in Animal Nu⁃trition,2006,2005(1):129-167.
[4]Balandrin M F,Klocke J A,Wurtele E S,et al.Natural plant chemicals:sources of industrial and medicinal materials[J].Sci⁃ence,1985,228(4704):1154-1160.
[5]Rosenthal G A,Berenbaum M R.Herbivores:their interactions with secondary plant metabolites.The chemical participants[M].Academic Press,1991.
[6]Yoshiki Y,Kudou S,Okubo K.Relationship between chemical structures and biological activities of triterpenoid saponins from soybean[J].Bioscience biotechnology and biochemistry,1998,62(12):2291-2299.
[7]Francis G,Kerem Z,Makkar H P S,et al.The biological action of saponins in animal systems:a review[J].British Journal of Nutri⁃tion,2002,88(6):587-605.
[8]Seeman P.Ultrastructure of membrane lesions in immune lysis[C],osmotic lysis and drug-induced lysis,1974,33(10):2116-2124.
[9]Cheeke P.Biological effects of feed and forage saponins and their impacts on animal production[J].Advances in experimental medi⁃cine and biology,1996,405:377-385.
[10]王洪荣,陈旭伟,王梦芝.茶皂素和丝兰皂苷对山羊人工瘤胃发酵和瘤胃微生物的影响[J].中国农业科学,2011,44(08):1710-1719.
[11]王新峰,毛胜勇,朱伟云.绞股蓝皂甙对体外瘤胃微生物甲烷产量及发酵特性的影响[J].草业学报,2011,20(2):52-59.
[12]Holtshausen L,Chaves A V,Beauchemin K A,et al.Feeding sa⁃ponin-containing Yucca schidigera and Quillaja saponaria to de⁃crease enteric methane production in dairy cows[J].Journal of dairy science,2009,92(6):2809-2821.
[13]Nasri S,Ben Salem H,Vasta V,et al.Effect of increasing levels of Quillaja saponaria on digestion,growth and meat quality of Barbarine lamb[J].Animal Feed Science and Technology,2011.
[14]Dorman H,Deans S.Antimicrobial agents from plants:antibacte⁃rial activity of plant volatile oils[J].J.Appl.Microbiol,2000,88(2):308-316.
[15]Cox S,Mann C,Markham J.Interactions between components of the essential oil of Melaleuca alternifolia[J].J.Appl.Microbiol,2001,91(3):492-497.
[16]Soliva C R,Amelchanka S L,Duval S M,et al.Ruminal meth⁃ane inhibition potential of various pure compounds in compari⁃son with garlic oil as determined with a rumen simulation tech⁃nique(Rusitec)[J].British Journal of Nutrition,2011,106(1):114.
[17]陆燕,林波,王恬,等.大蒜油对体外瘤胃发酵,甲烷生成和微生物区系的影响[J].动物营养学报,2010,22(2):386-392.
[18]Lin B,Wang J H,Lu Y,et al.In vitro rumen fermentation and methane production are influenced by active components of es⁃sential oils combined with fumarate[J].J.Anim.Physiol.Anim.Nutr.(Berl),2011.
[19]Tager L R,Krause K M.Effects of essential oils on rumen fer⁃mentation,milk production,and feeding behavior in lactating dairy cows[J].J.Dairy Sci.,2011,94(5):2455-2464.
[20]Giannenas I,Skoufos J,Giannakopoulos C,et al.Effects of essen⁃tial oils on milk production,milk composition,and rumen micro⁃biota in Chios dairy ewes[J].J.Dairy Sci.,2011,94(11):5569-5577.
[21]Haslam E.Plant polyphenols:vegetable tannins revisited[M].Cambridge Univ.Pr.,1989.
[22]Tagari H,Henis Y,Tamir M,et al.Effect of Carob Pod Extract on Cellulolysis,Proteolysis,Deamination,and Protein Biosynthe⁃sis in an Artificial Rumen[J].Appl.Microbiol,1965,13:437-442.
[23]Zelter S,Leroy F,Tissier J,et al.Protection of proteins in the feed against deamination by bacteria in the rumen.1.Studies in vitro:behaviour in an artificial rumen of some proteins tanned with tannin from chestnut wood or some aldehydes(formalde⁃hyde,glutaraldehyde,glyoxal)[J].Ann.Biol.animale Biochim Biophys,1970,10:111-122.
[24]Henis Y,Tagari H,Volcani R.Effect of water extracts of carob pods,tannic acid,and their derivatives on the morphology and growth of microorganisms[J].Appl Microbiol,1964,12(3):204-209.
[25]Smith A H,Zoetendal E,Mackie R I.Bacterial mechanisms to overcome inhibitory effects of dietary tannins[J].Microbial ecolo⁃gy,2005,50(2):197-205.
[26]Jones G A,Mcallister T A,Muir A D,et al.Effects of Sainfoin(Onobrychis viciifolia Scop.)Condensed Tannins on Growth and Proteolysis by Four Strains of Ruminal Bacteria[J].Appl.Envi⁃ron Microbiol,1994,60(4):1374-1378.
[27]Min B,Attwood G,Mcnabb W,et al.The effect of condensed tannins from< i> Lotus corniculatus</i> on the proteolytic activi⁃ties and growth of rumen bacteria[J].Animal Feed Science and Technology,2005,121(1):45-58.
[28]Muhammed S,Stewart C,Acamovic T.Effects of tannic acid,el⁃lagic acid,gallic acid and catchin on cellulase degradation by the rumen fungus Neocallimastix frontalis strain RE1[J].Anim.Sci.,1995,60(550A).
[29]Animut G,Puchala R,Goetsch A,et al.Methane emission by goats consuming different sources of condensed tannins[J].Ani⁃mal Feed Science and Technology,2008,144(3-4):228-241.
[30]Benchaar C,Mcallister T A,Chouinard P Y.Digestion,ruminal fermentation,ciliate protozoal populations,and milk production from dairy cows fed cinnamaldehyde,quebracho condensed tan⁃nin,or Yucca schidigera saponin extracts[J].J.Dairy Sci.,2008,91(12):4765-4777.
[31]金龙.紫色达利菊提取缩合单宁对大肠杆菌和瘤胃氮代谢以及瘤胃微生物的影响[D].东北农业大学,2011.
[32]薛树媛.灌木类植物单宁对绵羊瘤胃发酵影响及其对瘤胃微生物区系、免疫和生产指标影响的研究[D].内蒙古农业大学,2011.
[33]Khiaosa-ard R,Bryner S F,Scheeder M R,et al.Evidence for the inhibition of the terminal step of ruminal alpha-linolenic ac⁃id biohydrogenation by condensed tannins[J].J.Dairy Sci.,2009,92(1):177-188.
[34]Vasta V,Makkar H P S,MELE M,et al.Ruminal biohydrogena⁃tion as affected by tannins in vitro[J].British Journal of Nutri⁃tion,2009,102(01):82-92.
[35]Patra A K,Saxena J.Exploitation of dietary tannins to improve rumen metabolism and ruminant nutrition[J].J.Sci.Food.Agric.,2011,91(1):24-37.
