调肾祛斑颗粒含药血清对紫外线辐照后人皮黑素细胞增殖的影响
2012-08-09张凤娥欧阳恒
张凤娥,欧阳恒
1.怀化医专针灸推拿美容系(湖南怀化418000)
2.湖南中医药大学第二附属医院外科(湖南长沙410007)
近年来,我们采用调肾祛斑颗粒(前身为“清色 灵”冲剂)治疗黄褐斑[1]取得满意疗效[2-4],为探讨其作用机理,以便为临床应用提供科学依据,我们与沙棘冲剂[5,6]进行对照,观察调肾祛斑颗粒(TSQBG)含药血清对长波紫外线(UVA)照射后的体外原代培养的人皮黑素细胞(MC)的细胞增殖的影响,现报告如下。
1 材料与方法
1.1 实验材料
1.1.1 细胞标本 取自无病变的健康青年因包皮过长而行包皮环切术后切除的包皮。
1.1.2 主要试剂 四甲基偶氮噻唑蓝(MTT,美国Sigma公司产品),二甲基亚砜(DMSO),0.5%脱氧胆酸钠(上海华美生物工程公司产品),1∶1乙醇乙醚,含10%二甲基亚砜的1N NaOH溶液,氨基甲酸乙酯(广州化学试剂厂产品)等。
MCDB 153培养液的配制:(1)基础培养液:成分主要为MCDB153培养基17.6 g/L,其中添加成分的终浓度分别是 CT 0.2 μg/ml,IBMX10-4mol/L,TPA8 nmol/L,氢化考的松 0.5 μg/ml,胰岛素 5 μg/ml,青霉素100U/ml,链霉素100μg/ml,含 FCS 的终浓度为0.5%。0.22 μm滤膜的不锈钢滤器过滤除菌,分装至100 ml无菌玻璃瓶中,-20℃保存。(2)生长培养液:基础培养液,加胎牛血清至终浓度为10%,4℃保存。
1.1.3 实验器材 SM-3自动化酶免分析仪(北京天石医疗用品制作所)。6 cm塑料培养皿,96孔培养板等不同规格一次性细胞培养用品(美国Corning公司)。YXQ-LS-5O5II立氏压力灭菌器(上海博讯实业有限公司)。0.22 μm孔径的微孔滤器。AP250D-0电子天平(瑞典Ohaus corporation)。恒温水浴箱(北京长风仪器仪表厂)。-20℃低温冰箱(海尔公司)。UVA光源:紫外线灯管由四根并排的TLK40 W/1OR灯管组成(Philips产品),产生UVA功率为40 W,波长365 nm(范围340~400 nm)。PMA2100紫外线辐照计,连接PMA211OUVA辐照探测头(北京师范大学光电研究所)。
1.1.4 实验药物
1.1.4.1 调肾祛斑颗粒(TiaoShenQuBan Granule,TSQBG)自制。规格:15 g/袋,每袋含生药量10 g。药物制备:按处方比例取生地、柴胡、薏苡仁、益母草、当归、川芎、牡丹皮、丹参、白芷、甘草等中药,依次用8倍70%乙醇和8倍量水提取,合并滤液,浓缩,混匀,干燥后,收集干燥粉,再与适量花粉、紫河车粉混合,制成颗粒剂,分袋包装。
1.1.4.2 沙棘颗粒(ShaJi Granule,SJG) 内蒙古佳合药业有限公司生产。规格:15 g/袋,每袋含生药量5 g。批准文号:国药准字Z15020710。生产日期:05.01.16。产品批号:050102。
1.1.5 大鼠含药血清的制备 用大鼠作血清供体制备低、中、高不同剂量的TSQBG、SJG含药血清。
1.1.5.1 实验动物 健康成年雌性SD大鼠56只,普通级,体重320±10 g/只,由湖南农业大学动物科技学院实验动物养殖场提供。实验动物生产许可证:SCXK(湘)2003-0003号,动物使用许可证号为SYXK(湘)2003-0002。室内清洁消毒后,加饲料及水饲养。
1.1.5.2 动物分组 将大鼠按随机数字表法随机分为低剂量调肾祛斑颗粒组、中剂量调肾祛斑颗粒组、高剂量调肾祛斑颗粒组、低剂量沙棘颗粒组、中剂量沙棘颗粒组、高剂量沙棘颗粒组、生理盐水组7组,每组8只大鼠。
1.1.5.3 给药方案
(1)低、中、高剂量调肾祛斑颗粒组:按体表面积-剂量换算法计算每只大鼠的每天等效剂量,折算得大鼠的等效剂量为1.25g/d/只(作为中剂量),按倍比法设低剂量为0.625g/d/只、高剂量为2.5g/d/只,分低、中、高剂量3组以同时观察量效关系。每天临用时取3组剂量的调肾祛斑颗粒分别用蒸馏水混匀溶解,配制成8ml的供试混悬品液,分2次用一次性注射器抽取药液给大鼠灌胃,每次4 ml。连续6d,第6d的晚间禁食12h后(即第7天第1次给药前禁食12 h),于第7天第1次给予全日剂量灌胃后2 h采血。
(2)低、中、高剂量沙棘颗粒组:分别给予沙棘颗粒低剂量为0.625 g/d/只、等效(中)剂量1.25 g/d/只、高剂量2.5g/d/只,剂量换算与给药方法同上。
(3)生理盐水组:在同等条件下,只给予等体积生理盐水灌胃,方法同上,以制备无药血清。
1.1.5.4 收集血清 于末次灌胃后2 h,以11%氨基甲酸乙酯腹腔注射(11 g/kg)麻醉大鼠,确认麻醉后,将其仰面固定于操作台固定板上,用75%酒精棉球消毒腹部皮肤,无菌条件下,用剪刀沿腹部中线剪开腹部皮肤,用镊子剥开腹膜,另取镊子剥开腹腔其他脏器,注意不要碰破脏器。用干棉球轻拭腹腔,充分暴露腹主动脉,行腹主动脉取血。将血液分装至无菌塑料离心管中,标签标记,分组放置。室温静置 2 h,4℃,500 r/min,离心 25 min,分离血清,其中有溶血者弃之不用,小心抽取上层血清,同组血清合并混匀,分装至冻存管中。将分装至冻存管中的血清在56℃水浴30 min灭活补体,经0.22 μm滤膜过滤除菌,分装至EP管中,1 ml/EP管,-20℃冰箱冻存备用。临用时用基础培养液稀释调配至终浓度10%。
1.2 实验方法
1.2.1 正常人表皮MC的体外原代培养与鉴定参照 Hsu[7]和赵辫[8,9]等的培养方法进行 MC 体外原代培养,并经多巴染色[10]进行MC的鉴定。
1.2.2 实验分组 空白组(无UVA照射+10%无药血清);无药组(UVA照射+10%无药血清);低剂量TSQBG组(UVA照射+10%低剂量TSQBG含药血清);中剂量TSQBG组(UVA照射+10%中剂量TSQBG含药血清);高剂量TSQBG组(UVA照射+10%高剂量TSQBG含药血清);低剂量SJG组(UVA照射+10%低剂量SJG含药血清);中剂量SJG组(UVA照射+10%中剂量SJG含药血清);高剂量SJG组(UVA照射+10%高剂量SJG含药血清)。
空白组作为实验空白对照用,无药组作为实验阴性对照用,SJG则作阳性对照用。
1.2.3 各组含药血清的调配 采用倍比稀释法,各组血清具体调配方法如下。
10% 无药血清:100 μl(10 μl无药血清 +90 μl基础培养液);10%低剂量TSQBG含药血清:100 μl(10μl低剂量 TSQBG含药血清 +90 μl基础培养液);10%中剂量 TSQBG 含药血清:100 μl(10 μl中剂量TSQBG含药血清+90 μl基础培养液);10%高剂量TSQBG含药血清:100 μl(10 μl高剂量 TSQBG含药血清+90 μl基础培养液);10%低剂量SJG含药血清:100 μl(10 μl低剂量 SJG 含药血清 +90 μl基础培养液);10%中剂量 SJG含药血清:100 μl(10μl中剂量SJG含药血清+90 μl基础培养液);10%高剂量SJG含药血清:100 μl(10 μl高剂量SJG含药血清+90 μl基础培养液)。
1.2.4 实验指标及检测方法
1.2.4.1 UVA致人皮MC增殖剂量的选择 将原代培养的MC,常规消化,以0.25%胰酶消化5 min,倒去胰酶,加入生长培养液,用吸管反复吹打、分散细胞,吹打成细胞悬液,取10 μl细胞悬液光镜下计数,用生长培养液调整细胞浓度,按6×104/ml浓度接种于96孔培养板中,每孔100 μl,置入CO2培养箱中,以37℃、5%CO2(50 ml/LCO2)饱和湿度环境下常规培养。孵育24 h后进行换液,每孔加入200 μl生长培养液,继续孵育。当细胞培养至60%~70%融合时,吸弃培养液,用D-Hank’s液将细胞清洗两遍,加入100 μl D-Hank’s液置于紫外光源正下方,照射时间为 0、12、24、48、96、192 s,经测定的 UVA 剂量分别为 0、0.05、0.1、0.2、0.4、0.8 J/cm2(以紫外线辐照计进行能量测定),照射后用D-Hank’s液将细胞清洗一次,加入新鲜生长培养液,继续培养。间隔12 h再照射一次,方法相同,共照射两次,然后各实验孔分别给予新鲜生长培养液200 μl,继续培养。观察照射第二次后12、24 h两个时点细胞的增殖率,分别于第二次照射后12、24 h做MTT比色法试验。在终止细胞培养前4 h,各孔加入5 g/L MTT 20 μl,继续孵育4 h至终止培养时间,小心弃去上清液,每孔加入200 μl DMSO,充分振荡96孔培养板10min左右,使结晶完全溶解。立即置于酶免分析仪于波长490 nm处测定每孔吸光度值。以每个处理组A490值占阴性对照组(UVA照射剂量为0 J/cm2)A490值的百分率(处理组A490/阴性对照组A490×100%)表示MC增殖率。每组设立6个平行样品。
1.2.4.2 MTT法测定MC的增殖活性 参考文献[11,12],采用四甲基偶氮噻唑蓝比色法(MTT法)观察含药血清作用于MC不同时间后对细胞增殖的影响,同时初步观察时效和量效关系。MC增殖率以每个处理组A490值占空白对照组A490值的百分率(处理组A490/空白对照组A490×100%)来表示。每组设立6个平行样品,并重复实验3次,取平均值。
2 结果与分析
2.1 UVA致人皮MC增殖的剂量 实验结果(见表1)显示:经过0.2 J/cm2的剂量UVA照射第二次后24 h,MC增殖率最高,与对照组(0.00 J/cm2UVA照射组)相比有显著增高(P<0.01),并明显高于其它照射组(P <0.01,表1),表明0.2 J/cm2的剂量UVA照射能明显促进MC的增殖。
表1 不同剂量UVA照射对人皮MC增殖率的影响(n=6,±s)

表1 不同剂量UVA照射对人皮MC增殖率的影响(n=6,±s)
**:与各组相比 P <0.01。
UVA(J/cm2)MC增殖率(%)12 h 24 h 0.00 100.000 ±0.000 100.000 ±0.0000.05 98.439 ±2.123 103.573 ±1.8010.10 101.668 ±3.269 109.782 ±2.6040.20 94.341 ±4.517 117.983 ±3.603**0.40 93.188 ±5.022 102.536 ±3.8250.80 94.687 ±3.618 94.014 ±4.304
2.2 TSQBG含药血清对UVA辐照后人皮MC增殖率的影响 实验结果(见表2、图1)显示:UVA照射MC后给予各组大鼠血清孵育的MC于血清作用24、48、72 h时,与空白组比较,无药组MC均显著增殖(P<0.01);与无药组比较,各含药大鼠血清均能明显抑制MC增殖(P<0.01);各剂量TSQBG组间比较,中、高剂量TSQBG组含药血清对MC增殖的抑制作用均较低剂量组强(P<0.01),高剂量TSQBG组含药血清对MC增殖的抑制作用又较中剂量组强(P<0.01);各剂量SJG组间比较,中、高剂量SJG组含药血清对MC增殖的抑制作用均较低剂量组强(P均<0.01),高剂量SJG组含药血清对MC增殖的抑制作用又较中剂量组强(P<0.01);与SJG相比,低、中剂量TSQBG组含药血清对MC增殖的抑制作用均较各剂量SJG组含药血清弱(P<0.01);高剂量TSQBG组含药血清对MC增殖的抑制作用均不如中、高剂量SJG组(P<0.01),但作用24 h时与低剂量SJG组含药血清相当(P>0.05),作用48 h时比低剂量SJG组含药血清强(P<0.01),作用72 h时比低剂量SJG组强(P<0.05)。
表2 含药大鼠血清作用24、48、72 h对UVA辐照后人皮MC增殖率的影响(n=6,±s)
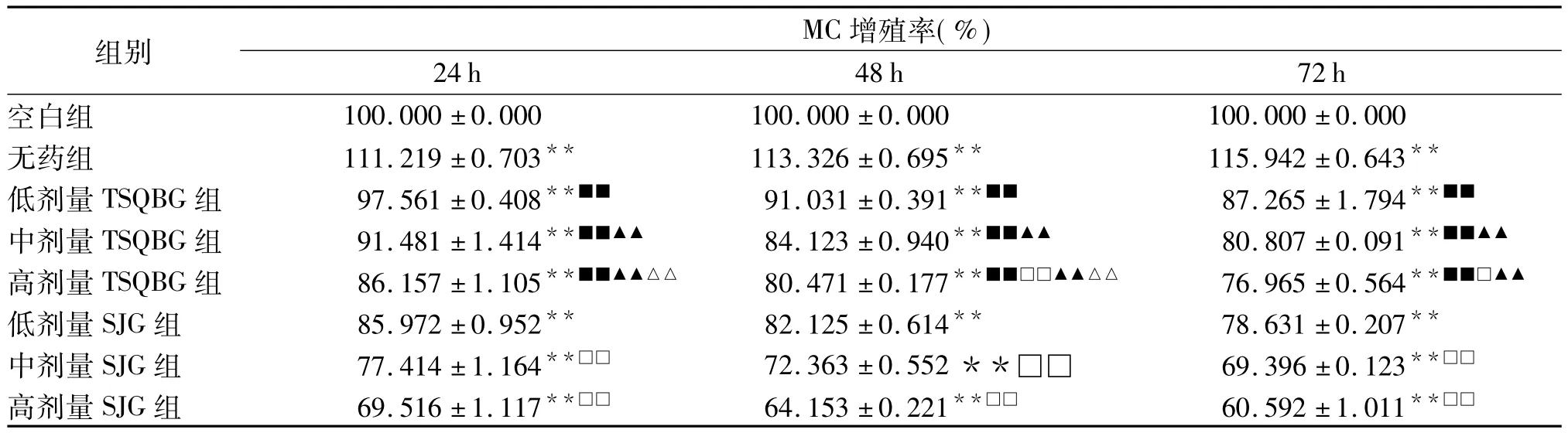
表2 含药大鼠血清作用24、48、72 h对UVA辐照后人皮MC增殖率的影响(n=6,±s)
注:与空白组比较**P <0.01;与无药组比较**P <0.01;与中高剂量 SJG 比较■■P <0.01;与低剂量 SJG 比较□P <0.05,□□P <0.01;与低剂量TSQBG组比较▲▲P<0.01;与中剂量TSQBG组比较△△P<0.01。
24 h 48 h 72 h空白组组别MC增殖率(%)100.000 ±0.000 100.000 ±0.000 100.000 ±0.000无药组 111.219±0.703** 113.326 ±0.695** 115.942±0.643**低剂量 TSQBG 组 97.561±0.408**■■ 91.031±0.391**■■ 87.265±1.794**■■中剂量 TSQBG 组 91.481±1.414**■■▲▲ 84.123 ±0.940**■■▲▲ 80.807±0.091**■■▲▲高剂量 TSQBG 组 86.157 ±1.105**■■▲▲△△ 80.471 ±0.177**■■□□▲▲△△ 76.965 ±0.564**■■□▲▲低剂量 SJG 组 85.972±0.952** 82.125±0.614** 78.631±0.207**中剂量SJG组 77.414±1.164**□□ 72.363±0.552**□□ 69.396±0.123**□□高剂量 SJG 组 69.516±1.117**□□ 64.153±0.221**□□ 60.592±1.011**□□
2.3 TSQBG含药血清干预UVA辐照后人皮MC增殖作用的时效与量效关系 研究结果显示:用大鼠作血清供体制备的低、中、高不同剂量TSQBG、SJG含药血清,作用于UVA辐照后人皮MC24、48、72 h3个不同时间点,对MC的细胞增殖均表现出抑制作用,并均随着剂量的增高其抑制作用也增强,随着作用于MC时间的延长其抑制作用也增强。说明在本实验范围内,TSQBG含药血清干预UVA辐照人皮MC作用的强弱与其剂量高低和作用时间长短有关,随着剂量的增高和作用时间的延长而增强,剂量越高、作用时间越长,其效应越好,呈现量效与时效关系。TSQBG对体外MC的抑增效应可能需要时间较长、药量较大,以中、高剂量的抑增效应为佳。以3次重复实验所得每次MC增殖率(Mean)作散点图如下(图2)。

图1 含药大鼠血清作用24~72 h对MC增殖率的影响

图2 含药血清干预UVA辐照后人皮MC增殖作用的时效与量效关系
3 讨论
TSQBG(前身为“清色灵”冲剂)是我们运用“整体调控”的辨病论治独特方法[13],开创“以色治色、以白反黑”的直观论治特色疗法[14]而拟定的治疗黄褐斑专方。
本研究采用的血清药理学方法,用大鼠作血清供体制备含药血清。实验结果表明:UVA辐照正常人表皮MC后能促进MC增殖、诱导MC增殖上调,提示黄揭斑发病与UVA照射有关;各含药血清均能抑制MC增殖,下调UVA辐照诱导的人皮MC增殖上调,并在本实验范围内呈现量效和时效关系,各含药血清抑制UVA辐照诱导的人皮MC增殖上调的作用随其浓度(剂量)的增高而增强、随其作用时间的延长而增强,提示TSQBG和SJG的临床疗效与其抑制MC增殖有关,临床治疗黄褐斑服药时间越长、疗效越明显,临床治疗应坚持服药以维持恒定的血药浓度和完成足够的疗程来获得满意疗效。
但是实验结果也表明:相对于SJG含药血清对UVA辐照诱导的人皮MC增殖上调的抑制作用来说,TSQBG含药血清对UVA辐照诱导的人皮MC增殖上调的抑制作用明显不如SJG强,而TSQBG治疗黄褐斑的临床疗效又显著优于 SJG(P <0.05)[4],说明TSQBG含药血清抑制MC的增殖作用比较温和,TSQBG对人体细胞的毒性小,临床用药安全。并提示TSQBG抑制MC增殖,下调UVA诱导的人皮MC的细胞增殖率的上调,这可能是TSQBG治疗黄褐斑的重要作用机理之一,而非主要、唯一疗效机制,TSQBG治疗黄揭斑良好的临床疗效一定还有其它作用机理存在,比如对MC的酪氨酸酶活性以及黑素合成的影响等值得探索,以便为其临床应用提供可靠科学依据。
[1]中国中西医结合学会皮肤性病专业委员会色素病学组.黄褐斑的临床诊断和疗效判定标准(2003年修订稿)[S].中华皮肤科杂志,2004,37(7):440.
[2]张凤娥,余建平,罗玉清.清色灵冲剂治疗黄褐斑40例临床疗效初步观察[J].湖南中医药导报,2003,9(4):35-36.
[3]张凤娥,李树平,马晓健,等.清色灵冲剂治疗黄褐斑的临床及实验研究[J].岳阳职业技术学院学报,2010,25(3):77-83.
[4]张凤娥,杨志波,贺菊乔.“调肾祛斑颗粒”治疗黄褐斑33 例临床观察[J].江苏中医药,2009,41(4):38-39.
[5]晏洪波,刘辉,吴宁.沙棘冲剂治疗黄褐斑的疗效观察[J].中国美容医学,2000,9(4):260-261.
[6]晏洪波,吴宁,刘辉.沙棘冲剂治疗30例黄褐斑的疗效观察[J].临床皮肤科杂志,2000,29(4):251.
[7]Hsu MY,Herlyn M.Cultivation of normal human epidermal melanocytes.Methods in molecular medicine:human cell culture protocols[J].Totowa,Humana Press Inc,1992,9-20.
[8]赵辨,黄秋玲,毕志刚,等.人正常黑素细胞体外纯培养及其细胞生物学鉴定[J].临床皮肤科杂志,1991,12(5):226-227.
[9]帕它木·莫合买提,潘建英,洪新宇,等.烟酸胺抑制人皮黑素细胞的适宜浓度研究[J].日用化学工业,2004,34:296-299.
[10]Boissy,Raymond E.Melanosome transfer to and translocation in the kerotinicyte[J].Experimenta.Dermatology,2003,Supplement 12(supplement 2):5-12.
[11]刘栋,朱文元,谭城.皮质类固醇对培养Cloudman S91黑素瘤细胞株黑素合成的影响[J].临床皮肤科杂志,2003,32(1):3-6.
[12]Im S-J,Kim K-N,Yun Y-G,et al.Effect of Radix Ginseng and Radix Trichosanthis on the Melanogenesis[J].Biol.Pharm.Bull,2003,26(6):849-853.
[13]张凤娥,欧阳恒,杨志波.中医治疗黄褐斑现状及展望[J].中国中医药信息杂志,2008,15(7):107-108.
[14]欧阳恒.中医皮科领域中的直观论治法[J].湖南中医药导报,2001,7(4):143-144.
