96-II喜树叶片高频率植株再生体系建立1)
2012-08-09董凤丽祖元刚王慧梅
董凤丽 祖元刚 王慧梅
(黑龙江生态工程职业学院,哈尔滨,150025) (森林植物生态学教育部重点实验室(东北林业大学))
喜树(Camptotheca acuminata Decne.)为我国特有树种,广泛分布于长江流域及南方各省区。其生长速度快、冠形完美,材质优良,是良好的用材树种及园林绿化树种。该树种因体内含有抗癌和抗逆转录病毒的生物碱:喜树碱、10-羟基喜树碱等而闻名,深受植物学界和医药学界的青睐。临床上用于治疗肝癌、胃癌、肠癌、膀胱癌卵巢癌、食道癌、早期白血病等,其疗效显著。但是由于喜树碱在植物组织中含量低、尤其是在成熟的喜树叶片中含量急剧下降[1],且目前野生状态下喜树资源不稳定,随着市场上喜树碱需求量的增加,生产上消耗的喜树也越来越多。因此开发优良品种、扩大栽种面积已势在必行。
到目前为止,对喜树的研究多集中在苗木的生长状况,喜树碱的药理作用及合成,细胞悬浮培养获得喜树碱等方面,对喜树的组织培养方面研究报道还很少。目前有关于利用喜树的茎段[2-4]、茎尖[5-6]、种胚[7]等作为外植体建立再生体系的报道,而叶片的再生仅有一例报道[8]。
东北林业大学森林植物生态学教育部重点实验室在1996年从美国引入喜树新品种——96-II,并在我国南方栽种后达到引种目的。本研究从96-II喜树离体培养入手,探讨离体叶片再生条件,旨在建立高频率叶片再生体系,为今后加速96-II喜树的人工繁殖、药用林培育及遗传转化提供一条新途径。
1 材料与方法
植物材料为96-II喜树无菌苗叶片。培养温度为22~25℃,光/暗周期16/8 h,光照强度1 000~1 500 lx。继代周期为30 d。
96-II喜树无菌苗的获得:剪取3 a生96-II喜树新生、未木质化的茎段,每段含有1个侧芽,用洗涤剂漂洗30 min,再经流水冲洗1 h后,于超净工作台内,将茎段在70%的乙醇中浸泡30 s,再用3%次氯酸钠消毒5 min,期间不断摇动,然后用无菌水漂洗3~5遍,用无菌滤纸吸干,接种在WPM+6-BA1.0 mg/L培养基中,置于培养室培养。25 d后,切取茎段叶腋处长出的新枝,接入继代培养基中进行扩繁。
叶片愈伤组织诱导及分化培养基筛选:以WPM、MS和B5为基本培养基,将无菌苗叶片切成1.0 cm×1.0 cm大小,分别接种于附加不同质量浓度的6-BA、NAA和2,4-D培养基上,蔗糖3%,琼脂0.7%,调节pH值5.9左右。每个组合重复处理3次,每次处理10叶片,30 d后将愈伤组织转入分化培养基,诱导不定芽分化。根据愈伤组织诱导率和不定芽诱导率大小确定最适培养基。
愈伤组织诱导率=(诱导出愈伤组织的外植体个数/接种外植体的总数)×100%;
芽诱导率=(诱导出芽的外植体个数/接种外植体总数)×100%。
生根培养基筛选:切取96-II喜树诱导出的1.5 cm以上的不定芽,接入附加不同质量浓度NAA及IBA的WPM生根培养基上,置于培养室内进行根的诱导。每个处理10个不定芽,3次重复。30 d后统计不定芽的生根情况,计算生根率,筛选出96-II喜树根诱导最适培养基。
生根率=(生根幼芽个数/接种幼芽总数)×100%。
炼苗移栽:将炼苗3~5 d后的组培苗,移栽到消毒处理过的泥炭土和细沙混合的基质中(V(泥炭土)∶V(细沙)=1∶1),30 d后统计成活率。
2 结果与分析
2.1 96-II喜树叶片愈伤组织及芽诱导
2.1.1 不同培养基对叶片愈伤组织诱导效果的影响
应用WPM、MS和B53种基本培养基,并用6-BA1.0 mg/L+NAA0.5 mg/L激素组合进行诱导愈伤组织效果比较,结果见表1和图1。研究表明,叶片培养在MS培养基上,生长受到抑制,不能利用培养基中的营养成分,逐渐死亡。MS培养基中盐质量浓度高,96-II喜树的叶片不能吸收利用,反而被毒害致死。即使能够存活,叶片也干枯,生长明显受到抑制。WPM培养基上叶片愈伤组织诱导率(97.6%)明显高于在B5培养基(56.9%)。愈伤组织体积大,结构致密,分化率高。由此,确定WPM为诱导叶片愈伤组织的最佳基本培养基。

表1 3种培养基对叶片愈伤组织诱导的效果

图1 不同培养基对叶片愈伤组织的诱导效果
2.1.2 不同激素组合对96-II喜树叶片愈伤组织诱导和分化的影响
从表2可以看出,只有细胞分裂素与生长素同时使用时,叶片才能被诱导脱分化形成愈伤组织,但只有二者达到适合比例时所形成的愈伤组织才具有再分化出不定芽的能力。单独施加6-BA时对96-II喜树叶片诱导愈伤组织不起作用,只有同时加入生长素后才能诱导形成愈伤组织。加入NAA、2,4-D都能很好诱导形成愈伤组织,但2,4-D与6-BA组合时,无论2,4-D质量浓度高低,愈伤组织诱导率都很高,长势快,但所形成的愈伤组织为白色,质地疏松,20 d后所形成的愈伤组织完全覆盖了整个叶片,随着培养时间的延长,愈伤组织表面会由白色转为红色,所形成的愈伤组织都不能分化出芽(图2)。说明2,4-D作用较强,使愈伤组织一直保持脱分化状态,很能转入分化状态。
当NAA与6-BA组合时,愈伤组织诱导率与二者的质量浓度都相关,且所形成的愈伤组织,绿色,结构致密,几乎都能分化出芽。当6-BA质量浓度不变时,愈伤组织诱导率随着NAA质量浓度升高而升高,愈伤组织的大小与NAA质量浓度也成正比。但是6-BA的质量浓度不与愈伤组织的体积成正比,6-BA为1.0 mg/L时愈伤组织形成明显好于6-BA0.5 mg/L时,但是当质量浓度达到1.5 mg/L时,愈伤组织形成受到了抑制,形成较晚,且体积小。这是因为这种生长素与细胞分裂素的配比,不适合96-II喜树叶片诱导愈伤组织。当NAA质量浓度达到0.5 mg/L时,所诱导的愈伤组织形成早,长势好,体积大,所以认为6-BA1.0 mg/L+NAA0.5 mg/L 的组合好于其它组合。
当6-BA、NAA和2,4-D3种激素同时使用时,愈伤组织形成明显快于其它激素的组合。但是当2,4-D质量浓度增高时愈伤组织呈现白色,分化率降低。当2,4-D质量浓度为0.1 mg/L时,诱导愈伤组织快,体积大,芽分化率很高。所以认为诱导叶片愈伤组织的最好的激素组合为6-BA1.0 mg/L+NAA0.5 mg/L+2,4-D0.1 mg/L。
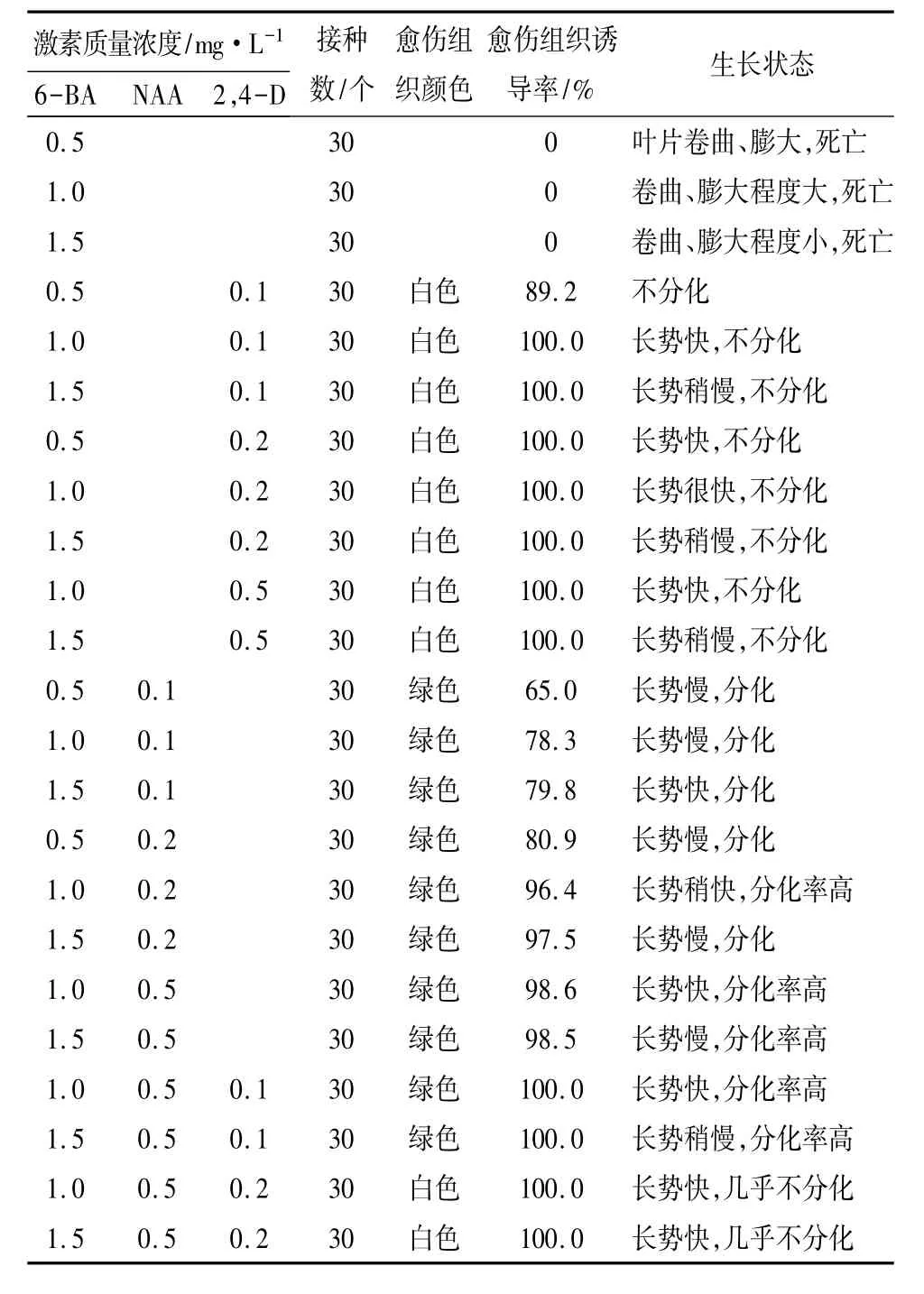
表2 不同激素组合对叶片愈伤组织诱导和分化效果的影响

图2 不同的激素组合诱导的96-II喜树叶片的愈伤组织
2.1.3 激素6-BA对愈伤组织分化的影响
在研究中发现,愈伤组织在含有细胞分裂素浓度过高而生长素质量浓度过低的培养基上诱导分化,会形成过于细密的嫩芽,虽然提高了增值速度,但苗多而弱,降低了芽的质量,不适宜作为生根或移栽用苗,甚至还会出现抑制分化的情况。只有转入没有生长素,低水平的细胞分裂素的培养基上,才能分化,抽枝、展叶,形成丛生芽。将愈伤组织转入含有不同质量浓度6-BA的培养基上,愈伤组织分化的情况见表3。当6-BA为0.2 mg/L时,苗健壮,但是分化率低;当6-BA0.8 mg/L时愈伤组织分化率高,但是芽的状态弱小,不利于生根等其他用途;在6-BA1.0 mg/L时愈伤组织分化受到抑制,分化率低且芽弱小;当6-BA0.5 mg/L时,愈伤组织分化率高,且苗健壮。所以,确定6-BA为0.5 mg/L是诱导96-II喜树愈伤组织分化最适合的激素质量浓度。

表3 不同6-BA质量浓度对愈伤组织分化及不定枝增值的影响

图3 愈伤组织分化的再生苗
2.2 96-II喜树根诱导
生长素对不定根的形成起关键性作用。在无激素的条件下,再生苗也能生根,但是生根率很低,只有33.3%,而且根的平均数量为2条。加入生长素后,生根状况都有了改善。IBA和NAA在高质量浓度时都能很好的诱导生根,从表4可以看出生根率和平均生根数都分别随两种激素质量浓度的增加而增长。而且生根的质量也和两种激素的质量浓度成正比。但从图4中可以看出二者的生根效果不同,IBA诱导的根细长,均匀;NAA诱导的根粗壮,但生根较晚。IBA诱导生根的苗,在其基部直接生出根,茎中的维管组织与根中的维管组织直接相连,移栽后容易成活;NAA诱导生根的苗开始在茎的基部形成愈伤组织,然后在所形成的愈伤组织上生出粗壮的根。随着NAA质量浓度的增高所形成的愈伤组织也增大,且根形成变晚。说明NAA先诱导茎基部脱分化,然后诱导愈伤组织分化生成根,这样形成的根与茎之间并无维管组织的直接联系,以致移栽后不能成活。从图4看出,试管苗在IBA的诱导下植株生长正常,而在NAA的诱导下植株不生长,且叶片下垂。随着NAA的质量浓度的增加,这种现象越明显,说明NAA抑制了植株的生长。由此,可以确定最佳的生根的激素为IBA,质量浓度为0.8 mg/L。
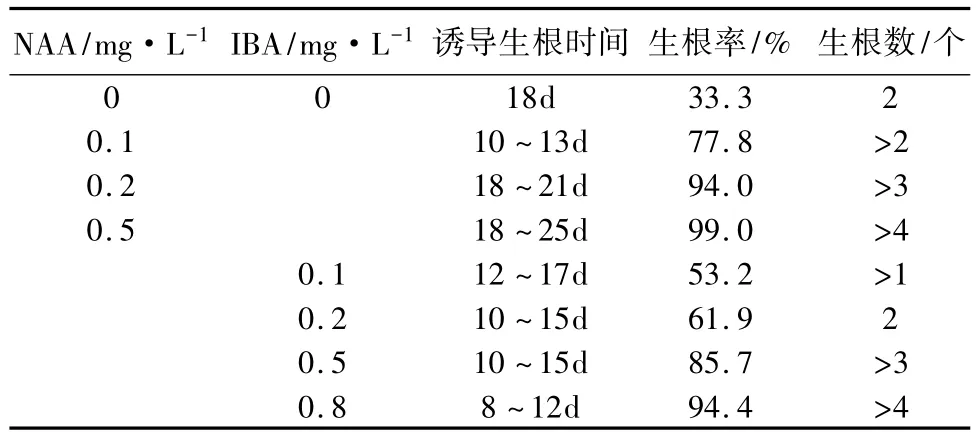
表4 不同的激素种类及质量浓度对生根的影响

图4 不同激素对生根诱导的影响
2.3 96-II喜树炼苗和移栽
将组培苗根长为1~2 cm时,去掉封口膜,在阳光充足的温室内,炼苗3~5 d,用自来水洗净根部培养基,移栽到经消毒处理的混合的基质中(V(泥炭土)∶V(细沙)=1∶1),在培养期间使用塑料膜小拱棚保温、保湿。30 d后调查,96-II喜树组培苗成活率为95%以上(图5、6)。

图5 生根的96-II喜树再生苗

图6 移栽的96-II喜树组培苗
3 讨论
本试验通过对96-II喜树无菌苗叶片离体培养,研究了不同基本培养基和不同质量浓度的激素配合使用对96-II喜树叶片愈伤组织诱导途径再生的条件。结果表明96-II喜树愈伤组织诱导需要生长素与细胞分裂素配合使用,单独使用6-BA不能诱导愈伤组织。2,4-D与6-BA配合对于诱导愈伤组织作用明显,愈伤组织形成早,速度快,但所诱导的愈伤组织不具有分化能力。NAA与6-BA配合,随着NAA质量浓度增加,愈伤组织诱导率明显提高,且具有很高的分化潜力,但愈伤组织形成速度稍慢,所以配合低质量浓度的2,4-D能提高愈伤组织诱导速率,但2,4-D质量浓度过高,影响愈伤组织分化。所以筛选3种激素之间的质量浓度比例是很重要的。组培苗移栽前,必须经过外界环境驯化或锻炼,才能适应外界的温度、湿度和强烈的自然光照。所以在移栽前要先去掉封口膜,在阳光充足的温室内,锻炼小苗3~5 d,有利于提高组培苗移栽成活率。其间可适当增加光照强度,以提高小苗的木质化程度。
[1]张玉红,王洋,阎秀峰.喜树种子萌发和幼苗过程中喜树碱含量的变化[J].植物生理学通讯,2002,38(6):575-577.
[2]陈颖,曹福亮,李淑娴,等.喜树茎段不定芽的诱导及再生系统的建立[J].经济林研究,2004,22(1):8-11.
[3]林桂芸,孙雁霞,邬晓勇,等.喜树离体愈伤组织和腋芽诱导试验[J].西南农业学报,2004,17(1):88-89.
[4]Liu Z,Li Z.Micropropagation of camptotheca acuminata decaisne from axillary buds,shoot tips,and seed embryos in a tissue culture system[J].Vitro Cell Dev Biol Plant,2001,37:84-88.
[5]吕立堂,朱冬雪,赵德刚.喜树茎尖组织培养与植株再生[J].中草药,2004,35(6):628-684.
[6]Wiedenfeld H,Furmanowa M,Roeder E.Camptothecin and 10-hydroxy camptothecin in callus and plantletsof camptotheca acuminata[J].Plant Cell Tiss Organ Cult,1997,49:213-218.
[7]张启香,方炎明.喜树组织培养初步研究[J].江苏林业科技,2005,32(3):1-3.
[8]Wang H M,Zu Y G,Wang W J,et al.Establishment of camptotheca acuminata regeneration from leaf explants[J].Biol Plant,2006,50(4):725-728.
