鹿角杜鹃嫩叶离体培养和高效植株再生1)
2012-08-09杨丽娟顾地周王秋爽禚玲玲张学士
杨丽娟 顾地周 王秋爽 禚玲玲 潘 雨 付 航 张学士
(通化师范学院,通化,134002)
鹿角杜鹃(Rhododendron latoucheae Franch.)又称岩杜鹃,是杜鹃花科杜鹃花属的常绿灌木或小乔木。主要分布浙江、江西、福建、湖北、湖南、广东、广西、四川和贵州等地的山坡灌丛或杂木林中。鹿角杜鹃是优良的、有待研究开发的园林绿化树种,可引种驯化成为露地栽培的园艺观赏植物,是杜鹃育种的重要种质资源。利用种子和嫁接等方法繁殖存在种子萌发率和繁殖系数极低等问题,使其开发及利用受到极大限制。向光锋等[1]利用1年生完全木质化的鹿角杜鹃枝条进行了扦插研究,平均成活率达85%,扦插生根速度较慢。江苏省农科院刘晓青等人以鹿角杜鹃嫩茎尖或茎段为材料,通过基部愈伤组织再分化形成丛生芽的方式对鹿角杜鹃进行离体培养,生根率为85.4%,但并未建立高效的快繁体系。本研究利用植物组织培养方法,以鹿角杜鹃嫩叶为材料,通过诱导嫩叶产生愈伤组织、愈伤组织再分化形成丛生芽方式对鹿角杜鹃进行快繁,为避免愈伤组织丛生芽苗遗传多样性在继代过程中的可能丢失,又在生根培养基的基础上探索节增殖的高效植株再生体系,以开创一步成苗技术,提高增殖系数。目前,与其同属的其他种植物离体培养和鹿角杜鹃其他方面研究已有报道[2-6],但利用鹿角杜鹃叶片离体培养和节增殖建立高效植株再生体系研究在国内外尚未见报道。
1 材料与方法
1.1 外植体材料的来源和处理
鹿角杜鹃枝条采自江西省井冈山,将枝条茎尖剪除后在实验室内水培促其腋芽萌发生长。待腋芽萌发放出鲜嫩叶片后将嫩叶剪下,用70%酒精涮洗5 s,再用3%次氯酸钠溶液浸泡10 min,无菌水冲洗6次,无菌滤纸吸干表面水分后备用。
1.2 鹿角杜鹃嫩叶愈伤组织的诱导
以DR为基本培养基[7],附加不同质量浓度的玉米素ZT(由预试验确定为2.10~2.80 mg·L-1)和吲哚乙酸IAA(由预试验确定为0.30~0.70 mg·L-1),内含蔗糖 30 g·L-1,琼脂粉 7.0 g·L-1,调节pH值为5.7,将1.1中处理的叶片切割成0.50 cm左右的叶碟接种到培养基中,在温度(26±2)℃、光照强度800 lx、光照周期12 h·d-1条件下培养。为了提高鹿角杜鹃嫩叶愈伤组织诱导的速度和诱导率,应用均匀设计法设计实验,选用U10(102)均匀表,每个处理接种10个叶碟数,重复3次取诱导率的平均值,筛选诱导鹿角杜鹃嫩叶愈伤组织的玉米素和吲哚乙酸最适宜的质量浓度配比。嫩叶碟培养40 d统计诱导率。
1.3 鹿角杜鹃嫩叶愈伤组织的芽苗再分化
以DR为培养基,添加不同质量浓度的玉米素ZT(由预试验确定为2.60~3.30 mg·L-1)、吲哚乙酸 IAA(由预试验确定为0.05~0.20 mg·L-1)和激动素 KT(由预试验确定为 1.30~1.80 mg·L-1),加入蔗糖30 g·L-1,琼脂7.0 g·L-1,调节 pH 值为5.7,将嫩叶愈伤组织切割成小块,在温度(28±2)℃、光照强度1 200 lx、光照周期10 h·d-1条件下培养。选用U12(123)均匀表,每个处理接种愈伤组织块数为10,重复3次,筛选最适合鹿角杜鹃嫩叶愈伤组织芽苗分化的玉米素、吲哚乙酸和激动素质量浓度配比。愈伤组织培养45 d统计分化率。
1.4 鹿角杜鹃芽苗生根、植株高效再生体系和炼苗
以1/4DR为培养基,并附加不同质量浓度的激动素 KT(由预试验确定为0.20~0.75 mg·L-1)、吲哚乙酸IAA(由预试验确定为0.10~0.20 mg·L-1)和吲哚丁酸IBA(由预试验确定为0.05~0.15 mg·L-1),添加蔗糖 10 g·L-1,琼脂 6.8 g·L-1,调节 pH为5.6,待愈伤组织再分化的芽苗长至2.00 cm时,将切下芽苗接种到培养基中,在温度(23±2)℃、光照强度800 lx、光照周期8 h·d-1条件下培养。为了提高鹿角杜鹃的生根率,选用U12(123)均匀表,每个处理接种芽苗数为10,重复3次取平均值,筛选最适合鹿角杜鹃再生芽苗生根的激动素、吲哚乙酸和吲哚丁酸的质量浓度配比。芽苗培养40 d统计生根率。
采取节增殖方式对鹿角杜鹃进行高效快繁,待生根的苗伸长至3.00 cm以上时,在超净工作台上打开培养瓶,将生根的苗留1或2叶剪下苗干,并切割成1或2叶1段转接到附加赤霉素GA32.30 mg·L-1的生根培养基中,进行腋芽萌发伸长同时生根培养,统计并计算每瓶中每段茎节的增殖倍数和周期。
芽苗生根后,从培养瓶中取出再生植株,在含有10 mg·L-1高锰酸钾溶液中洗去根部残留的琼脂,然后植入经200倍液的杀毒矾消毒过的V(草炭土)∶V(河砂)∶V(腐烂松针)=3∶1∶2的混合基质中,用透光好的塑料薄膜覆盖以保湿保温,相对湿度保持在80%,温度控制在(20±2)℃,每天自然光照12 h,每天中午适当通风换气,每天早晚喷洒清水各1次。
1.5 数据处理与分析
通过均匀设计法进行试验设计,数据经分析处理后摸索出各因素对愈伤组织诱导率、芽苗分化率和生根率的影响,再经过进一步验证实验筛选愈伤组织诱导、芽苗再分化和生根的主要因素质量浓度。均匀设计软件采用Uniform Design 3.0V。
2 结果与分析
2.1 培养基中影响鹿角杜鹃嫩叶愈伤组织诱导的主要因素筛选
表1中试验所得数据经分析处理后可知,检验值 Ft>临界值 F(0.05,2,7),说明回归方程显著(表2)。通过回归方程可知,玉米素和吲哚乙酸的最优质量浓度分别为2.80和0.70 mg·L-1,以此组合计算愈伤组织诱导率的最优解为97.5%,此解为回归方程的解析解,需按公式Y=y±uα·s(其中uα为正态分布的双侧分位数,s为剩余标准差)计算出优化值估计区间为93.86%~101.14%。由回归方程可知,玉米素和吲哚乙酸均与愈伤组织诱导率呈正相关,以免玉米素在2.10 mg·L-1和吲哚乙酸在0.70 mg·L-1以上有更高的愈伤组织诱导率,因此,又以玉米素质量浓度为 2.10~2.50 mg·L-1,以及吲哚乙酸质量浓度为0.70~1.00 mg·L-1做了9个处理补充试验(重复3次取平均值),结果表明:玉米素质量浓度为2.60 mg·L-1和吲哚乙酸为0.75 mg·L-1时愈伤组织诱导率最高且愈伤组织质量和形态最好。按1.2中的的方法,将叶片切割成0.50 cm左右的叶碟接种到附加玉米素2.60 mg·L-1和吲哚乙酸0.75 mg·L-1的DR培养基上进行验证试验(重复3次取平均值)。叶碟培养6 d开始增厚;继续培养至20 d,叶碟逐渐增厚变形,在叶块表面出现绿色的愈伤组织;培养至40 d,叶碟完全转变为黄绿色的愈伤组织(图1a),诱导率达99.2%,比表1中10个处理的诱导率均高,且在估计区间内。
2.2 培养基中影响鹿角杜鹃愈伤组织芽苗再分化的主要因素筛选
表3中试验所得数据经分析处理后可知,检验值 Ft>临界值 F(0.05,3,8),回归方程显著(表2)。由回归方程和回归分析结果可知,玉米素、吲哚乙酸和激动素的最优质量浓度分别是3.30、0.05 和 1.80 mg·L-1,那么,最优解析解为97.0%,优化值估计区间为93.59%~100.41%。由表2可知,玉米素和激动素均与分化率呈正相关,吲哚乙酸与分化率呈负相关。避免玉米素质量浓度在3.30 mg·L-1和激动素在1.80 mg·L-1以上及吲哚乙酸在0.05 mg·L-1以下有较高的分化率,因此,以玉米素质量浓度为3.30~3.50 mg·L-1,吲哚乙酸质量浓度为 0~0.05 mg·L-1,以及 KT 质量浓度为 1.80~2.00 mg·L-1做了12个处理的补充试验,重复3次取平均值,发现玉米素质量浓度为3.35 mg·L-1,吲哚乙酸质量浓度为 0.05 mg·L-1,激动素质量浓度为 1.90 mg·L-1时愈伤组织分化率最高且芽苗形态最佳。待嫩叶碟完全脱分化形成愈伤组织后,将愈伤组织切割成小块将其接种到添加玉米素3.35 mg·L-1、吲哚乙酸0.05 mg·L-1和激动素 1.90 mg·L-1的 DR 培养基上进行验证试验,培养12 d发现愈伤组织表面产生大量颗粒状小凸起,继续培养至25 d,颗粒状小凸起逐渐转变为锥状,培养至35 d,锥状体生长并伸长为不定芽(图1b),培养至45 d,愈伤组织分化出大量的不定芽,不定芽高度可达1.50 cm以上(图1c),平均分化率可达99.9%,在估计区间内,且比表2中12个水平的分化率均高。可见,鹿角杜鹃嫩叶愈伤组织芽苗再分化的最佳培养基为:DR+ZT3.35 mg·L-1+IAA0.05 mg·L-1+KT1.90 mg·L-1。
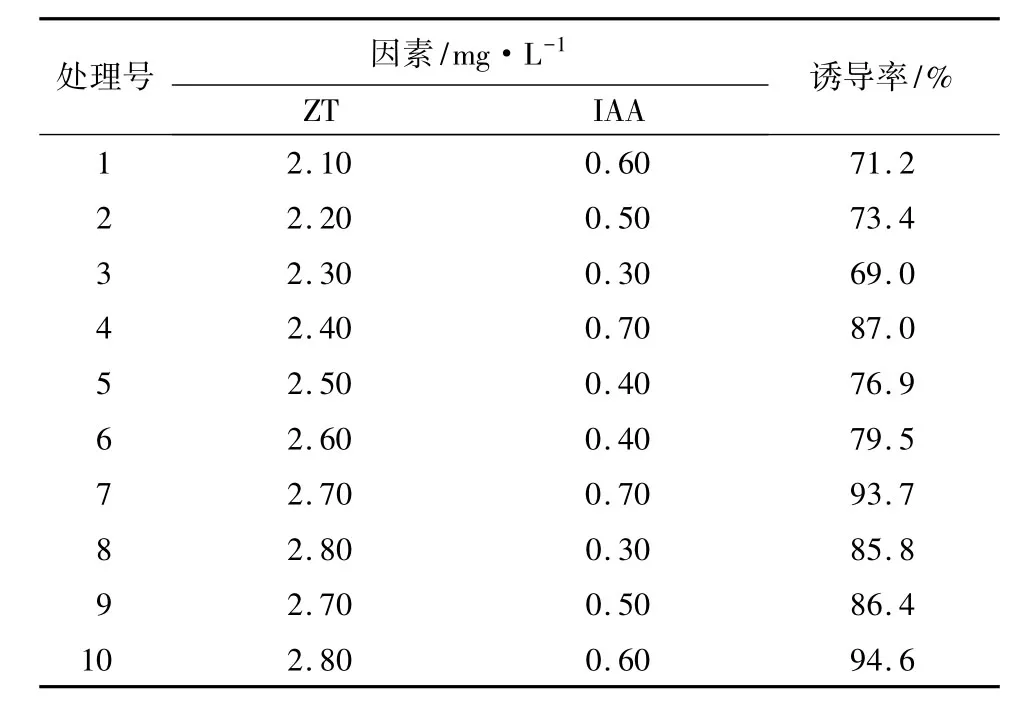
表1 影响鹿角杜鹃愈伤组织诱导主要因素的U10(102)试验
2.3 培养基中影响鹿角杜鹃再生芽苗生根的主要因素筛选
由表4中试验所得数据和回归分析结果(表2)可知,检验值 Ft>临界值 F(0.05,2,9),表明回归方程有意义。同理,根据回归方程获知,激动素和吲哚丁酸的最优质量浓度分别为0.20和0.05 mg·L-1,计算生根率的最优解析解为93.6%,同2.1中公式计算得优化值估计区间为86.53%~101.67%。通过回归分析可知,激动素和吲哚丁酸均与生根率呈负相关。猜测激动素质量浓度在0.20 mg·L-1和吲哚丁酸在0.05 mg·L-1以下有较高的生根率,又以激动素质量浓度为0~0.20 mg·L-1,以及吲哚丁酸质量浓度为0~0.05 mg·L-1做了6个水平的补充试验,重复3次。结果表明,激动素质量浓度为0.10 mg·L-1和吲哚丁酸质量浓度为0.04 mg·L-1时芽苗生根率最高。因此,待2.2中诱导的再生芽苗长至2.00 cm左右时,在无菌条件下打开培养瓶将生长健壮的芽苗从芽团上切下,转接到附加激动素0.10 mg·L-1和吲哚丁酸0.04 mg·L-1的1/4DR培养基中做验证实验,再生芽苗培养7 d,在芽苗切口处有微小锥状颗粒出现,培养15 d后锥状颗粒逐渐转变为白色的根锥,培养至30 d根锥伸长为不定根,培养至40 d可形成5条以上含有侧根的不定根(图1d),生根率达98.0%以上,在估计区间范围内,且比表4所列12个水平的生根率均高。可见,鹿角杜鹃再生芽苗生根的最佳培养基为:1/4DR+KT0.10 mg·L-1+IBA0.04 mg·L-1。
按照1.4中的方法,对生根培养基进行改良,即为 1/4DR+KT0.10 mg·L-1+IBA0.04 mg·L-1+GA32.30 mg·L-1。再生植株含有叶腋的茎节在培养基上培养40 d后,腋芽逐渐萌发伸长生长,同时在茎段靠近切口的干部可发出3~5条不定根,苗高可达4.5 cm(图1e)。快繁的结果表明,经过38 d的培养后,每节段平均增殖7倍以上,植株再生率为96.5%。

表2 鹿角杜鹃离体培养和高效植株再生各阶段的回归分析结果
根据1.4中的方法,待芽苗生根后并长至3.00~4.00 cm以上时进行移栽炼苗,鹿角杜鹃再生植株经过炼苗后,12 d可揭去薄膜,成活率达98.5%以上(图1f)。
3 结论与讨论
本研究结果表明,培养基DR+ZT2.60 mg·L-1+IAA0.75 mg·L-1对鹿角杜鹃嫩叶愈伤组织诱导的效果最好,当玉米素和吲哚乙酸质量浓度分别超过2.60 mg·L-1和0.75 mg·L-1时诱导的愈伤组织颜色变白且质地松软而失去分化能力,质量浓度分别低于2.10 mg·L-1和0.30 mg·L-1时愈伤组织诱导率均低于58.0%;培养基 DR+ZT3.35 mg·L-1+IAA 0.05 mg·L-1+KT 1.90 mg·L-1对鹿角杜鹃嫩叶愈伤组织再分化的效果最佳,玉米素质量浓度低于2.60 mg/L和高于3.35 mg·L-1时愈伤组织芽苗分化率均下降,均在45.0%以下,说明低质量浓度的玉米素满足不了鹿角杜鹃愈伤组织芽苗的分化,而过高质量浓度的玉米素对愈伤组织芽苗的分化起抑制作用。适宜质量浓度的吲哚乙酸有利于芽苗的生长。在培养基中附加KT1.90 mg·L-1,分化的芽苗比未附加的粗壮、长势好且分化速度快[8];在添加激动素0.10 mg·L-1和吲哚丁酸0.04 mg·L-1的1/4DR培养基中对鹿角杜鹃愈伤组织再分化芽苗进行生根培养的结果表明,生根速度快,平均生根率高达98.0%以上,吲哚乙酸对鹿角杜鹃的生根影响不显著。当吲哚丁酸低于0.04 mg·L-1时芽苗生根率仅为57.0%,高于0.15 mg/L时,芽苗基部膨胀并产生愈伤组织,继续培养根从愈伤组织上产生,含有这样根的苗在炼苗移栽时根随愈伤组织从苗基部脱落,成活率极低,原因可能是根中和苗茎的疏导组织连接错位导致的,Danielle等[9]的研究也发现了这一缺点。高效快繁采取再生植株茎节增殖的方式,在生根培养基中附加2.30 mg·L-1的赤霉素有利于腋芽快速萌发和生长[10],从而缩短了茎节的增殖周期,提高了增殖倍数,该方法与王雯雯等[11]开展的大字杜鹃快繁研究有共同点。该方法成本低,简捷而可操作性强,可用于工厂化育苗。
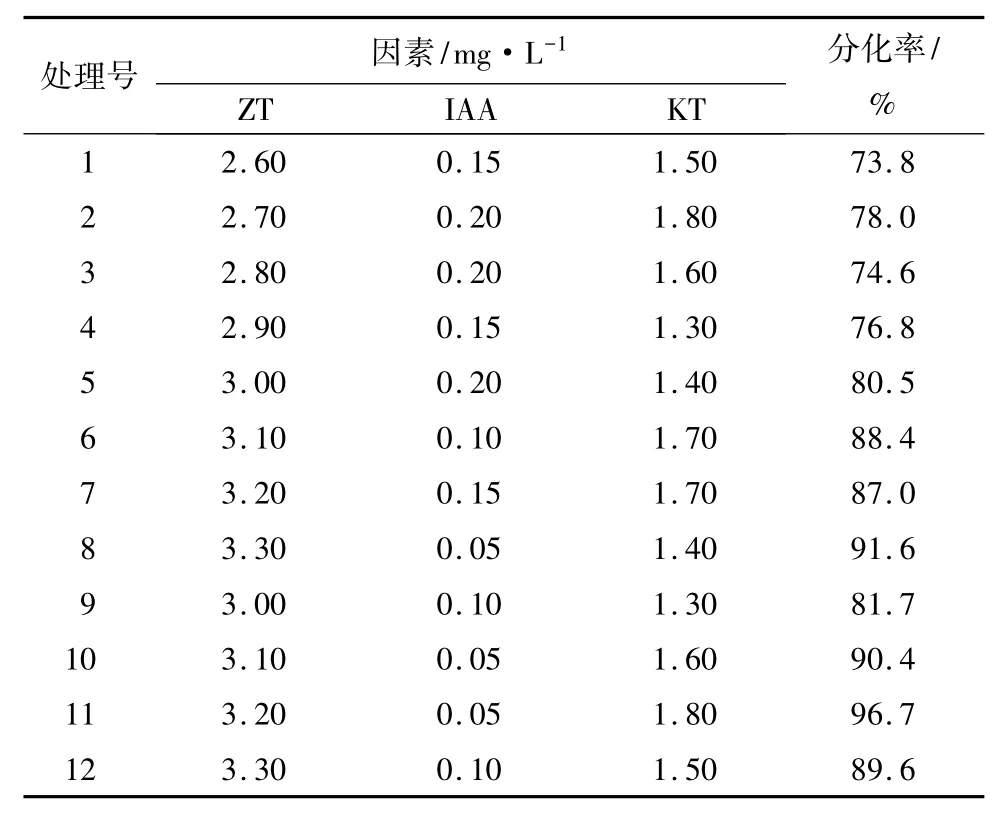
表3 影响鹿角杜鹃愈伤组织再生芽苗分化主要因素的U12(123)试验
鹿角杜鹃嫩叶愈伤组织诱导过程中,对玉米素和吲哚乙酸进行显著性检验可知,玉米素和吲哚乙酸均对愈伤组织诱导率影响显著。由回归分析结果计算出玉米素和吲哚乙酸对回归的贡献率分别为74.3%和31.0%,说明玉米素对愈伤组织的诱导率的贡献远远大于吲哚乙酸,可见玉米素对鹿角杜鹃嫩叶愈伤组织诱导的贡献大于吲哚乙酸,说明玉米素在鹿角杜鹃嫩叶愈伤组织诱导中起主导地位,鹿角杜鹃嫩叶愈伤组织是嫩叶细胞脱分化后经增殖形成的细胞团,细胞的增殖主要依赖于玉米素的细胞分裂和分化作用,吲哚乙酸在嫩叶愈伤组织诱导中促进嫩叶细胞的脱分化;嫩叶愈伤组织再分化过程中,通过显著性检验可知,玉米素、吲哚乙酸和激动素对愈伤组织分化率影响均显著,贡献率分别是19.7%、9.76% 和 10.2%,可见玉米素对愈伤组织芽苗再分化率的贡献大于吲哚乙酸和激动素,说明玉米素在鹿角杜鹃嫩叶愈伤组织芽苗的再分化中起主要作用,这一点体现了玉米素对植物细胞功能分化的作用,吲哚乙酸和赤霉素分别促进了再生芽苗的生长和伸长;在鹿角杜鹃再生芽苗生根过程中,同理,经显著性检验可知,激动素和吲哚丁酸两个因素对生根率影响显著,而吲哚乙酸对生根率影响不显著,激动素和吲哚丁酸对生根的贡献率分别为86.3%和13.7%,表明激动素对再生芽苗的生根贡献远远大于吲哚丁酸,这说明鹿角杜鹃试管苗的生根对激素具有选择性,生根所需的生长素主要依赖于吲哚丁酸,辅以适当浓度的激动素有利于植物细胞趋于根器官功能的分化,并且在鹿角杜鹃生根中激动素其决定性作用。本试验结果同时说明了每种植物对不同植物生长调节物质都具有不同程度的选择性[12],这可能是由植物自身的基因型控制的,而基因型不同又决定了细胞分裂、分化和器官重建所依赖的植物生长调节物质种类及其质量浓度高低有所不同。
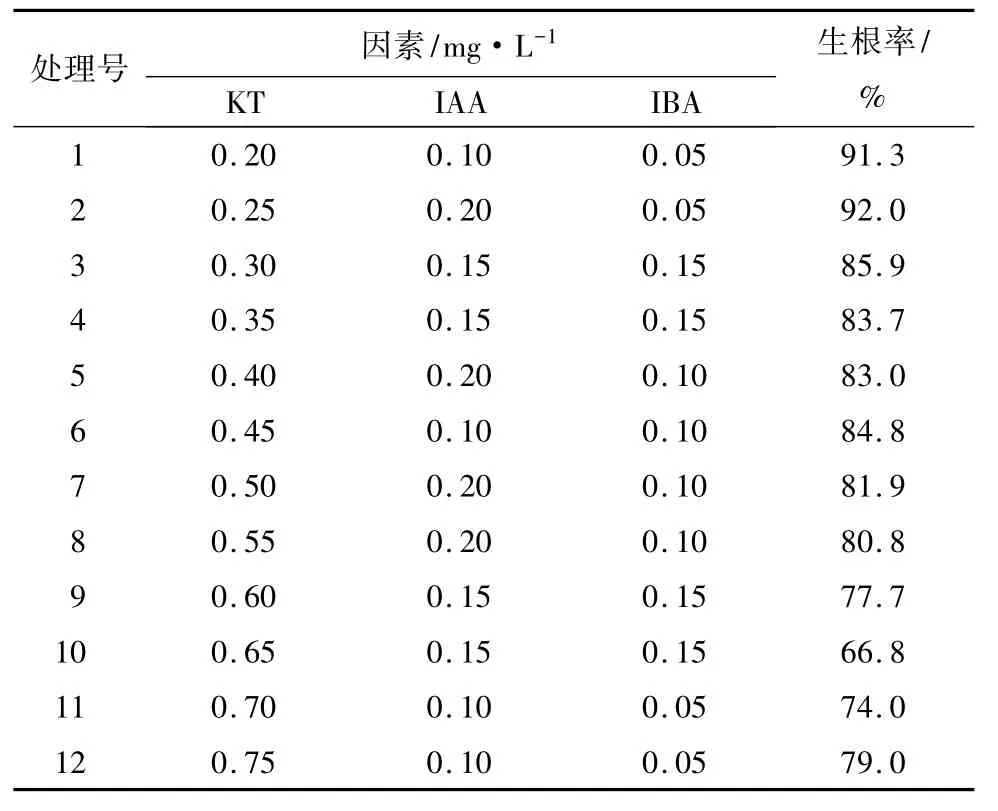
表4 影响鹿角杜鹃生根主要因素的U12(123)试验
目前,国外有许多野生杜鹃优良品种已通过人工繁殖并驯化为园艺栽培种。我国野生杜鹃品种众多,但人工繁殖并开发利用极少。鹿角杜鹃是我国珍稀植物资源和园艺观赏植物,至今未见推广应用。本结果建立了鹿角杜鹃嫩叶离体培养和高效植株再生体系。为鹿角杜鹃和其它野生杜鹃优良品种的开发利用和工厂化育苗奠定基础和提供方法。

图1 鹿角杜鹃嫩叶离体培养和高效植株再生各阶段的形态
[1]向光锋,颜立红,蒋利媛,等.鹿角杜鹃的扦插试验[J].湖南林业科技,2009,36(6):13-14.
[2]汤桂钧,张建安,蒋建平,等.高山杜鹃的组织培养快速繁殖技术研究[J].上海农业学报,2004,20(3):15-18.
[3]黄丽群,谢禄山,颜立红,等.湖南野生鹿角杜鹃资源的园林应用价值开发初探[J].湖南环境生物职业技术学院学报,2008,14(4):8-10.
[4]顾地周,邓志刚,綦茂伟,等.苞叶杜鹃离体培养及种质试管保存体系的建立[J].南京林业大学学报:自然科学版,2009,33(3):20-24.
[5]廖菊阳,朱颖芳,彭春良,等.湖南杜鹃属植物种类及引种适应性初探[J].中南林业调查规划,2010,29(1):45-50.
[6]廖菊阳,闫文德,王光军,等.鹿角杜鹃光合日变化特性分析[J].中南林业科技大学学报,2011,31(5):117-120.
[7]曹孜义,刘国民.实用植物组织培养技术教程[M].兰州:甘肃科学技术出版社,2002.
[8]姜云天,陈艳秋,朱俊义,等.细叶杜香高效快繁体系建立及种质试管保存研究[J].西南大学学报:自然科学版,2009,31(2):118-123.
[9]Danielle JD,William E V,Kwai Y L.The anatomy of tissue cultured red raspberry prior to and after transfer to soil[J].Plant Cell Tissue and Organ Culture,1985(1):43-50
[10]李合生.现代植物生理学[M].北京:高等教育出版社,2002.
[11]王雯雯,马秋月,朱俊义,等.大字杜鹃离体快繁体系建立及种质试管保存研究[J].植物研究,2009,29(2):198-203.
[12]高新一,王玉英.植物无性繁殖实用技术[M].北京:金盾出版社,2003.
