电刺激对大鼠脊髓损伤后神经生长因子表达的影响
2012-08-09陈虹李俊岑党彦丽刘姿辰杨拯张晓
陈虹,李俊岑,党彦丽,刘姿辰,杨拯,张晓
脊髓是中枢神经系统中极易受损的部位,脊髓损伤(SCI)的致残率高,严重危及人类的健康。脊髓损伤后的修复一直是医学领域的难点。神经生长因子(nerve growth factor,NGF)由 Levi-Montgalcini在 1953年首先发现,是神经营养因子(neurotrophic factors,NTFs)的典型代表,TrkA是其受体[1]。脊髓损伤后NGF在一定的条件下,可促进未损伤神经元出芽,重建被破坏的神经回路。NGF在体内和离体条件下都具有维持神经元存活,促使轴突延伸等功能,对脊髓损伤的重建具有重要作用[2-3]。电针疗法属于针灸疗法的一种,是将神经电刺激疗法与中医针灸疗法相结合而形成的。针刺入腧穴得气后,在针灸针具上通以接近人体生物电的微量电流,利用针和电两种刺激相结合,提高针刺的治疗效果。已有研究证明,电针能够促进NTFs的表达,维持周围神经和中枢神经的生长、存活及修复,促进脊髓损伤的修复[4-5]。电针治疗可通过促进NGF及其受体TrkA的表达来使受损神经元得到修复,从而修复脊髓损伤。
1 材料与方法
1.1 实验动物 健康成年SD大鼠72只,雌雄不限,体重(180±20)g,由四川大学实验动物中心提供。分笼饲养,环境温度20℃~25℃。随机分为3组:损伤对照组(n=24)、电刺激组(n=24)和正常组(n=24),各组再分成于造模后l d、3d、5 d、7 d小组,每小组6只。
1.2 动物模型制备 损伤对照组和电刺激组大鼠均用1.5%戊巴比妥钠45 mg/kg腹腔注射麻醉。背部剃毛,常规消毒。以T9为中心,纵行切开皮肤及皮下组织,剥离椎旁肌肉并暴露棘突与椎板,咬除T9椎板,按Allen法[6]用10 g冲击棒自25 mm高处自由坠落致伤脊髓。缝合伤口。术后小心护理,独笼饲养,协助大鼠排尿,每日早晚各1次,至排尿反射恢复;每日注射青霉素80000 U和生理盐水2 ml,抗菌和补充体液,持续至大鼠取材为止。注意观察皮肤有无压疮或感染,下肢有无溃烂。正常组大鼠切除相应椎板后缝合伤口。
1.3 电刺激 术后24 h起对电刺激组大鼠进行经皮电刺激30 min,每天1次,至动物取材。参数设置:疏密波脉冲电流,电流强度中档,刺激频率10 Hz,正极接T7右侧夹脊穴位置的皮肤,负极接右下肢足三里穴位置的皮肤。
1.4 运动功能 各组大鼠在术后1 d、3d、5 d、7 d按Basso,Beattie&Bresnahan(BBB)运动功能评分方法进行评定[7]。
1.5 取材 各组大鼠在术后1 d、3d、5 d、7 d进行取材。用过量的戊巴比妥钠过度麻醉大鼠,自左心室插管后剪开右心耳,灌注加入肝素钠与普鲁卡因的冰生理盐水直到有澄清液从右心耳流出,再灌注4%多聚甲醛1 h。打开椎弓管,切除T7~T11段脊髓,固定24 h后放入自动脱水包埋机处理。修片,连续切片,片厚5μm,连续5张进行贴片、烤片,备用。
1.6 免疫组织化学染色 非生物素二步法进行NGF免疫组化染色。将各组切片置于二甲苯中脱蜡,梯度酒精水化,高压热抗原修复,3%H2O2封闭内源性过氧化物酶,正常山羊血清封闭非特异性抗原。滴加NGF抗体(效价1∶20),4℃冰箱过夜。用兔抗鼠二抗37℃恒温孵育60 min,在切片上加入DAB-H2O2显色液,室温下反应,显微镜下显色充分,及时用0.01 mol/L PBS漂洗;苏木素复染,梯度洒精逐级脱水,二甲苯透明,树胶封片。显微镜下观察NGF的表达,阳性结果为棕黄色反应。
1.7 Western blot 各组大鼠在脊髓损伤后1 d、3d、5 d、7 d深度麻醉后迅速取材,研磨充分。按照每g组织3 ml蛋白裂解/抽提试剂(应含抑制剂)冰水浴上超声5次,每次2 s,间隔10 s;-20℃放置1 h后,10000 g离心30 min,取上清,280 nm紫外光吸收法初步测定蛋白浓度。电泳分离,洗板(薄厚共2块)用洗洁精清洗,自来水冲净,去离子水反复冲洗,组装玻璃板,将其水平放置。制备8%分离胶溶液5 ml,取3.4 ml加入玻璃板中,覆盖一层异丙醇(约2 ml);分离胶聚合完全后(约30 min),倾出覆盖层,用去离子水清洗凝胶顶部数次以去除残留未聚合的丙烯酰胺。尽可能排除凝胶上液体,再用滤纸吸净残留水。制备5%积层胶溶液5 ml,加入玻璃板至灌满。待积层胶聚合完全后(约30 min),置于4℃冰箱中过夜,使之聚合充分。取出凝胶板置于实验台上,使之减冻至室温。在样品中按1∶4体积比加入5×SDS凝脂上样缓冲液配制样品,100℃加热3 min变性。用去离子水洗涤加样槽,将凝胶固定于电泳装置上,上下槽各加入Tris-甘氨酸电极缓冲液。按预定顺序加样,加样量为10~25μl(1.5 mm厚)。
1.8 统计学分析 用OLYMPUS数码照像机采集图像。观察NGF阳性产物在脊髓的分布,分别计数各组脊髓内、中、外3个视野1028μm2面积内NGF的阳性细胞数;测量阳性产物的平均积分光密度值。各组阳性细胞数和平均积分光密度值数据以(±s)表示,用SPSS 13.0软件进行方差分析和LSD组间比较。显著性水平α=0.05。
2 结果
2.1 运动功能 损伤前,3组大鼠BBB评分均为21.00分。脊髓损伤后,损伤对照组、电刺激组BBB评分均小于正常组(P<0.05),损伤后第5天起,电刺激组BBB评分优于损伤对照组(P<0.05)。见表1。

表1 脊髓损伤后不同时间点各组大鼠BBB评分的比较
2.2 免疫组化染色
2.2.1 正常组 NGF免疫反应阳性物主要分布于正常大鼠脊髓灰质前角神经元内(图1),阳性产物的亚细胞定位主要分布于细胞核和胞浆。神经元突起染色相对较浅。此外,少量胶质细胞亦见染色。
2.2.2 损伤对照组 脊髓损伤后1 d,NGF免疫反应阳性细胞数较正常时增多,但无显著性差异(P>0.05);术后3d、5 d、7 d时存在显著性差异(P<0.05)。NGF免疫反应阳性物主要分布于大鼠脊髓灰质前角神经元内,亚细胞定位仍是细胞核和胞浆中,神经元突起染色较深(图2、图4、图6、图8)。
2.2.3 电刺激组 电刺激1 d,NGF免疫反应阳性细胞数较正常组和损伤对照组增多(图3),但无显著性差异(P>0.05)。电刺激3d、5 d、7 d,NGF阳性细胞数逐渐增加(图5、图7、图9),电刺激5 d、7 d,免疫阳性细胞数较正常组和损伤对照组同期增多(P<0.05)。NGF免疫反应阳性物主要分布于大鼠灰质前角神经元内,定位于细胞核和胞浆中,神经元突起染色深,少量胶质细胞中NGF免疫反应阳性。各组灰质前角NGF阳性运动神经元的数量和平均积分光密度值见表2。
2.3 Western blot检测 电刺激组中NGF的表达比损伤对照组明显增多。见图10。

表2 各组脊髓NGF阳性细胞数和平均积分光密度值(n=6)
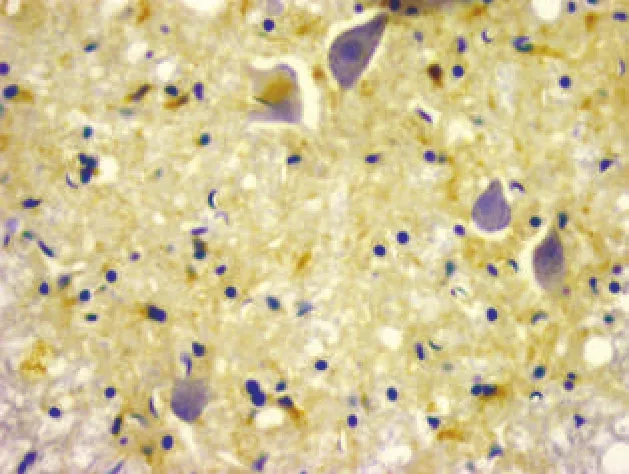
图1 正常组(NGF免疫组化染色,400×)

图2 损伤对照组术后1 d(NGF免疫组化染色,400×)

图3 电刺激组术后1 d(NGF免疫组化染色,400×)

图4 损伤对照组术后3d(NGF免疫组化染色,400×)

图5 电刺激组术后3d(NGF免疫组化染色,400×)
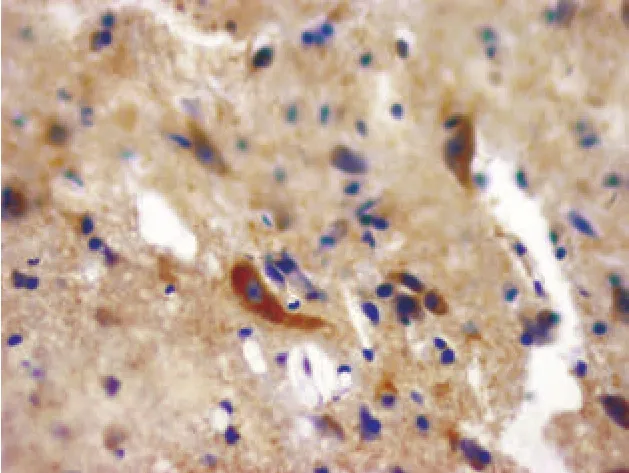
图6 损伤对照组术后5 d(NGF免疫组化染色,400×)
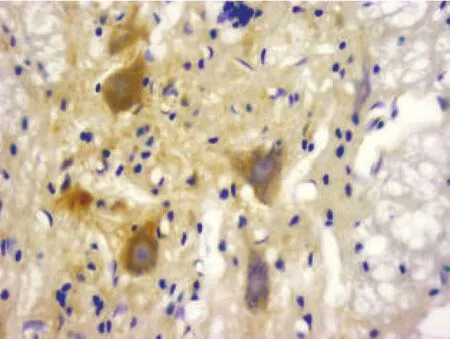
图7 电刺激组术后5 d(NGF免疫组化染色,400×)
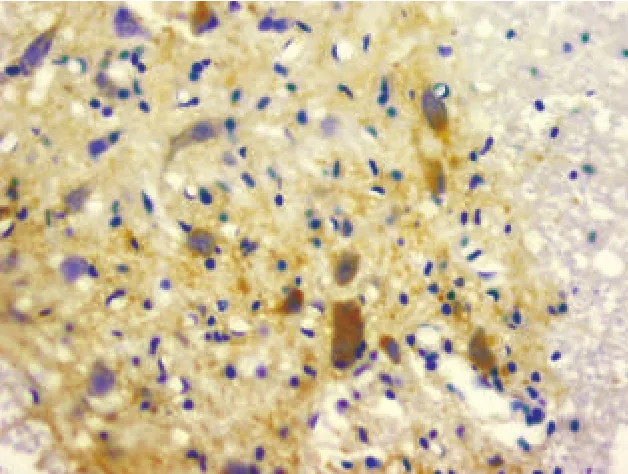
图8 损伤对照组术后7 d(NGF免疫组化染色,400×)

图9 电刺激组术后7 d(NGF免疫组化染色,400×)

图10 Western blot检测
3 讨论
脊髓损伤后,提高神经元的存活质量、促进神经元轴突的生长及定向致靶是恢复脊髓功能的关键;而受损神经元的存活及轴突的再生受内、外环境多种因素的影响。
NGF作为神经营养素家族的一员,来源于靶组织,逆向营养神经元,能促进皮质脊髓束与靶器官建立功能联系和逆转受损神经元的萎缩,并增加神经元的存活率,最终使受损神经修复[8];若得不到NGF的营养,近侧段很快退变,神经元胞体死亡。因此,NGF被认为是神经再生修复的重要因子之一。中枢神经系统损伤后,NGF分泌增加,对维持损伤部位神经元的存活及引导神经纤维再生具有重要意义。但在没有外界干预的情况下,中重度损伤内源性NGF表达量不足以起到保护和修复的作用,且维持时间较短[9]。许多学者通过给予外源性NGF、移植NGF基因修饰后的施万细胞、成纤维细胞来增加损伤局部的NGF的浓度[10],取得一定的治疗效果。
本实验采用术后24 h经皮电刺激治疗脊髓损伤,正极接T9右侧夹脊穴,负极接右下肢足三里穴,目的是在损伤区周围形成一个外加电场,结果发现损伤脊髓局部NGF表达明显增加。
本实验BBB评分显示,脊髓损伤后,损伤对照组和电刺激组大鼠BBB评分值随时间的推移而逐渐增高,且电刺激组大鼠BBB评分在脊髓损伤后5 d、7 d高于损伤对照组。这表明,电刺激有利于促进大鼠后肢功能的恢复,可能是由于电刺激诱导NGF的大量表达,减轻脊髓继发性损伤而致。研究显示,脊髓损伤后针刺可促使脊髓Ⅱ板层、背核和备用背根的背根节(DRG)中NGF和NGF mRNA阳性神经元数量增多,且此效应随时间增长而加强[11]。有报道,NGF在防止脊髓继发性损伤的病理过程中起着重要作用,可促进脊髓及背根节的运动、感觉轴突再生[12]。电针能够提高NGF在损伤脊髓中的阳性表达[13]。
NGF表达增加的机理可能是:电针使受损伤的脊髓神经再生建立新的轴突联系,加速神经营养因子的传输;也可能是电针治疗加速脊髓神经元和传导功能的恢复对NGF的需求减少[14]。具体原因还有待进一步研究。
本实验显示,电刺激能诱导NGF表达,促进后肢运动功能的恢复。我们推测,电刺激NGF表达增加,从而创造有利于神经再生的微环境。但脊髓损伤是一种复杂性的损伤,电刺激治疗脊髓损伤中NGF表达的长期变化有待进一步研究。
[1]Sposato V,Parisi V,Manni L.Glaucoma alters the expression of NGF and NGF receptors in visual cortex and geniculate nucleus of rats:effect of eye NGF application[J].Vision Res,2009,49(1):54-63.
[2]Huang F,Dong X,Zhang L.The neuroprotective effects of NGF combined with GM1 on injured spinal cord neurons in vitro[J].Brain Res Bull,2009,79(1):85-88.
[3]Hajebrahimi Z,Mowla SJ,Movahedin M.Gene expression alterations of neurotrophins,their receptors and prohormone convertases in a rat model of spinal cord contusion[J].Neurosci Lett,2008,441(3):261-266.
[4]Paul C,Samdani AF,Betz RR.Grafting of human bone marrow stromal cells into spinal cord injury:a comparison of delivery methods[J].Spine,2009,34(4):328-334.
[5]Yamasaki K,Setoguchi T,Takenouchi T.Stem cell factor prevents neuronal cell apoptosis after acute spinal cord injury[J].Spine,2009,34(4):323-327.
[6]Allen AR.Surgery of experimental lesion of spinal cordequivalent to crush injury of fracture dislocation of spinal column:A preliminary report[J].JAm MedAssoc,1991,57:878-880.
[7]Basso DM,Beattie MS,Bresnahan JC,et al.MASCIS evaluation of open field locomotor scores:effete of experience and teamwork on reliability multieenter animal spinal cord injury study[J].J Neurotrauma,1996,13(7):343-359.
[8]Liel DJ,Huang W,Yong W,et al.Regulation of Trk receptor following conunsion of the rut spinal cord[J].Nerol,2001,167(1):15-26.
[9]Widenfalk J,Lundstromer K,Jubran M,et al.Neurotrophic factors and receptors in the immature and adult spinal cord after meehanical injury or kainic acid[J].J Neurosci,2001,21(10):3457-3475.
[10]Tuszynski MH,Grill R,Jones LL,et al.Spontaneous and augmented growth of axons in the primate spinal cord:Effects of local injury and nerve growth factor-secreting cell grafts[J].J Comp Neurol,2002,449(1):88-101.
[11]谌宏鸣,吴良芳,保天然.针刺对部分去背根猫脊髓和背根节NGF及mRNA的影响[J].神经解剖学杂志,2000,16(4):311.
[12]黄纯海,王廷华,李群.脊髓全横断大鼠神经生长因子和脑源性神经营养因子表达及三七皂苷的干预效应[J].中国组织工程研究与临床康复,2007,11(41):8276-8279.
[13]李晓宁,宋金柱,苏志强.夹脊电针对大鼠脊髓损伤后NGF和BDNF表达的影响[J].哈尔滨工业大学学报,2007,39(12):2014-2016.
[14]王新家,孔抗美,叶卫莲,等.针刺影响慢性脊髓损伤大鼠脊髓组织神经生长因子及其受体的表达[J].中医正骨,2005,17(5):6-7.
