不同液体治疗方案对患者脑组织含水量、颅内压以及脑组织水通道蛋白-4和N-甲基-D-天冬氨酸受体-1表达的影响
2012-08-09张雪宁刘小滨
王 霞,刘 超,张雪宁,闵 苏,刘 东,魏 珂,董 军,罗 洁,刘小滨
1天津市人民医院急诊科,天津 300121
2天津医科大学 第二医院放射科,天津 300211
3重庆医科大学 附属第一医院麻醉科,重庆 400016
4天津医科大学 第二医院神经外科,天津 300211
神经外科围手术期脑水肿严重影响手术进行和术后患者脑功能恢复。既往研究仅监测不同液体治疗对患者血流动力学和脑脊液压力的影响,对不同液体治疗方案对脑组织水转运影响的研究较少,神经外科的液体治疗方案一直是麻醉界的主要争论焦点之一,影响临床恰当液体治疗方案的制定。中枢神经系统水、电解质分布失衡与水分子的跨膜转运有关。水通道蛋白家族 (aquaporins,AQPs)可调节细胞水通透性,与脑水肿密切相关[1-3],其中AQP-4是脑组织中最主要的AQPs[4],也是产生细胞水肿的“最后共同通道”[5];神经元突触大量释放的兴奋性氨基酸通过N-甲基-D-天门冬氨酸受体 (N-methyl-D-aspartic acid receptor,NMDAR)产生的神经毒性作用是导致脑组织中AQP-4等基因的激活从而引起脑水肿及神经元凋亡等迟发性损伤的主要原因[6]。本研究拟在限制液体总量的同时,考察使用不同胶体以及不同晶胶比对患者颅内压、脑组织含水量和脑组织AQP-4、NMDAR-1表达的影响以及术后2 h患者的格拉斯哥昏迷量表评分 (Glasgow Coma Scale,GCS),以揭示围手术期脑水转运的机制,探求神经外科围手术期适宜的液体治疗方案。
资料和方法
材料 小鼠抗人AQP-4单克隆抗体 (英国,AbD Serotec公司);兔抗人NMDAR-1单克隆抗体(美国 US Biological公司);4% 琥珀酰明胶 (4%Gelofusine,佳乐施,GEL,沈阳贝朗制药有限公司);6%中分子羟乙基淀粉200/0.5(6%羟乙基淀粉200/0.5和氯化钠注射液,商品名贺斯或HES,德国费森尤斯卡比医药有限公司);乳酸钠林格氏液 (RL,上海百特医疗用品有限公司);BJM428SOPHYSA型颅内压监护仪 (法国SOPHYSA公司);蛋白电泳系统(美国Bio-rad公司);二氨基联苯胺显色试剂盒 (上海碧云天生物有限公司);金盘多媒体图像处理系统(成都金盘电子科大多媒体技术有限公司);光学显微照相系统 (Olympus-45,日本Olympus公司)。
对象 入选标准:确诊癫痫拟行癫痫灶切除术的患者,性别不拘,年龄15~45岁,术前无放疗病史和心脑血管病史,美国麻醉师协会分级Ⅰ~Ⅲ级。排除标准:围手术期使用血管活性药物、利尿药;围手术期出血量>500 ml,需进行血制品输注治疗;围手术期颅脑感染。研究方案经我院医学伦理委员会批准,所有患者均于研究前了解研究全部过程并签署知情同意书。
研究设计和分组 采用随机单位组2×2析因设计:将每例入选对象视为1个单位,对每个单位施以2个处理因素,即胶体因子 (2水平:4%琥珀酰明胶、6%中分子羟乙基淀粉)和晶胶比因子 (2水平:0∶1、1∶1)的所有组合 (共4组,n=8)。通过随机数字发生器将32例患者随机分为4组 (n=8):Ⅰ组 (4% 琥珀酰明胶,晶胶比0∶1)、Ⅱ组 (6%中分子羟乙基淀粉,晶胶比0∶1)、Ⅲ组 (4% 琥珀酰明胶,晶胶比1∶1)、Ⅳ组 (6%中分子羟乙基淀粉,晶胶比1∶1)(晶体使用乳酸林格氏液)。
麻醉和手术 芬太尼、维库溴胺、咪唑安定麻醉诱导,气管插管保证双肺良好通气,以丙泊酚静脉泵注及七氟醚吸入复合麻醉维持,间断给予芬太尼加强镇痛,维库溴胺保证肌肉松弛。呼吸参数设定:潮气量8 ml/kg,吸入氧浓度80%,调整呼吸频率,保持呼气末二氧化碳分压在35~45 mmHg(1 mmHg=0.133 kPa)。术中连续监测血压、心率和尿量,且所有患者的麻醉由同一组麻醉医师完成,所有患者的手术采用相同的手术方式,由同一组手术医师完成,留取切除脑组织块中灶区的周围区域组织块。
液体治疗方案 手术前1 h分别输注晶胶比0∶1、1∶1,输注4%琥珀酰明胶、6%中分子羟乙基淀粉各10 ml/kg,进行急性高溶性血液稀释。术中液体治疗仍按相应分组的方案输注,速度:5ml/(kg·h)。
颅内压持续监测 将BJM428SOPHYSA型颅内压监护仪测量导管植入大脑额叶硬膜下,与颅内压监护仪连接持续监测患者颅内压。每15分钟记录患者呼气相的颅内压数值,统计时取整个液体治疗期间平均值。
材料处理 在去DEPC水制成的冰面上吸除血迹,分离双侧脑组织为A、B两份。A份用锡铂纸标记包裹后置于液氮中过夜,然后保存于-80℃超低温冰箱中,备做Western blot;B份称量湿重后,置入80℃恒温电烤箱中烘烤72 h至恒重 (两次称重差别≤0.2 mg)。
干燥法测定脑含水量 按照Elliott公式 [脑组织含水量 =(湿重 -干重)/湿重 ×100%]计算 B份脑组织含水量。
Western blot检测 AQP-4和NMDAR-1在神经元中的表达 取A份脑组织匀浆0.2 g,经Western及免疫沉淀细胞裂解液提取蛋白,再用BCA蛋白浓度测定试剂盒测定蛋白浓度,据此调节蛋白浓度一致。取等量蛋白样品,用5×SDS加样缓冲液按1∶1(V/V)稀释待测样品,于100℃煮沸5 min;另用1×SDS加样缓冲液溶解预染蛋白质相对分子质量标准混合物,于100℃煮沸3 min。取待测标本15 μl上样 (甘油醛-3-磷酸脱氢酶作为蛋白质上样量的标定),经SDS-PAGE电泳至预染蛋白质相对分子质量标准所示目的相对分子质量出现为止,用湿法将蛋白条带电转至聚偏二氟乙烯膜,50 g/L脱脂奶粉封闭3 h,加入相应抗体 [小鼠抗人AQP-4单克隆抗体、兔抗人NMDAR-1单克隆抗体 (1∶200)]4℃孵育过夜,使用相应辣根酶标记IgG(1∶200)37℃孵育2 h,采用二氨基联苯胺显色,金盘多媒体图像处理系统测定阳性条带的积分光密度值。
格拉斯哥昏迷量表评分 手术后2 h,在病房对患者进行随访和格拉斯哥昏迷量表评分。评分由非手术参与医生进行,评分过程严格执行双盲原则。
结 果
颅内压持续监测结果 6%中分子羟乙基淀粉较4% 琥珀酰明胶以及晶胶比1∶1较晶胶比0∶1均可增加液体治疗期间的平均颅内压 (F=55.714,P=0.000;F=142.432,P=0.000);两者的影响呈相加效果,即晶胶比1∶1和6%中分子羟乙基淀粉两因素叠加造成患者液体治疗期间颅内压进一步升高 (F=11.056,P=0.002)(表1)。
脑组织含水量变化 6%中分子羟乙基淀粉较4%琥珀酰明胶以及晶胶比1∶1较晶胶比0∶1均可显著增加液体治疗后的脑组织含水量 (F=31.477,P=0.000;F=84.896,P=0.000);两者的影响呈相加效果,即晶胶比1∶1和6%中分子羟乙基淀粉两因素叠加造成患者液体治疗后脑组织含水量进一步升高(F=8.007,P=0.008)(表2)。
Western blot检测AQP-4和NMDAR-1在神经元中的表达 6%中分子羟乙基淀粉较4% 琥珀酰明胶以及晶胶比1∶1较晶胶比0∶1均可增加液体治疗后的脑组织AQP-4的表达 (F=37.205,P=0.000;F=149.652,P=0.014);两者的影响呈相加效果,即晶胶比1∶1和6%中分子羟乙基淀粉两因素叠加造成患者液体治疗后AQP-4的表达进一步升高 (F=5.038,P=0.033)(图1、表3)。
6%中分子羟乙基淀粉较4%琥珀酰明胶以及晶胶比1∶1较晶胶比0∶1均可增加液体治疗后的脑组织NMDAR-1表达 (F=29.664,P=0.000;F=65.951,P=0.000);两者的影响呈相加效果,即晶胶比1∶1和6%中分子羟乙基淀粉两因素叠加造成患者液体治疗后脑组织NMDAR-1表达进一步升高 (F=5.020,P=0.033)(图1、表4)。
格拉斯哥昏迷量表评分 6%中分子羟乙基淀粉较4%琥珀酰明胶以及晶胶比1∶1较晶胶比0∶1对手术后格拉斯哥昏迷量表评分差异均无统计学意义 (P>0.05)(表5)。
表1 不同液体治疗期间患者的颅内压变化 (n=8,,kPa)Table 1 Changes of intracranial pressure upon different liquid therapies(n=8,,kPa)
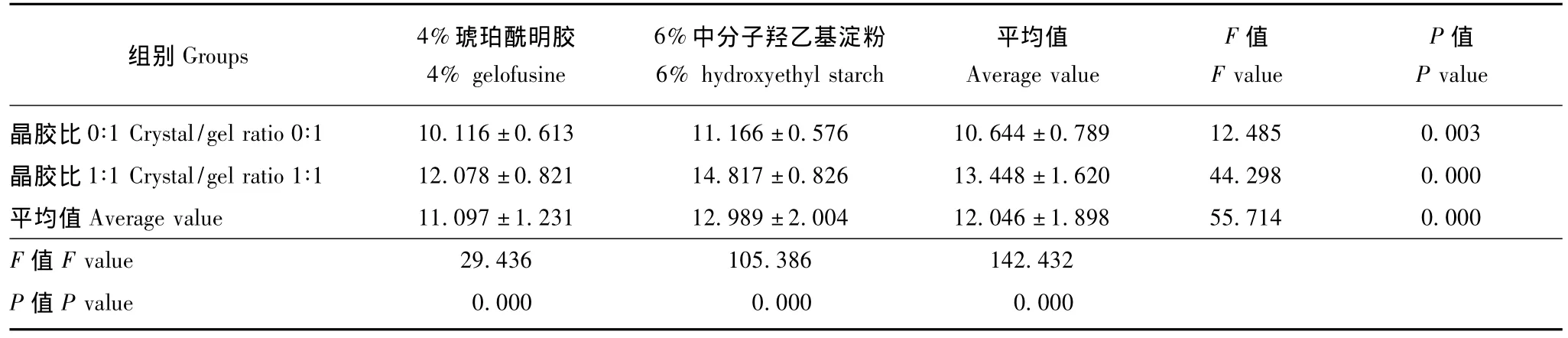
表1 不同液体治疗期间患者的颅内压变化 (n=8,,kPa)Table 1 Changes of intracranial pressure upon different liquid therapies(n=8,,kPa)
组别Groups 4%琥珀酰明胶4%gelofusine 6%中分子羟乙基淀粉6%hydroxyethyl starch平均值Average value F值F value P值P value晶胶比 0∶1 Crystal/gel ratio 0∶1 10.116±0.613 11.166 ±0.576 10.644±0.789 12.485 0.003晶胶比 1∶1 Crystal/gel ratio 1∶1 12.078±0.821 14.817 ±0.826 13.448±1.620 44.298 0.000平均值Average value 11.097±1.231 12.989±2.004 12.046±1.898 55.714 0.000 F值F value 29.436 105.386 142.432 P值P value 0.000 0.000 0.000
表2 不同液体治疗前后患者的脑组织含水量变化 (n=8,,%)Table 2 Changes of brain water content upon different liquid therapies(n=8,,%)
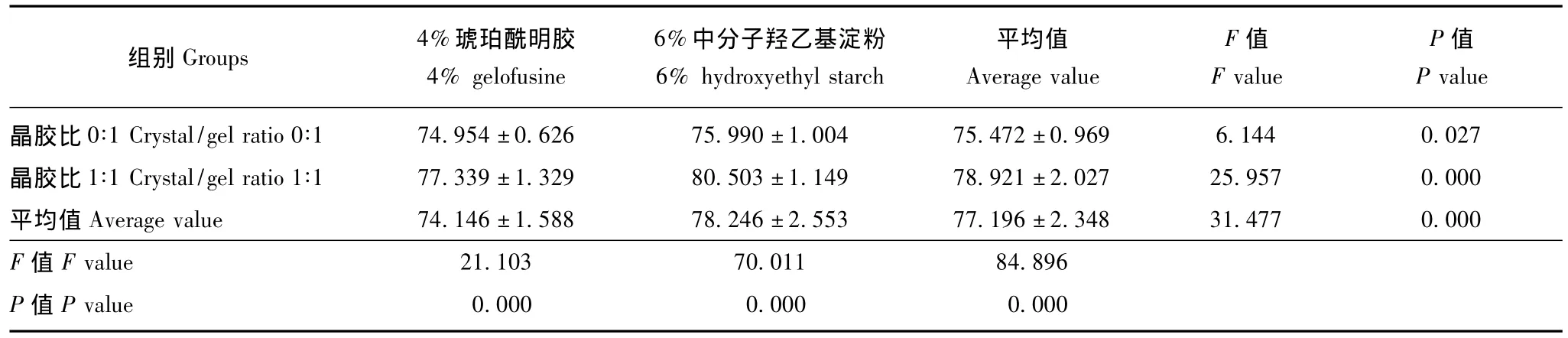
表2 不同液体治疗前后患者的脑组织含水量变化 (n=8,,%)Table 2 Changes of brain water content upon different liquid therapies(n=8,,%)
组别Groups 4%琥珀酰明胶4%gelofusine 6%中分子羟乙基淀粉6%hydroxyethyl starch平均值Average value F值F value P值P value晶胶比 0∶1 Crystal/gel ratio 0∶1 74.954±0.626 75.990 ±1.004 75.472±0.969 6.144 0.027晶胶比 1∶1 Crystal/gel ratio 1∶1 77.339±1.329 80.503 ±1.149 78.921±2.027 25.957 0.000平均值Average value 74.146±1.588 78.246±2.553 77.196±2.348 31.477 0.000 F值F value 21.103 70.011 84.896 P值P value 0.000 0.000 0.000
表3 水通道蛋白-4在神经元中的表达 (免疫印迹法,积分吸光度值)(n=8,)Table 3 Expression of aquaporin-4 in the brain tissue(Western blot,integral absorbance value)(n=8,)
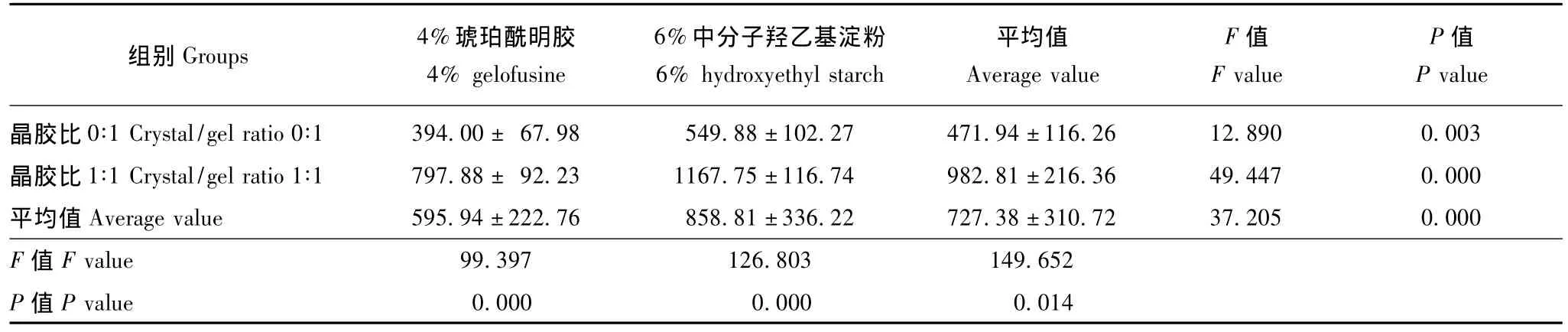
表3 水通道蛋白-4在神经元中的表达 (免疫印迹法,积分吸光度值)(n=8,)Table 3 Expression of aquaporin-4 in the brain tissue(Western blot,integral absorbance value)(n=8,)
组别Groups 4%琥珀酰明胶4%gelofusine 6%中分子羟乙基淀粉6%hydroxyethyl starch平均值Average value F值F value P值P value晶胶比 0∶1 Crystal/gel ratio 0∶1 394.00± 67.98 549.88±102.27 471.94±116.26 12.890 0.003晶胶比 1∶1 Crystal/gel ratio 1∶1 797.88± 92.23 1167.75±116.74 982.81±216.36 49.447 0.000平均值Average value 595.94±222.76 858.81±336.22 727.38±310.72 37.205 0.000 F值F value 99.397 126.803 149.652 P值P value 0.000 0.000 0.014
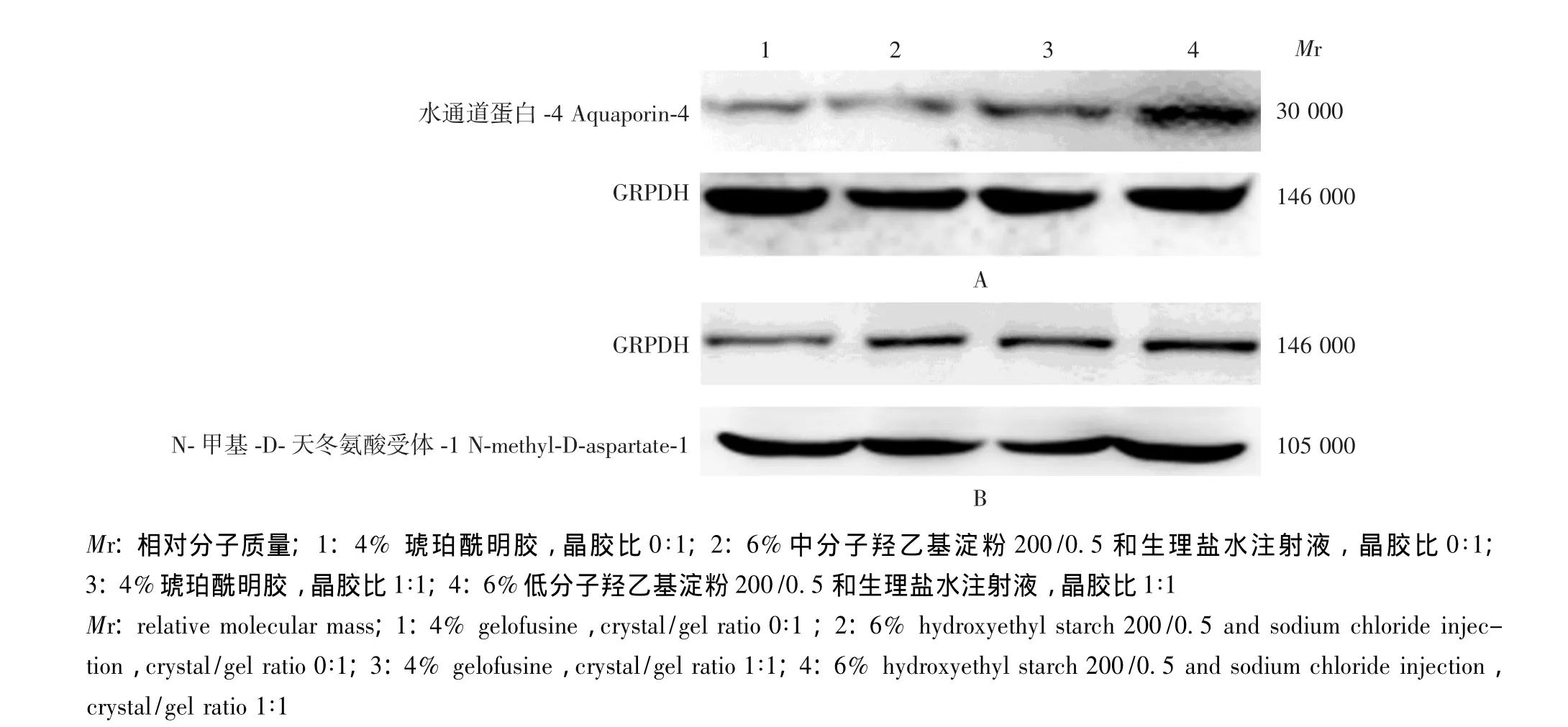
图1 水通道蛋白-4(A)和N-甲基-D-天冬氨酸受体-1(B)在脑中的免疫印迹法的显影结果Fig 1 Expressions of aquaporin-4(A)and N-methyl-D-aspartate-1(B)in the brain tissue(Western blot)
表4 N-甲基-D-天冬氨酸受体-1在脑中的表达 (免疫印迹法,积分吸光度值)(n=8,)Table 4 Expression of N-methyl-D-aspartate-1 in the brain tissue(Western blot,integral absorbance value)(n=8,)
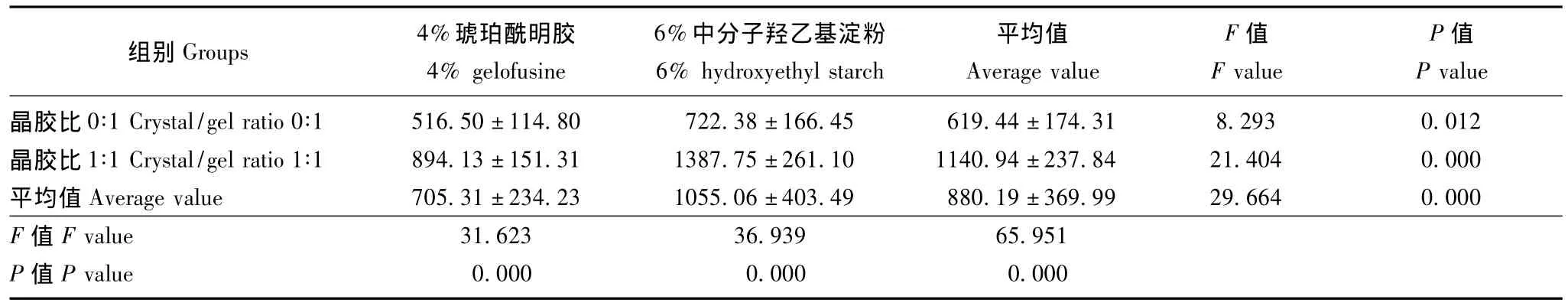
表4 N-甲基-D-天冬氨酸受体-1在脑中的表达 (免疫印迹法,积分吸光度值)(n=8,)Table 4 Expression of N-methyl-D-aspartate-1 in the brain tissue(Western blot,integral absorbance value)(n=8,)
?
表5 格拉斯哥昏迷量表评分 (手术后2 h)(n=8,)Table 5 Glasgow coma scores 2 hours after operation(n=8,)
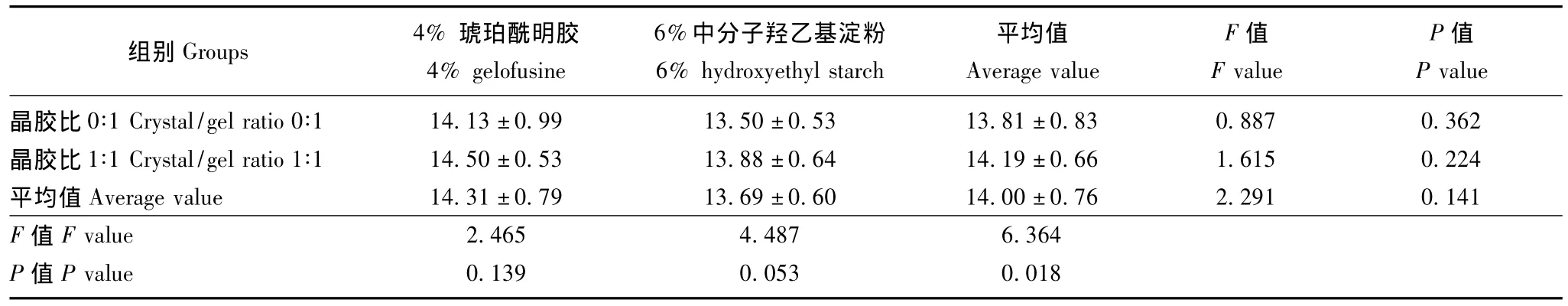
表5 格拉斯哥昏迷量表评分 (手术后2 h)(n=8,)Table 5 Glasgow coma scores 2 hours after operation(n=8,)
?
讨 论
目前国内常用的胶体为4%琥珀酰明胶和6%羟乙基淀粉[7]。此前,对液体治疗的研究仅限于检测某些生理指标的变化,由于研究手段的局限,对于围手术期液体治疗对脑组织水转运的影响知之较少,较大程度影响了临床恰当液体治疗方案的制定。
脑水肿的直接监测指标是颅内压,而脑含水量改变是脑水肿的最终表现。本研究显示不同的胶体及不同晶胶比影响手术中颅内压和术后脑含水量,琥珀酰明胶优于中分子羟乙基淀粉、晶胶比0∶1优于1∶1;同时显示和晶体液不同配比的两种胶体均不会造成颅内压和脑含水量高于正常水准。目前,由于缺乏证据,对于各种胶体在神经外科手术中胶体液的选择较为盲目,这一结果或可提供参考。此外,临床多认为常规手术中晶胶比1∶1是最佳配比,这与本研究结果矛盾,可能需要更多研究者探讨。
在细胞内外和血管内外的水分子转运存在逆浓度梯度的转运过程,这一功能与水通道蛋白密切相关,即脑内微环境改变导致AQPs表达上调[1-3],引起某些活性物质分泌异常,导致细胞膜结构发生改变[8],增加细胞膜对水的通透性,从而导致血脑屏障通透性增加,两者的变化又进一步加剧脑组织含水量的增加,进一步促进脑水肿的形成[9]。
AQPs是90年代初发现的一种膜蛋白,广泛分布于机体的不同组织器官中,介导不同类型细胞膜的跨膜水转运,目前在哺乳动物中已发现13种AQPs亚型 (AQP 0-12)[10]。AQP-4是脑组织中含量最多、分布最广的水通道蛋白,在脑内主要分布于星形胶质细胞、脑表面的软脑膜、脑室系统的室管膜、脉络丛、下丘脑的视上核和视旁核,对维持脑内水平衡发挥重要的作用[11]。
本研究显示中分子羟乙基淀粉相对琥珀酰明胶、晶胶比 0∶1相对晶胶比 1∶1,会增加 AQP-4和NMDAR-1在脑中的表达。这一结果与 Thrane等[4]、胡惠等[5]和鲁宏等[12]研究显示AQP-4是星形胶质细胞水肿的重要分子基础、是产生细胞水肿的“最后共同通道”相一致。此外,Li等[6]研究显示神经元突触大量释放的兴奋性氨基酸通过NMDAR产生的神经毒性作用可能是导致脑组织中AQP-4等基因的激活从而引起脑水肿及神经元凋亡等迟发性损伤的主要原因,这一结果在本研究同样得到证实。
另有研究认为,AQP-4的功能可能是双方面的,它可能导致脑水肿性形成和发展,也可能起到保护作用,即在大脑局部缺血的病理情况下,AQP-4可能通过调控水的转运,既参与脑水肿的形成、又参与其消退[13]。其原因可能为:增高的AQP-4可能是机体为调解细胞外间隙过多的水分和K+的一种保护性反应,但过度增高的AQP-4会使进入细胞内的水分增加,从而促进细胞毒性脑水肿的形成[14-15]。这些研究结合本研究结果,提示临床工作者不同的胶体和晶胶比对AQPs及其对脑水转运调节的影响很可能是多方面和多方向的。
此外,本研究显示各种液体治疗方案对术后2 h患者的格拉斯哥昏迷量表评分无明显影响,且都在安全范围之内,皆可安全使用于神经科手术中;若考虑术中颅内压的变化因素,则4%琥珀酰明胶较6%中分子羟乙基淀粉、晶胶比1∶1较晶胶比0∶1对脑含水量及颅内压的控制更好,更适合神经外科围手术期使用。
[1]Oliva AA Jr,Kang Y,Truettner JS,et al.Fluid-percussion brain injury induces changes in aquaporin channel expression [J].Neuroscience,2011,180(4):272-279.
[2]Blocher J,Eckert I,Elster J,et al.Aquaporins AQP1 and AQP4 in the cerebrospinal fluid of bacterial meningitis patients [J].Neurosci Lett,2011,504(1):23-27.
[3]Ibata K,Takimoto S,Morisaku T,et al.Analysis of aquaporin-mediated diffusional water permeability by coherent anti-stokes Raman scattering microscopy [J].Biophys J,2011,101(9):2277-2283.
[4]Thrane AS,Rappold PM,Fujita T,et al.Critical role of aquaporin-4(AQP-4)in astrocytic Ca2+signaling events elicited by cerebral edema [J].Proc Natl Acad Sci USA,2011,108(2):846-851.
[5]胡惠,鲁宏,何占平.水通道蛋白-4 mRNA沉默可抑制离体缺氧星形胶质细胞水通道蛋白-4的表达 [J].解剖学杂志,2011,34(1):355-359.
[6]Li YK,Wang F,Wang W,et al.Aquaporin-4 deficiency impairs synaptic plasticity and associative fear memory in the lateral amygdala:involvement of downregulation of glutamate transporter-1 expression [J].Neuropsychopharmacology,2012,37(8):1867-1878.
[7]赵砚丽,张东,霍树平.两种羟乙基淀粉急性高容量血液稀释对病人凝血功能的影响 [J].中华麻醉学杂志,2005,25(9):716-718.
[8]顾凤明,张连山.加压素对大鼠内耳水通道蛋白7表达的影响 [J].中国医学科学院学报,2008,30(6):659-662.
[9]李燕华,罗永坚,李吕力,等.脑缺血后AQP-9表达与血脑屏障通透性的关系 [J].中风与神经疾病杂志,2008,25(1):33-35.
[10]Ribeiro MC,Hirt L,Bogousslavsky J,et a1.Time course of aquapo rin expression after transient focal cerebral ischemia in mice [J].J Neurosci Res,2006,83(7):1231-1240.
[11]张兴业,孙善全,刘辉.局灶性缺血再灌注大鼠AQP 4与Kir 4.1表达与脑水肿正相关[J].基础医学与临床,2010,30(8):785-789.
[12]鲁宏,胡惠,何占平.氯化钴诱发缺氧对体外星形胶质细胞水通道蛋白4表达的影响 [J].中华神经科杂志,2011,44(2):117-121.
[13]Lu H,Hu H,He ZP,et al.Reperfusion of the rat brain tissues following acute ischemia:the correlation among diffu-sion-weighted imaging,histopathology,and aquaporin-4 expression [J].Chin Med J(Engl),2011,124(19):3148-3153.
[14]楚燕飞,李兵仓,王建民,等.大鼠颅脑爆炸伤后水通道蛋白-4的表达变化 [J].中国创伤杂志,2006,22(5):377-381.
[15]Dua RK,Devi BI,Yasha TC.Increased expression of Aquaporin-4 and its correlation with contrast enhancement and perilesional edema in brain tumors [J].Br J Neurosurg,2010,24(4):454-459.
