家禽MSTN基因转录子的克隆及真核表达
2012-08-08隋世慧
胡 兰,隋世慧
(沈阳农业大学畜牧兽医学院,沈阳 110161)
肌生成抑制素基因(Myostatin,MSTN)是1997年发现的一种新的生长因子,该基因编码的蛋白质是转化因子β(TGF-β)超家族中的一员;但是,MSTN基因编码蛋白与TGF-β超家族其他成员的同源性比较低,最高不超过45%[1]。研究发现该基因对骨骼肌的生长具有负调控作用,因此将其命名为肌生成抑制素基因。MSTN基因缺失鼠肌肉增大,骨骼肌肌群分布更广泛,体重大约是野生鼠2倍[2];Grobet发现双肌牛中该基因发生突变,在同样喂食条件下,双肌牛比普通牛多提供30%的肉产品[3]。已经证明MSTN基因存在于各种动物体内,其中猪MSTN cDNA全部序列为1 253 bp,牛、鸡、鹌鹑、鸽子和鹅的MSTN cDNA均为1 128 bp,担尼鱼MSTNcDNA为1 125 bp,鲶鱼MSTNcDNA为1 170 bp。除鱼类外,该基因核苷酸序列在不同物种间具有较强的保守性。小鼠、大鼠、人、猪、鸡、火鸡MSTNcDNA的C端序列同源性为100%;而狒狒、牛和绵羊比较仅有1~3个碱基的区别[4-6]。
Robers等首次在大马哈鱼不同组织里发现MSTN蛋白的两个异构体[7];同年10月,在大马哈鱼体内发现两种MSTNmRNA,将其分别命名为MSTNⅠ和MSTNⅡ;后又进一步证明MSTNⅠ和MSTNⅡ转录子在鱼胚和成年鱼中都有表达[8]。Biga等报道在斑马鱼体内亦存在两种MSTNmRNA[9];2005年,Kerr等通过试验证明这种现象在鱼体内普遍存在[10]。Garikipati等报道在大马哈鱼体内普遍存在4种不同的MSTN基因,分别命名为rtMSTN-1a, rtMSTN-1b, rtMSTN-2a 和 rtMSTN-2b[11]。
到目前为止,除在鱼体内发现不同的MSTNcDNA,在其他动物均未见报道。我们在以前的研究工作中偶然发现家禽体内可能存在有多种MSTNcDNA。本研究旨在利用分子生物学手段,确定家禽体内MSTN基因转录子的种类、序列差异及真核表达情况,从而为进一步研究该基因的作用途径及调控机制提供试验依据。
1 材料与方法
1.1 材料
1.1.1 试验动物
试验用海兰鸡、白羽鸡和寿光鸡由沈阳农业大学种鸡场提供,每个品种数量为3只,均为1日龄。
1.1.2 菌株和质粒
工程菌株DH5α、scs110、TA克隆载体pMD-18 T simple vector购自宝生物工程(大连)公司;质粒pEGFP-N1均为本实验室保存产品,
1.1.3 工具酶和主要试剂
RNAiso Reagent、 RNA PCR Kit(AMV)Ver.3.0、DH5α感受态细胞、限制性内切酶BamH I和XhoI(购自大连宝生物公司);DMEM培养基、胎牛血清(购自GIBCO公司);Lipofectamine2000脂质体(购自Invitrogen公司);其他试剂均为国产分析纯。
1.2 方法
1.2.1 腿鸡总RNA的提取
在无菌条件下,将1日龄寿光、海兰、白羽鸡处死、取腿肌,迅速将其放入-80℃超低温冰箱以备用;利用总RNA提取试剂盒提取腿肌总RNA。
1.2.2 RT-PCR引物设计与合成
根据GenBank中的鸡MSTN基因序列,利用Primer(version 5.0)和Oligo6.22软件设计一对寡核苷酸引物,两引物内包含MSTN基因的全部开放阅读框,并在上下游引物的5'端分别加入保护碱基和酶切位点。引物由宝生物工程(大连)有限公司合成。引物序列如下:
上游引物 5'CCGCGGGATCCATGCAAAAGC TAGCAGTCTATGTTT 3'(引入BamH I酶切位点);
下游引物 5'ACCGCCCTCGAGTCATGAGCAC CCGCAACGATCTACAA 3'(引入XhoI酶切位点)。
1.2.3 MSTN cDNA扩增
RT-PCR反应按TaKaRa RNA PCR Kit(AMV)Ver.3.0说明书进行。反转录反应条件:42℃30 min,99℃ 5 min,5℃ 5 min。PCR扩增反应条件:94℃预变性2 min,94℃变性30 S,55℃退火30 S,72℃延伸2 min 30 s,35个循环,72℃终止5 min。PCR产物用1%琼脂糖凝胶电泳检测,染色后于紫外光下照相。
1.2.4 MSTN cDNA的克隆和测序
PCR产物经1.5%琼脂糖凝胶纯化后进行TA克隆,然后转化大肠杆菌DH5α,培养、提取质粒,单、双酶切鉴定,将筛选出来的阳性TA克隆质粒送宝生物工程(大连)有限公司测序。
1.2.5 真核表达载体的构建
用BamH I/XhoI双酶切pEGFP-N1表达载体和用TA克隆阳性质粒,电泳检测并回收酶切产物,按照表达载体:目的片段=3∶2的比例16℃过夜连接,转化、鉴定方法同TA克隆。鉴定正确的重组质粒命名为pEGFP-N1-cMSTN-1和pEGFP-N1-cMSTN-2。
1.2.6MSTN基因在鸭胚成纤维细胞中的表达
常规方法培养14日龄鸭胚成纤维细胞,待细胞长满瓶底传代鉴定为成纤维细胞后,调整细胞浓度为2×106个·mL-1,铺6孔板。按Lipofectamine 2000转染试剂说明书进行转染,每孔加入0.5 mL转染混合物,置37℃培养箱中继续培养。转染1 h后,再加入完全培养基至5 mL·孔-1,继续培养48 h。
1.2.7 转染细胞中MSTN蛋白表达的检测
转染后48 h,用荧光显微镜观察细胞中绿色荧光蛋白的表达情况,利用RT-PCR检测瞬时转染细胞的MSTN mRNA量以及利用SDS-PAGE电泳分析表达产物水平。
2 结果与分析
2.1 MSTN基因的RT-PCR结果
以1日龄海兰鸡、白羽鸡、和寿光鸡腿肌为试材,进行RT-PCR扩增,产物经1%琼脂糖凝胶电泳检测,见图1,扩增产物均呈现3条清晰电泳条带。其中一条电泳带在1.1 kb处,与已经报道的鸡MSTN cDNA全长序列大小相符;另外,在750和1 000 bp处也均有清晰条带。
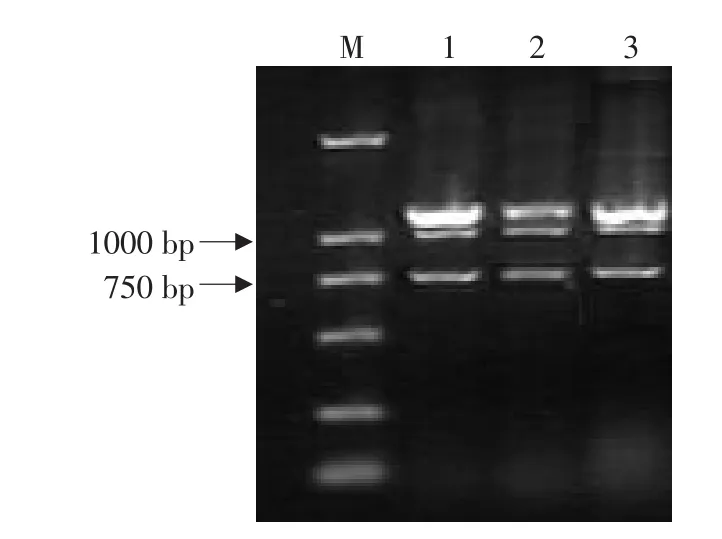
图1 MSTN基因RT-PCR扩增产物电泳结果Fig.1 Electrophoresis map ofMSTN geneRT-PCR products
2.2 MSTN cDNA的克隆及鉴定结果
2.2.1MSTNcDNA重组质粒的PCR鉴定
PCR产物经电泳分离,回收1.1 kb、1.0 kb及750 bp处的目的片段,分别命名为cMSTN-1、cMSTN-2和cMSTN-3。分别将海兰鸡、白羽鸡和寿光鸡中的这三种目的片段与pMD18-T simple Vector连接、转化DH5α大肠杆菌感受态细胞,在LB培养基中培养,通过蓝白斑筛选后,分别随意调取1瓶阳性菌液,进行菌液PCR鉴定见图2。将通过以上鉴定为阳性的克隆分别命名为pMD-cMSTN-1、pMD-cMSTN-2和pMD-cMSTN-3。
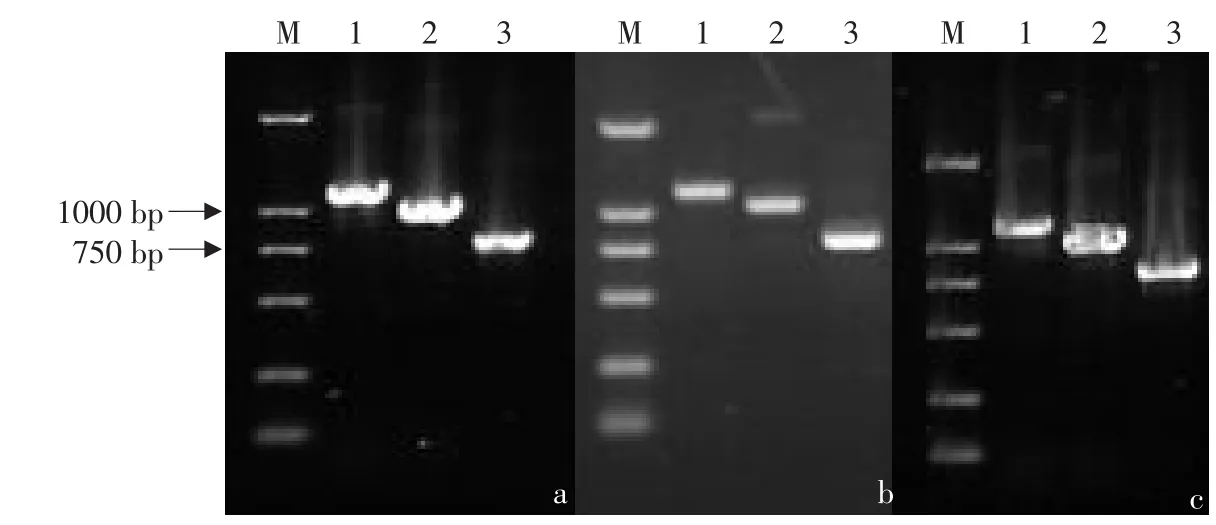
图2 重组质粒PCR扩增产物电泳结果Fig.2 Electrophoresis map of recombinant plasmid by PCR
2.2.2MSTNcDNA重组质粒的双酶切鉴定结果
利用BamH I与XhoI双酶切海兰鸡、白羽鸡和寿光鸡的pMD-cMSTN-1、pMD-cMSTN-2和pMD-cMSTN-3重组质粒,酶切产物进行电泳鉴定见图3。
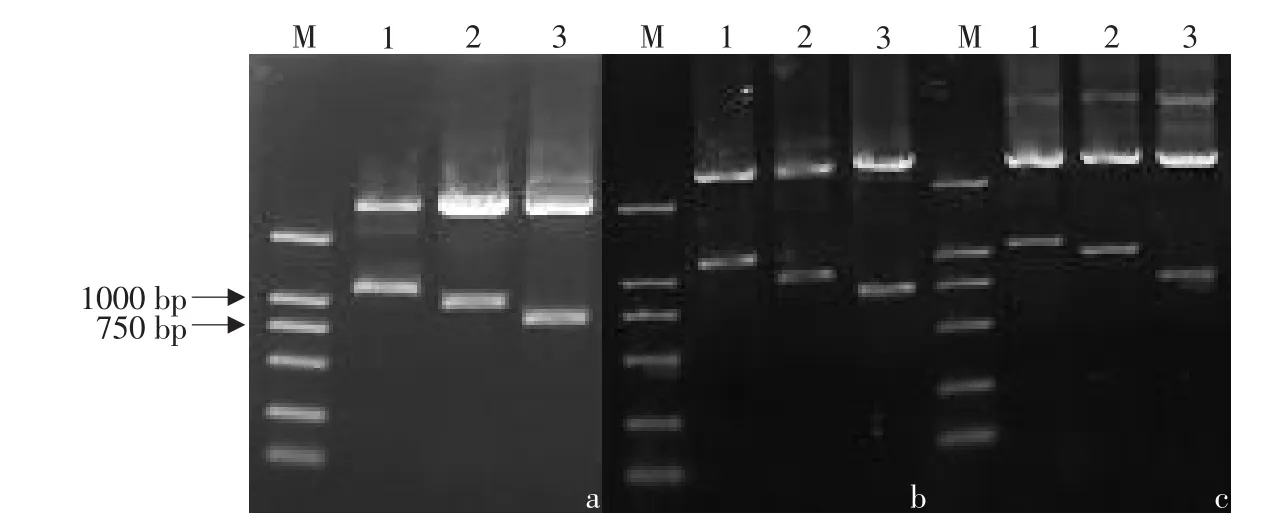
图3 重组质粒双酶切电泳检测结果Fig.3 Electrophoresis map of recombinant plasmid digested byBamH I andXhoI
2.3 MSTN cDNA序列测定及分析
2.3.1MSTNcDNA序列测定结果
将海兰鸡、白羽鸡和寿光鸡的pMD-cMSTN-1、pMD-cMSTN-2和pMD-cMSTN-3共9种质粒送交宝生物工程(大连)有限公司进行测序,海兰 鸡 的 pMD-cMSTN-1、pMD-cMSTN-2和pMD-cMSTN-3测序结果如下:
上述结果表示时,采用“…”表示缺失序列。序列测定结果表明海兰鸡、白羽鸡和寿光鸡腿肌均同时存在三种MSTN基因转录子,分别命名为 cMSTN-1、 cMSTN-cMSTN-3。 cMSTN-1 由1 128 bp组成,cMSTN-2由985 bp组成,cMSTN-3由754 bp组成。cMSTN-2与cMSTN-1相比,缺失了374~517 bp处的143 bp,同时有3处碱基不同。cMSTN-3与cMSTN-1相比,缺失了374~748处的374 bp,同时有26处碱基不同。cMSTN-3与cMSTN-2相比,缺失374~748处的231 bp。


2.3.2 不同品种家禽cMSTN-1的比较分析
将海兰鸡、白羽鸡和寿光鸡的cMSTN-1与设计引物时参考的GenBank上的鸡MSTN基因序列(gb:AF019621.1)进行比较,结果表明海兰鸡和白羽鸡的cMSTN-1与设计引物时参考的GenBank上的鸡MSTN cDNA序列同源性达100%;寿光鸡的csMSTN-1同源性达99.9%,在1 115 bp处发生碱基突变,由G→A。同时,也对其编码的氨基酸进行了差异分析,海兰鸡和白羽鸡的第1 115核苷酸组成的密码子为UGC,编码半胱氨酸,而寿光鸡第1 115核苷酸组成的密码子为UAC,编码酪氨酸。
2.3.2 不同品种家禽cMSTN-2和cMSTN-3的比较分析
由于cMSTN-2和cMSTN-3是新发现的两种MSTN基因转录子,没有其他参考数据,本研究中仅对我们测定的三个品种家禽进行了比较。海兰鸡、白羽鸡和寿光鸡的cMSTN-3同源性达100%。在这三个家禽品种中cMSTN-2核苷酸和编码氨基酸的差异见表1。
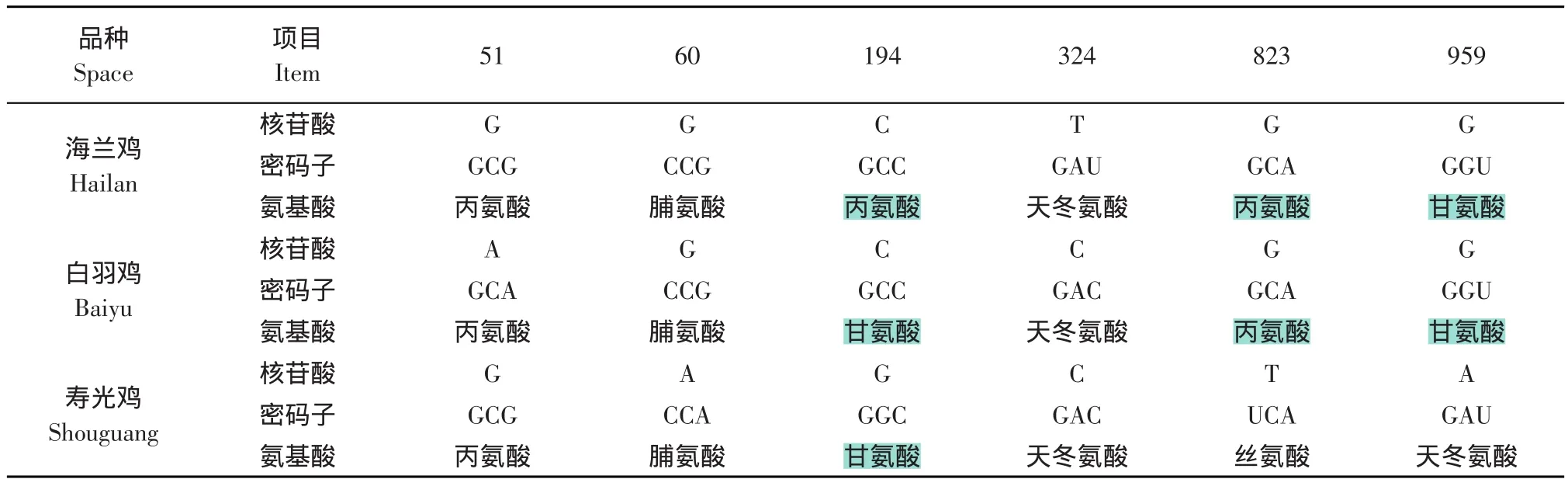
表1 海兰鸡、白羽鸡和寿光鸡cMSTN-2编码氨基酸的差异Table 1 Differences of cMSTN-2 among Hailan,Baiyu and Shouguang Chicken
由表1可见海兰鸡和白羽鸡的cMSTN-2与寿光鸡的cMSTN-2相比均有5处碱基不同,而海兰鸡和白羽鸡相比只存在2处碱基不同。同时,对其编码的氨基酸进行推测,海兰鸡和白羽鸡只有一个氨基酸差别,而寿光鸡和海兰鸡有3个氨基酸不同,寿光鸡和白羽鸡都存在2个氨基酸不同。另外,通过序列分析发现在cMSTN-2的388~390处,出现UAA终止密码子,所以推测如果cMSTN-2编码蛋白,可能只有129氨基酸,亦即在其形成的蛋白质中最多只有一个氨基酸不同。
2.4 重组表达质粒的双酶切鉴定
由于cMSTN-2和cMSTN-3是新发现的两种转录子,为了确定其在真核细胞中的表达情况,试验中选择泰昌鸡cMSTN-2和cMSTN-3作为代表,构建pEGFP-N1-cMSTN-2和pEGFP-N1-cMSTN-3真核表达载体。利用BamH I+XhoI双酶切重组质粒鉴定,得到预期大小的片段见图4,表明目的基因成功插入pEGFP-N1载体。
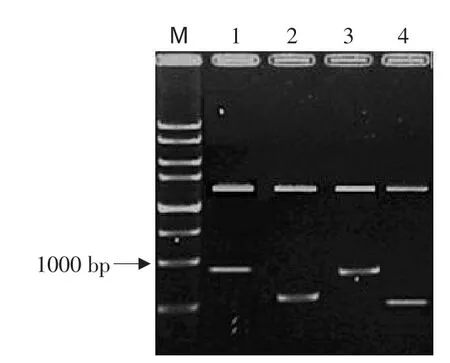
图4 重组质粒双酶切电泳结果Fig.4 Double digestion of recombinant plasmid with BamH I plusXhoI
2.5 转染细胞中MSTN基因的RT-PCR检测
利用脂质体转染法将pEGFP-N1-cMSTN-2和pEGFP-N1-cMSTN-3转染鸡胚成纤维细胞,48 h后,收集培养细胞,提取质粒、进行RT-PCR鉴定,电泳后分别得到两个预期的目的片段(见图5)。
2.6 转染成纤维细胞的显微观察
pEGFP-N1-cMSTN-2和pEGFP-N1-cMSTN-3转染鸡胚成纤维细胞48 h后,在荧光显微镜下观察发现有绿色荧光(见图6),说明成功转染。
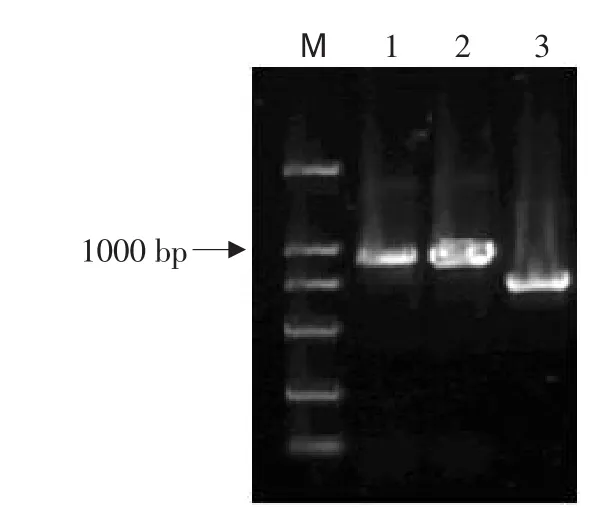
图5 重组质粒的PCR扩增结果Fig.5 PCR identification of recombinant plasmid
2.5 表达产物的SDS-PAGE电泳分析
转染48 h后,通过蛋白质分离、SDS-PAGE蛋白电泳,结果见图7。由图7可见,在成纤维细胞pEGFP-N1-cMSTN-2表达蛋白质分子质量约为15 ku。pEGFP-N1-cMSTN-3没有明显蛋白表达条带。

图7 转染48 hMSTN蛋白的SDS-PAGE结果Fig.7 SDS-PAGE analysis of the MSTN protein after 48 h of tranfection
3 讨论与结论
试验中,考虑到试验动物的代表性,分别选择海兰鸡、白羽鸡和寿光鸡作为蛋鸡、肉鸡和蛋肉兼用品种的代表。海兰鸡是我国主要饲养的蛋鸡品种之一,特点是适应性强,抗病率高,饲料能量要求低,生产可利用种蛋数量多。白羽鸡是我国重要的肉鸡品种,其生长发育快,饲料转化率高,肉用性能优良。寿光鸡是我国蛋肉兼用的地方优良品种之一,躯体高大、骨骼粗壮、蛋质浓稠、肉质鲜美是其主要特点。研究结果表明这3个品种的腿肌均存在3种MSTN转录子,而且其序列大小一致。从测定结果推断,家禽中可能普遍存在3种MSTN转录子,大小分别为1 128、985和754 bp。现已证明cMSTN-1除在家禽骨骼肌中表达外,在心肌、肠、脾脏、脑中也有少量表达;其表达蛋白大小约为43 ku[12]。家禽中存在的cMSTN-1、cMSTN-2和cMSTN-3与已经报道的大马哈鱼体内的MSTN转录子有很大差异,大马哈鱼体内MSTNⅠmRNA由2 346个核苷酸组成,MSTNⅡmRNA由1 409个核苷酸组成[13]。
序列分析结果表明寿光鸡cMSTN-1序列和其他两种家禽有所不同,在1 115 bp处发生碱基突变,由G变为A,结果导致其编码的氨基酸由半胱氨酸变为酪氨酸,这一结果可能与寿光鸡的体型高大有密切关系。在海兰鸡、白羽鸡和寿光鸡品种间,cMSTN-2序列的同源性没有cMSTN-1高,而且在388~390处出现终止密码子,推测该序列可能起到调控功能,但作用途径有待进一步研究。三种不同品种家禽的cMSTN-3序列完全相同,而且均与cMSTN-1和cMSTN-2序列差异较大,SDS-PAGE检测结果表明pMD-cMSTN-3在成肌细胞中不表达;试验后续又对家禽cMSTN-1、cMSTN-2和cMSTN-3在DNA水平上的相应序列进行研究,现已证实cMSTN-3的相应DNA序列不含有内含子,推测cMSTN-3是由假基因转录生成,但其功能有待深入研究。
[1] Lee S J,Mcpherron A C.Regulation of skeletal muscle mass in mice by a new TGF-beta superfamily member[J].Nature,1997,387:83-90.
[2] Mcpherron A C,Lee S J.Suppression of body fat accumulation in myostatin deficient mice[J].The Journal of Cilinical Inrestigation,2002,109(5):595-601.
[3] Grobet L,Martin L J,Poncelet D.et al.A deletion in the bovine myostatin gene causes the double-muscled phenotype in cattle[J].Nat Genet,1997,17(1):71-4.
[4] Ji S,Losinski R L,Cornelius S G.et al.Myostatin expression in porcine tissues:tissue specificity and developmental and postnatal regulation[J].Am J Physiol,1998,275:R1265-R1273.
[5] Mateescu R G,Thonney M L.Gene expression in sexually dimorphic muscles in sheep[J].Journal of Animal Science,2002,80(7):1879-1887.
[6] Bogdanovich S,Perkins K,Krag T,et al.Myostatin propeptidemediated ameliortion of dystophic pathophysiology[J].FASEB,2005,19:543-549.
[7] Roberts S B,Goetz F W.Differential skeletal muscle expression of myostatin across teleost species,and the isolation of multiple myostatin isoforms[J].FEBS Lett,2001,491(3):212-216.
[8] Oostbye T K,Galloway T,Nielsen C.et al.The two myostatin genes of Atlantic salmon(Salmo salar)are expressed in a variety of tissues[J].Eur J Biochem,2001,268(20):5249-5257.
[9] Biga P R,Hardy R W,Schelling G T.et al.Growth hormone differentially regulates muscle myostatin1 and-2 and increases circulating cortisol in rainbow trout(Oncorhynchus mykiss)[J].Gen Comp Endocrinol,2004,138(1):32-41.
[10] Kerr T,Roalson E H,Rodgers B D.et al.Phylogenetic analysis of the myostatin gene sub-family and the differential expression of a novel member in zebrafish[J].Evol Dev,2005,7(5):390-400.
[11] Garikipati D K,Gahr S A,Roalson E H,et al.Characterization of rainbow trout myostatin-2 genes(rtMSTN-2a and-2b):Genomic organization,differential expression,and pseudogenization[J].Endocrinology,2007,148(5):2106-15.
[12] Sundaresan N R,Saxena V K,Singh R,et al.Expression profile of myostatin mRNA during the embryonic organogenesis of domestic chicken(Gallus gallus)domesticus[J]).Res Vet Sci,2008,85(1):86-91.
[13] Roberts S B,Goetz F W.Differential skeletal muscle expression of myostatin across teleost species,and the isolation of multiple myostatin isoforms[J].FEBS Lett,2001,491(3):212-216.
