鹿结核病野毒株与卡介苗差异基因基因文库的构建
2012-08-08刘东旭李健明
刘东旭,时 坤,李健明,杜 锐
(吉林农业大学中药材学院,长春 130118)
鹿结核病(Deer tuberculosis)是由分枝杆菌(Mycobacterium)引起一种鹿的慢性、消耗性传染病,其病理特点是在组织器官形成结核病灶、肉芽肿并发生干酪样坏死[1]。无论是野生还是驯化的各品种鹿几乎均易感。大部分国家的鹿场都曾发生过结核病或曾经检出过结核病菌。
目前,国内外尚无防制鹿结核病的有效方法。在某些国家采取全群诊断、宰杀诊断反应阳性动物的方法[2]。由于鹿是珍贵的经济动物,国内,许多养殖户应用卡介苗(BCG)来预防鹿结核病。但因卡介苗本身就是减毒牛分枝杆菌[3],结核病的诊断,尤其是结核菌素对诊断结果产生的干扰,无法准确鉴别疫苗株与自然流行株、疫苗免疫动物与自然感染动物,以至于许多国家不用其对动物进行免疫,阻碍了结核病防治进程[4]。实践证明,BCG免疫仍是目前有效预防鹿结核病的手段[5]。通过抑制性消减杂交筛选出结核病流行株与卡介苗的差异基因,为建立鹿结核病自然感染和卡介苗免疫鉴别诊断方法奠定基础,对促进养鹿业健康发展具有现实意义。
1 材料与方法
1.1 材料
1.1.1 菌株及载体
鹿结核病野毒株、卡介苗由吉林农业大学经济动物疾病实验室保存、提供。PCR克隆载体pMD18-T与感受态细胞JM109购自TaKaRa公司。
1.1.2 试剂
抑制性差减杂交试剂盒PCR-SelectTMBacterial Genome Subtraction Kit(购自美国BD clontech公司);TaKaRa DNA Fragment Purification Kit(购自TaKaRa公司);PCR Plus(购自宝泰克生物科技公司);质粒小量试剂盒(购自杭州维特洁生化技术有限公司);Middlebrook 7H9 Broth(购自美国DIFCO公司)。
1.2 方法
1.2.1 菌株的培养
将鹿结核病野毒株及卡介苗分别接种改良罗氏培养基,于37℃保温箱中培养4~8周,待长出淡黄色不透明形如菜花状的粗糙菌落后,无菌操作,轻轻刮取少量纯培养物置于7H9液体培养基,37℃震荡培养,待菌液内出现絮状沉淀,取出于4℃保存备用。
1.2.2 细菌的基因组提取
将用7H9液体培养基培养的细菌,85℃灭活后,5 000 r·min-1离心10 min,去上清液。用TE悬浮沉淀,并加0.05 mL 10%SDS,5 μL 20 mg·mL-1蛋白酶K,混匀,37℃保温1 h。加入0.15 mL 5 mol·L-1NaCl,0.15 mL CTAB/NaCl溶液,混匀,65℃保温20 min。用等体积酚∶氯仿∶异戊醇(25∶24∶1)抽提,5 000 r·min-1离心10 min,将上清液移至干净的离心管中。用等体积氯仿:异戊醇(24∶1)抽提,将上清液移至干净的离心管中。再用1倍体积异丙醇,颠倒混合,室温下静止10 min。弃上清液,用70%乙醇漂洗DNA沉淀后,溶解于100 μL TE,采用分光光度计法进行DNA定量检测后-20℃保存。
1.2.3 抑制性差减杂交
抑制性消减杂交按照Clontech公司的PCRSelectTMBacterial Genome Subtraction Kit说明书进行,具体过程如下:细菌基因组用RsaI酶切后,分别与接头连接。根据结核分枝杆菌的保守序列IS6110,选取中间不含有RsaI酶切位点的片段,以此为模板设计连接检测引物,扩增长度为107 bp的保守片段,引物序列如下:IS6110F引物:5'GTC GCC CGT CTA CTT GGT G 3'IS6110R引物:5'GCG GAT TCT TCG GTC GTG 3'。按照说明书进行连接效率分析。确定连接效率后,进行两轮差减杂交。其中鹿结核病野毒株为tester组,卡介苗为driver组。按照说明书对两轮差减杂交产物进行适当的调整,进行两次杂交,两次PCR。进行差减效率的检测。
1.2.4 差减文库的构建
将第二次PCR产物经纯化后,取4 μL与pMD18-T载体16℃连接过夜,42℃热击转化到JM109感受态细胞中,加入800 μL LB液体培养基37℃振荡培养4 h。将培养物涂于含有氨苄青霉素/X-Gal/IPTG的LB固体培养基上,37℃培养过夜,次日观察蓝白色菌落生长情况。
1.2.5 差减文库的筛选、克隆及鉴定
挑取文库中白色菌落,接种含氨苄青霉素的LB液体培养基中,37℃振荡培养12 h后,保存菌种并提取质粒。以Nester primer 1和Nester primer 2R为引物,进行PCR扩增。反应体系为:模板 1 μL,Nester primer 1 0.5 μL,Nester primer 2R 0.5 μL,PCR Plus 7 μL,DEPC水 16 μL,总体系20 μL。反应程序:94℃预变性10 min,94℃变性30 s,68℃退火30 s,72℃延伸共30个循环,72℃10 min后4℃保存。PCR产物用1%琼脂糖凝胶电泳分析。
2 结果与分析
2.1 细菌基因组的提取、定量及酶切分析
用紫外分光光度计测定鹿结核病野毒株和卡介苗的DNA在260和280 nm处的吸光度,其OD260/280比值均在1.8~2.0之间,说明提取的基因组中蛋白质和RNA污染较少,纯度较高,经RsaI酶切后的基因组DNA大小范围在0.1~2.0 kb之间,成弥散状分布。用2%琼脂糖凝胶电泳检测,可见清晰的DNA条带,见图1。
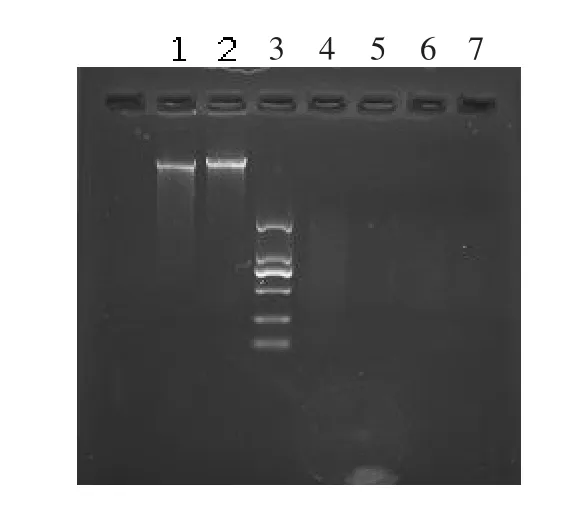
图1 基因组DNA及酶切产物的电泳检测Fig.1 Electrophoresis of the DNA by Rsa I restriction enzyme digest and DNA
2.2 接头连接效率的检测
为验证接头的连接效率,根据结核分枝杆菌复合群保守IS6110设计特异性引物,预计扩增片段大小107 bp且不含RsaI酶切位点。结果表明(见图2),用特异性上游引物与primer 1扩增出的产物(泳道2、4),相比于用特异性引物扩增出的产物(泳道3、5),其亮度相近不低于25%,说明接头连接的效率较高。
2.3 抑制性差减杂交结果
两轮差减杂交后,差异的基因片段两端带有不同接头,鹿结核病流行株两次差减后,以第一次PCR产物为模板,Nester primer 1和Nester primer 2R为引物进行PCR扩增。结果表明(见图3),消减杂交后的差异基因被富集,在弥散条带中出现一些清晰条带。未差减的DNA经两次PCR的产物条带微弱,且与差减杂交后的基因有显著差异。
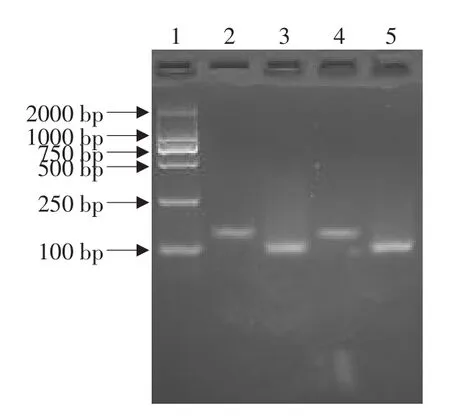
图2 接头连接效率PCR产物电泳结果Fig.2 Result of ligation'efficient of PCR products
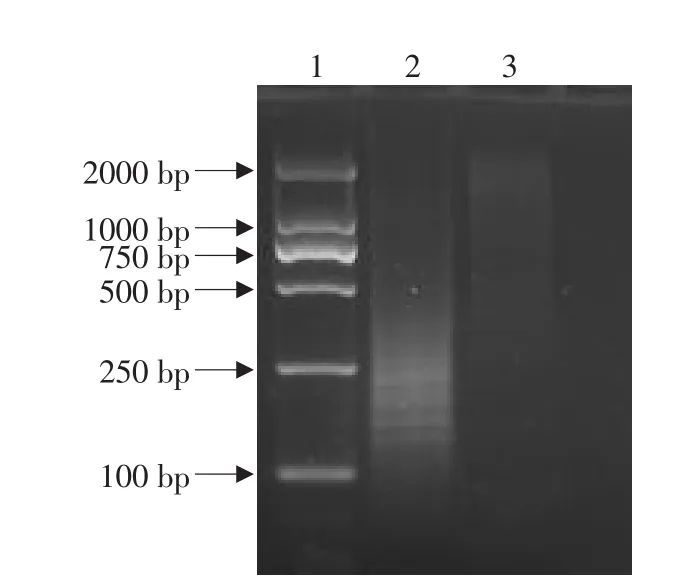
图3 抑制性差减杂交PCR结果Fig.3 PCR results of DNA subtraction
2.4 差减效率的检测
以差减杂交第二次PCR产物和未差减杂交第二次PCR产物为模板,以IS6110引物做差减效率检测,分别在18、22、26、30个循环时分别取样5 μL进行2%琼脂糖凝胶电泳检测。结果表明(见图4、5),未差减组,从在第18个循环开始出现了107 bp左右的特异性条带。差减组从第26个循环开始出现微弱条带。
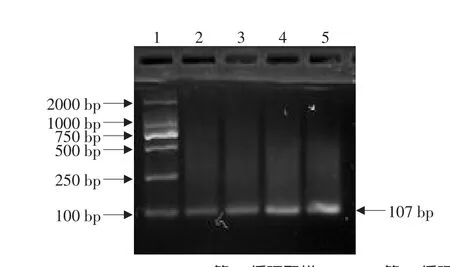
图4 未差减组杂交效率检测Fig.4 Analysis of efficiency of the unsubtraction
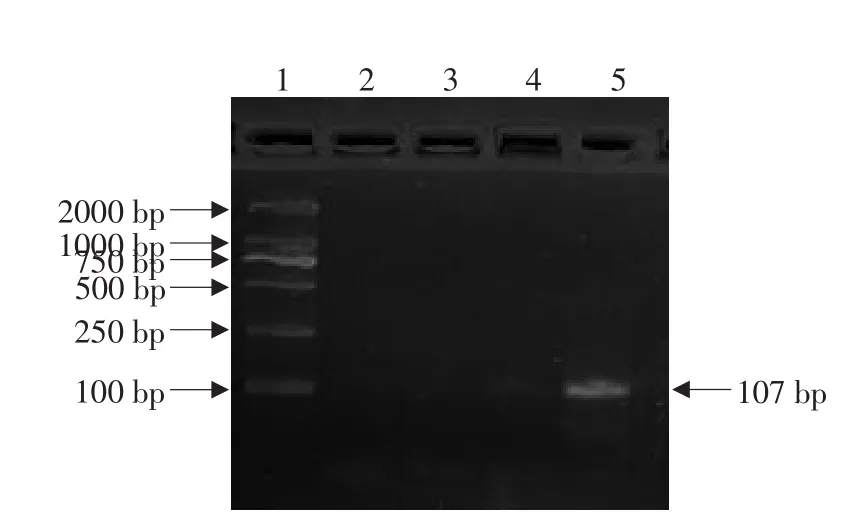
图5 差减组杂交效率检测Fig.5 Analysis of efficiency of the subtraction
2.5 差减文库的构建及鉴定
结果见图6、7。
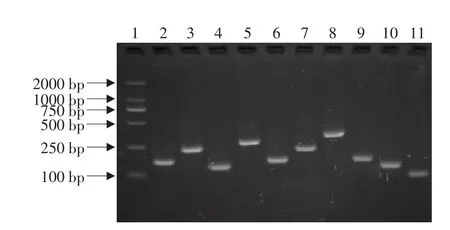
图6 差减杂交文库中部分随机克隆的PCR鉴定Fig.6 Part of PCR identification result for subtractive hybridization library
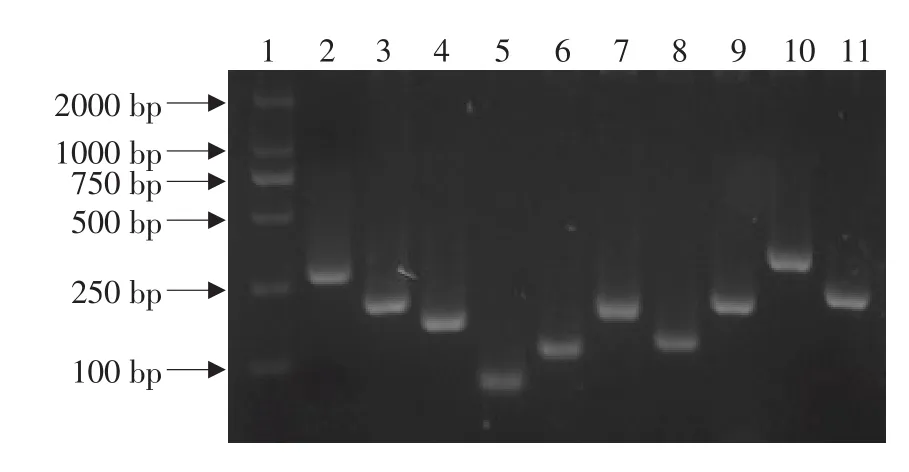
图7 文库菌落部分PCR结果Fig.7 Part of PCR identification result for subtractive hybridization library
差减后PCR产物纯化后,与pMD18-T载体连接,转化到JM109感受态细胞中,蓝白斑筛选。用Nester primer 1和Nester primer 2R引物进行PCR鉴定,208个克隆获得了插入片断,且插入片断为单一条带并大于100 bp。
3 讨论
筛选出鹿结核病流行株和卡介苗差异基因是建立鹿结核病自然感染和卡介苗免疫鉴别诊断方法的基础。mRNA差异显示技术、代表性差异分析法和基因表达系统分析技术等是20世纪80年代末90年代初问世的筛选差异基因的方法。上述方法的缺点是对低丰度mRNA富集效率低、费时、假阳性高[6-8]。抑制性消减杂交的问世为微生物基因组学研究、致病基因的研究等提供新技术[9]。Akopyants首次将该方法改良并应用于细菌基因组学研究[10]。抑制性差减杂交是应用抑制性PCR原理[11],利用两种接头,选择性扩增差异表达的靶片段,抑制非靶片段的扩增。经抑制差减杂交后的DNA群体不仅富集了差异表达基因(目的基因),而且目的基因间丰度的差异经过均等化作用已基本消除,使消减后的DNA群体为丰度一致的目的基因群体。
为了保证抑制性差减杂交的顺利进行,在试验过程中,要选择合适的内切酶对基因组进行酶切,要对酶切效率要进行检查,只有酶切的片段符合要求,才能保证抑制性差减杂交有效。试剂盒要求,酶切出的片段要小于2 000 bp,本试验所选用的RsaI限制性内切酶可以有效对基因组进行酶切,且酶切后的片段符合试剂盒要求。酶切后的DNA与接头的连接效率要进行检测,本试验采用结核分枝杆菌的保守序列IS96110,选取中间不含有RsaI酶切位点的片段,以此为模板设计连接检测引物,对接头连接后的产物进行检测,检测结果符合试剂盒要求,说明接头已连接好,可进行下一步试验。抑制性差减杂交中差减效率的检测最为重要,即是否充分除去了试验组和对照组的相同序列。在本试验中,用检测接头连接效率的引物对差减效率进行检测,结果表明差减组与差减对照组相差8个循环才出现条带,说明本次试验的差减成功切效率较高。已初步筛选出卡介苗与鹿结核菌野毒株的差异基因。
4 结论
本试验是以鹿结核病野毒株和卡介苗为研究对象,以鹿结核病野毒株为tester组,卡介苗为driver组,tester组,构建鹿结核病野毒株和卡介苗基因组差减文库,并获得208个单一的且大于100 bp的片段,这些克隆片段中可能含有鹿结核病野毒株独有的特异性的DNA片段。本实验室正在对这些基因进行鉴定、测序及序列分析,对筛选出具有反应原性的差异基因片段进行表达,对鹿结核病的防制、鹿结核病自然感染和卡介苗免疫的鉴别诊断及新型疫苗研制打下基础,也为人结核病和牛结核病防治研究工作提供理论参考。
[1] 马广福.鹿结核病诊断方法及防制方法的研究[J].家畜传染病,1985(2):17-20.
[2] Fraser M.Tuberculosis in deer:Another piece in the unfinishedMycobacterium bovisjigsaw[J].The Veterinary Journal,2008,175(3):287-288.
[3] Manjunatha M,Venkataswamy,Michael F,et al.In vitro culture medium influences the vaccine efficacy ofMycobacterium bovisBCG[EB/OL].Vaccine,Available Online.http://www.sciencedirect.com/science/article/pii/S0264410X11019670,2011.
[4] Rossignol L,Guthmann J P,Kernéis S,et al.Barriers to implementation of the new targeted BCG vaccination in France:A cross sectional study[J].Vaccine,2011,29(7):5232-5237.
[5] Abdelmoneim E M,Kheir,Abdelmoneim A,et al.The sensitivity of BCG scar as an indicator of previous vaccination among Sudanese infants[J].Vaccine,2011,29(10):8189-8191.
[6] Liang P,Pardee A B.Differential display of eukaryotic messenger RNA by means of the polymerase chain reaction[J].Science,1992:257-967
[7] Lisitsyn N,Wigler M.Cloning the differences between two complex genomes[J].Science,1993,259(12):946.
[8] Hubank M,Schatz DG.cDNA representational difference analysis:a sensitive and flexible method for identification of differentially expressed genes[J].Methods Enzymol,1999:303-325.
[9] Diatchenko L,Laa Y F,Campbell A P,et al.Suppression subtraction hybridization:A method for generating differentially regulated or tissue specific cDNA probes and libraries[J].Proc Natl Acad Sci USA,1996,93:6025-6030.
[10] Akopyants N S,Fradkov A,Diachenko L,et al.PCR-based subtractive hybridization and differences in gene content among strains ofHelicobacterpylori[J].Proc Nail Acad Sci USA,1998,95:13108-13113.
[11] Huang X W,Li Y X,Niu Q H,et al.Suppression subtractive hybridization(SSH)and itsmodificationsin microbiological research[J].Applied Microbiology and Biotechnology,2007,76(4):753-760.
