鸡HOPX基因的克隆及表达分析
2012-08-08张志威王维世闫晓红
张 坤,张志威,王维世,闫晓红,李 辉,王 宁
(东北农业大学动物科学技术学院,农业部鸡遗传育种重点实验室,哈尔滨 150030)
HOPX基因(Homeodomain only protein X)又名OB1(Odd homeoBox 1),其编码的蛋白是一个非HOX家族蛋白,该蛋白非常小,仅有73个氨基酸残基构成[1]。与HOX家族蛋白不同,HOPX仅有一个非典型的同源异型结构域(Homeodomain)。由于突变,该结构域不能结合DNA,而主要是参与蛋白间的互作。HOPX的作用取决于与其互作的蛋白[2]。目前已发现HOPX蛋白可与血清反应因子(Serum response factor,SRF)[3-4]、组蛋白去乙酰化酶2(HDAC2)[5]等发生蛋白互作。HOPX基因在的哺乳动物脑、胎盘、心脏、脾脏、肺脏、膀胱、平滑肌等多种组织和器官表达[6]。HOPX基因调控心脏发育[7-9]、平滑肌[10-12]、骨骼肌[13]、上皮角质细胞[14-15]以及滋养层细胞的分化[16]。很多有关癌症的研究表明,HOPX基因是一个肿瘤抑制因子,HOPX基因启动子的甲基化能导致食管鳞状细胞癌[17],子宫内膜癌[18]和胃癌的发生[19],HOPX还是肺癌和绒毛膜癌的抑制因子[20-22]。对HOPX基因的功能和调控的研究,目前多集中于哺乳动物,禽类HOPX基因的相关研究尚未见报道。本实验室的鸡组织转录表达谱分析及Northern blot分析发现,HOPX基因在鸡脂肪组织的表达量显著高于其它组织。
为深入研究该基因在脂肪生长发育过程中的作用,本研究扩增和克隆鸡HOPX基因全长的CDS区,对其进行了序列分析,采用real-time RT-PCR和半定量RT-PCR的方法,进行该基因的组织表达谱分析、该基因在东北农业大学高、低脂鸡脂肪组织发育过程中的表达差异分析以及在鸡脂肪细胞分化过程中的表达分析。本研究为开展HOPX基因在脂肪生长发育过程中的作用及其作用机制研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验材料
本研究实验动物为10日龄商品AA肉仔鸡和东北农业大学高、低脂系双向选择品系第14世代肉鸡。实验鸡按常规商品肉鸡饲养程序进行饲养。在无菌条件下,从1~12周龄的高、低脂系肉鸡中,每周龄分别选取高、低脂系鸡各5只,采集腹部脂肪组织,且7周龄时,同时采集肾脏(K),心脏(H),肝脏(L),睾丸(Te),脾脏(Sp),十二指肠(D),回肠(I),空肠(J),肌胃周围脂肪(GF),腹部脂肪(AF),腺胃(P),肌胃(G),大脑(Cr),胸肌(PM)和腿肌(LM)15种组织样。
1.1.2 感受态细胞和克隆载体
大肠杆菌TOP10感受态细胞(购自北京康为世纪生物技术有限公司);克隆载体pMD-18T Vector(购自大连宝生物工程有限公司)。
1.1.3 试剂
琼脂糖凝胶DNA回收试剂盒和质粒小量制备试剂盒(购自Axygen(杭州)有限公司);琼脂糖(Agarose)(购自北京原平皓生物技术公司);内切酶EcoRI和SacI、oligo dT引物、dNTP、Taq酶、RNase Inhibitor及SYBR Premix ExTaq试剂盒(均购自大连宝生物工程有限公司);总RNA极速提取试剂盒(购自上海飞捷生物技术有限公司);DNA Marker(购自北京全式金生物技术有限公司);半定量RT-PCR试剂盒、RNase H2O(购自Promega公司);DMEM/F12(1:1)培养液和I型胶原酶(购自GIBCO公司)。
1.1.4 引物设计
根据NCBI数据库(http://www.ncbi.nlm.nih.gov/)提供的HOPX基因(NM_204556)和GAPDH基因(K01458)的核酸序列,采用Primer Premier 5.0软件设计引物,分别用于HOPX全长CDS区扩增以及HOPX基因和内参基因的表达分析。引物由上海英骏(Invitrogen)生物技术有限公司合成。

表1 HOPX基因PCR引物序列、退火条件及产物Table 1 Primer sequences,PCR product and annealing temperatures of chicken HOPX gene
1.2 方法
1.2.1 鸡RNA提取和cDNA的制备
从1至12周龄,每周龄分别选取高、低脂系鸡各5只,每个周龄屠宰一批肉鸡,在无菌条件下,采取腹部脂肪组织,其中在7周龄时,同时还采取其他14种组织样品。样品迅速冻存于液氮中,然后再保存在-80℃冰箱中。采用总RNA提取试剂盒(上海飞捷生物技术有限公司),提取脂肪组织等各组织样的总RNA。cDNA制备的具体操作如下:分别取1 μg鸡各组织总RNA,采用Oligo-dT引物,按照Promega提供的试剂说明进行反转录。反转录反应液组成是总RNA 1 μg,Oligo-dT Primer 0.5 μL,RNAse Free Water 3.5 μL,ImProm-II Buffer 4 μL,MgCL22.5 μL,dNTP 1 μL,RNAse Inhibitor(40 U·μL-1)0.5 μL,ImProm-II Reverse Transcriptase 1 μL,RNAse Water 6 μL,总体系为20 μL。反转录反应条件为70℃5 min,冰浴5 min,25℃5 min,60℃60 min,70℃15 min。所得到的cDNA在-20℃保存。
1.2.2 鸡HOPX基因CDS区的扩增、克隆和序列分析
以鸡脂肪组织cDNA为模板,用引物GHOPX1(F和R)扩增HOPX的编码区。反应液的组成是ExTaq酶0.5 μL,10×Ex Taq Buffer 10 μL,dNTP 8 μL,cDNA 5 μL,上/下游引物(GHOPX1)各 2 μL,H2O 72.5 μL,总体系为 100 μL。 PCR 反应条件是94℃ 5 min,30个循环(94℃ 30 s;55.3℃ 30 s;72 ℃30 s),72 ℃ 5 min。
将HOPX基因CDS区的扩增产物,采用凝胶回收试剂盒回收,克隆到pMD-18T载体中,转化大肠杆菌TOP10感受态细胞,在平板培养基挑取单菌落,加入到含有氨苄抗性的LB液体培养基中,放于37℃摇床中过夜。用菌液PCR和双酶切法鉴定。挑选阳性的克隆,送上海英骏(Invitrogen)生物技术有限公司测序,应用ClusterW2.0(http://www.ebi.ac.uk/Tools/msa/clustalw2/)进行HOPX蛋白序列的同源性分析。
1.2.3 Real-time RT-PCR反应
以反转录得到的cDNA为模板,进行HOPX基因mRNA表达量的定量分析。反应液的组成是SYBR 5 μL,ROX 0.2 μL,上/下游引物(GHOPX2)各 0.2 μL,H2O 3.4 μL,cDNA 1 μL,总体系为 10 μL。反应条件为95℃30 s,40个循环(95℃5 s;60 ℃ 25 s),95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。GAPDH基因作为内参基因,反应液的组成及反应条件同上述。用ABI 7500 Software软件分析表达结果。
1.2.4 半定量RT-PCR反应
以反转录得到的cDNA为模板,进行HOPX基因的PCR扩增。反应液组成为EasyTaq酶0.05 μL,上/下游引物(GHOPX2)各 0.2 μL,H2O 7.25 μL,cDNA 0.5 μL,10×Buffer 1 μL,dNTP 0.8 μL,总体系为10 μL。反应条件为94℃5 min,23个循环(94 ℃ 30 s;55.3℃ 30 s;72 ℃ 30 s),72 ℃ 5 min。GAPDH基因作为内参基因,退火温度设为41.5℃,其余条件同上述。PCR产物经2%琼脂糖凝胶电泳检测。
1.2.5 前脂肪细胞培养和分化
取10日龄商品AA肉仔鸡,无菌采取腹部脂肪组织,放入装有PBS的平皿中,反复冲洗,尽量除去血管和筋膜,用眼科剪剪碎组织,随即转入含有胶原酶的消化液试管中,于37℃消化60 min(每5 min震荡一次)。消化完毕,加入培养液终止消化,然后分别经100目和600目的不锈钢筛网过滤。将滤液分装入离心管,2 000 r·min-1离心10 min,除去培养液,用红细胞裂解液重悬细胞,制成细胞悬液,室温孵育10 min后,2 000 r·min-1离心10 min,细胞沉淀,用培养液(DMEM/F12)洗1~2次,最后重悬细胞,获得鸡基质-血管细胞(S-V细胞),即鸡前脂肪细胞。
将分离的前脂肪细胞记数后,按1×105cells·mL-1左右的密度接种,置于CO2培养箱中培养,48 h后,洗去未贴壁的细胞,再在培养液中加入油酸(160 μmol·L-1)诱导分化,以后每2 d换液1次。收集不同分化时间点细胞,提取细胞总RNA,采用real-time RT-PCR分别检测HOPX基因和GAPDH(内参)基因的表达,引物见表1。采用2-△△Ct的方法计算HOPX基因mRNA的相对表达量。
2 结果与分析
2.1 HOPX基因全长CDS区的扩增、克隆及序列分析
HOPX基因CDS区的PCR扩增产物经2%琼脂糖凝胶电泳检测,可见一条240 bp特异性带(预期的扩增片段上下游包括两个酶切位点),与预期相符(见图1)。胶回收PCR产物,采用pMD-18T载体克隆。阳性重组质粒酶切鉴定如图2所示,双酶切获得了预期大小的DNA片段。测序结果与NCBI数据库序列(NM_204556)一致,表明试验已成功获得鸡HOPX基因。序列分析显示,HOPX的CDS区全长222 bp,编码73个氨基酸。SMART结构域分析显示,与人和鼠等的HOPX相似,鸡HOPX也仅有一个非典型的HD结构域,不能能结合DNA。
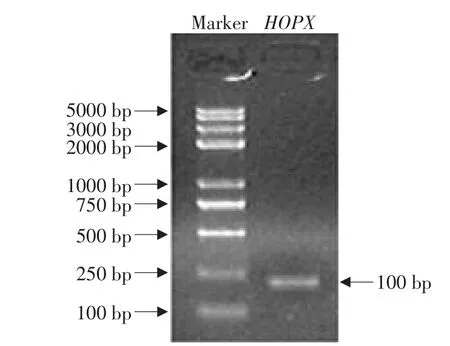
图1 PCR产物凝胶电泳图谱Fig.1 Agarose gel electrophoresis of RT-PCR products corresponding mRNA coding chicken HOPX
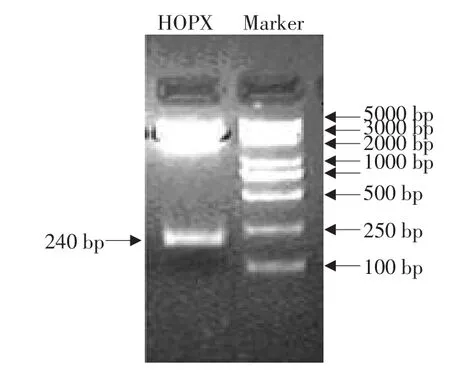
图2 重组质粒双酶切鉴定图谱Fig.2 Identification of the recombinant HOPX plasmid by double digestion
查询EMBL数据库(http://www.ebi.ac.uk/)共获得鸡HOPX蛋白的20个同源序列,这20个物种分别为火鸡,牛、猪、人,大小鼠、豚鼠、熊猫、兔、猕猴、狨猴、大猩猩、长臂猿、大象、仓鼠、鸭嘴兽、三文鱼、斑马鱼和河豚。多序列比对分析显示,这些HOPX蛋白序列的在不同物种间的保守性较高,表现出物种间进化关系越近,序列间相似度越高的规律(见表2)。
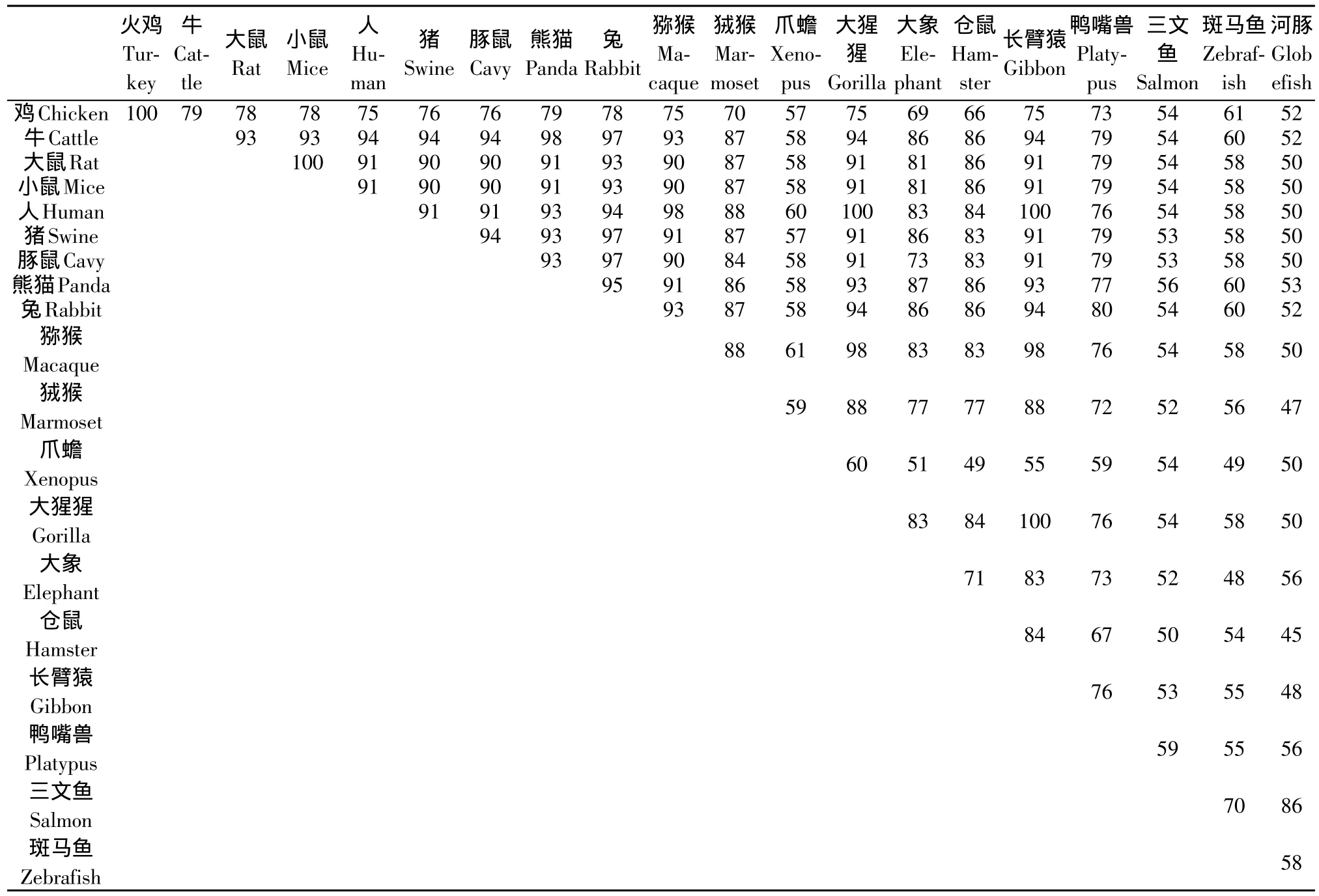
表2 鸡与其他物种HOPX氨基酸序列同源性比较Table 2 Comparison of amino acid sequences of HOPXs from 20 different species
例如,人和大猩猩、长臂猿间;鸡和火鸡间;大鼠和小鼠间序列相似度均为100%。哺乳类牛、猪、人、鼠、大象、猿类、兔、大熊猫等序列相似度大于86%,斑马鱼与三文鱼序列的相似度为86%,而鸡与哺乳类HOPX蛋白的序列相似度在69%~79%间,与鱼类的相似度则小于61%。
2.2 HOPX基因的表达分析
2.2.1HOPX基因在不同组织中的表达情况
以GAPDH基因(glyceraldehyde-3-phosphate dehydrogenase)作为内参基因,采用real-time RTPCR的方法,检测HOPX基因在肉鸡高,低脂系7周龄公鸡的肾脏(K)、心脏(H)、肝脏(L)、睾丸(Te)、脾脏(Sp)、十二指肠(D)、肌胃周围脂肪(GF)、 肌 胃 (G)、 腹 部 脂 肪 (AF)、 回 肠 (I)、 大 脑(Cr)、腿肌(LM)、胸肌(PM)、空肠(J)和腺胃(P)共 15种组织中的表达。结果显示,HOPX基因在脂肪组织(腹部脂肪组织和肌胃周围脂肪组织)的表达量最高。HOPX基因虽也在鸡的其它多个组织有表达,但其表达量较低,尤其在胸肌、腿肌及肾脏表达量最低(见图3),这与本实验室早期表达谱芯片和Northern blot分析结果一致。进一步比较HOPX基因在高、低脂系肉鸡不同器官和组织中的表达情况,可见,在睾丸和脾脏组织中,低脂系鸡HOPX基因的表达量显著高于高脂系(P<0.05);在腿肌、心脏、肌胃组织中,低脂系鸡HOPX基因的表达量极显著高于高脂系(P<0.01),而在空肠中,高脂系鸡HOPX基因的表达极显著地高于低脂系(P<0.01)。除此之外,高、低脂系肉鸡的其他供试组织中HOPX基因的表达量差异不显著(见图3)。
半定量RT-PCR方法的验证如图4所示,其结果与real-time RT-PCR的结果基本吻合。
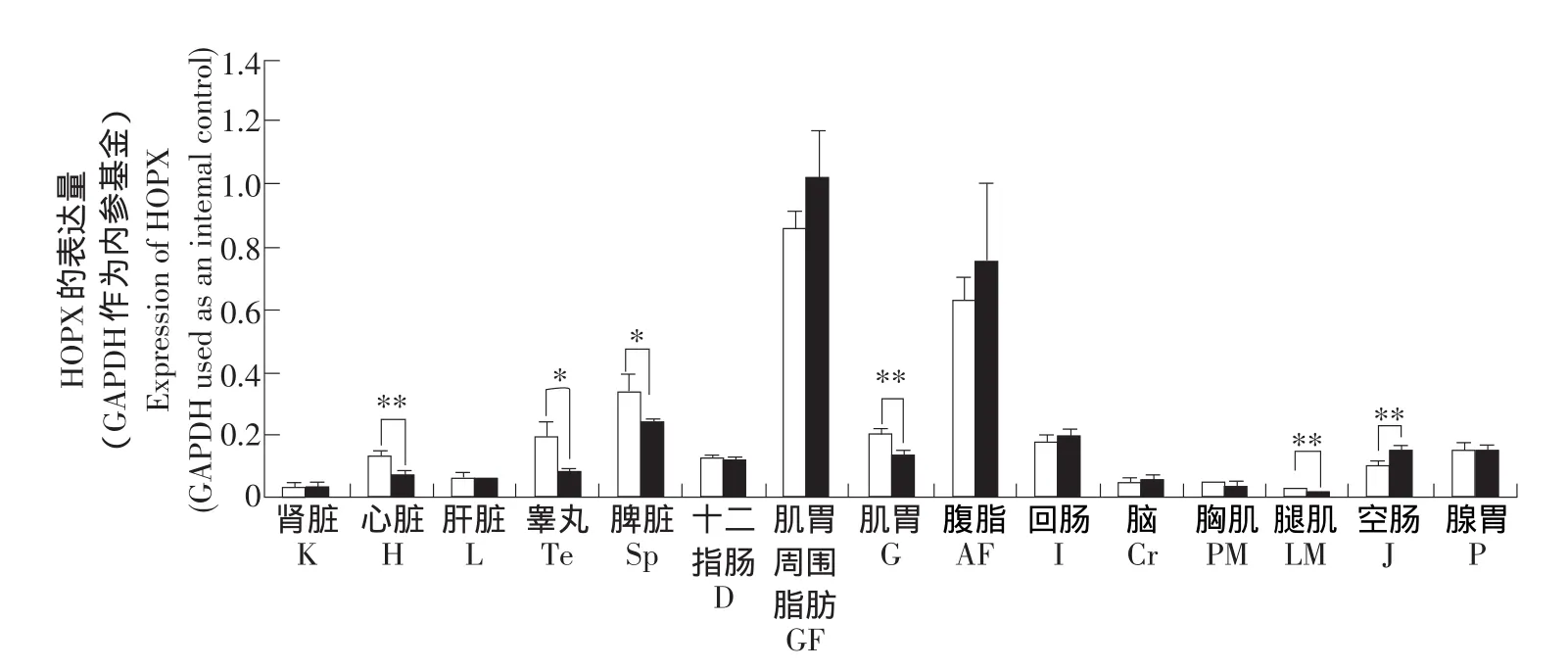
图3 鸡HOPX基因在7周龄15种组织中的表达特性(real-time RT-PCR)Fig.3 Tissue expression characterization of HOPX gene in 7-week-old broilers of NEAUHLF(real-time RT-PCR)
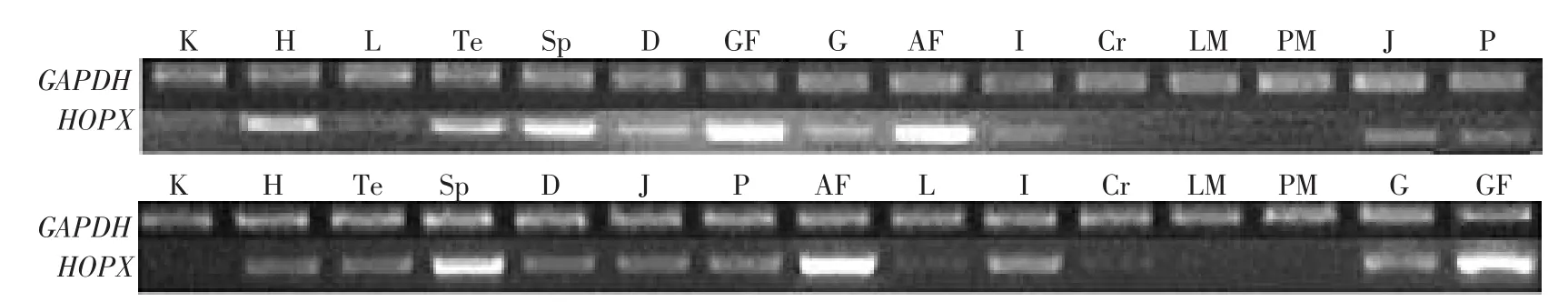
图4 鸡HOPX基因在7周龄15种组织中的表达特性(半定量RT-PCR)Fig.4 Tissue expression characterization of the HOPX gene in 7-week-old broilers of NEAUHLF(semi-quantitation RT-PCR)
2.2.2HOPX基因在高、低脂系肉鸡脂肪发育过程中的表达情况
HOPX基因在脂肪组织中高表达,提示HOPX基因在脂肪组织的生长和发育中发挥作用。为了解HOPX基因在脂肪生长发育中的作用,采用real-time RT-PCR方法,检测HOPX基因在高、低脂系肉鸡脂肪组织生长发育过程中的表达规律及差异。结果显示,随着鸡龄的增长和脂肪组织的生长发育,鸡脂肪组织中,HOPX基因的表达呈上升趋势;到7周龄时,HOPX基因在高、低脂两系脂肪组织中表达量均略有下降,但之后又都持续上升;至9到12周龄时,HOPX的表达量趋于稳定。高、低脂两系间脂肪组织HOPX基因表达量的比较分析还表明,高脂系鸡的脂肪组织中HOPX基因的表达量均高于低脂系中的表达量,且在2、3、5、6、10、12周龄时,HOPX的表达量差异显著(P<0.05),在1、8、11周龄时,HOPX的表达量差异极显著(P<0.01),在4、7、9周龄时差异不显著(见图5)。
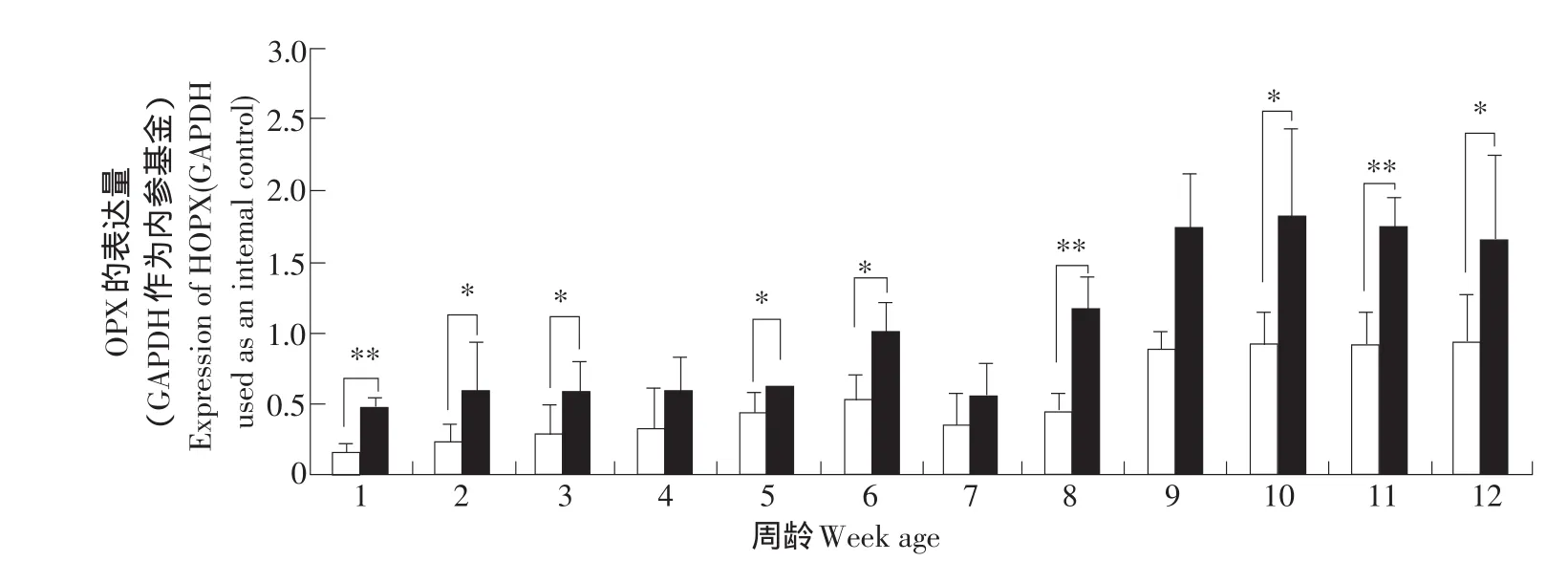
图5 鸡HOPX基因在高、低脂鸡脂肪组织发育过程中的表达规律和差异(real-time RT-PCR)Fig.5 Tissue expression characterization of the HOPX gene in abdominal fat tissue of broilers of NEAUHLF(real-time RT-PCR)
2.2.3HOPX基因在脂肪细胞分化过程中的表达情况
脂肪组织的生长发育包括细胞的增殖和分化。为了进一步研究HOPX基因对于脂肪生长发育的作用,我们检测了HOPX基因在脂肪细胞分化过程中的表达情况,结果见图6。HOPX基因在脂肪细胞分化初期表达量下降,但随着脂肪细胞的分化,其表达上升,在细胞分化72 h,表达量达到最高,随后表达量下降。
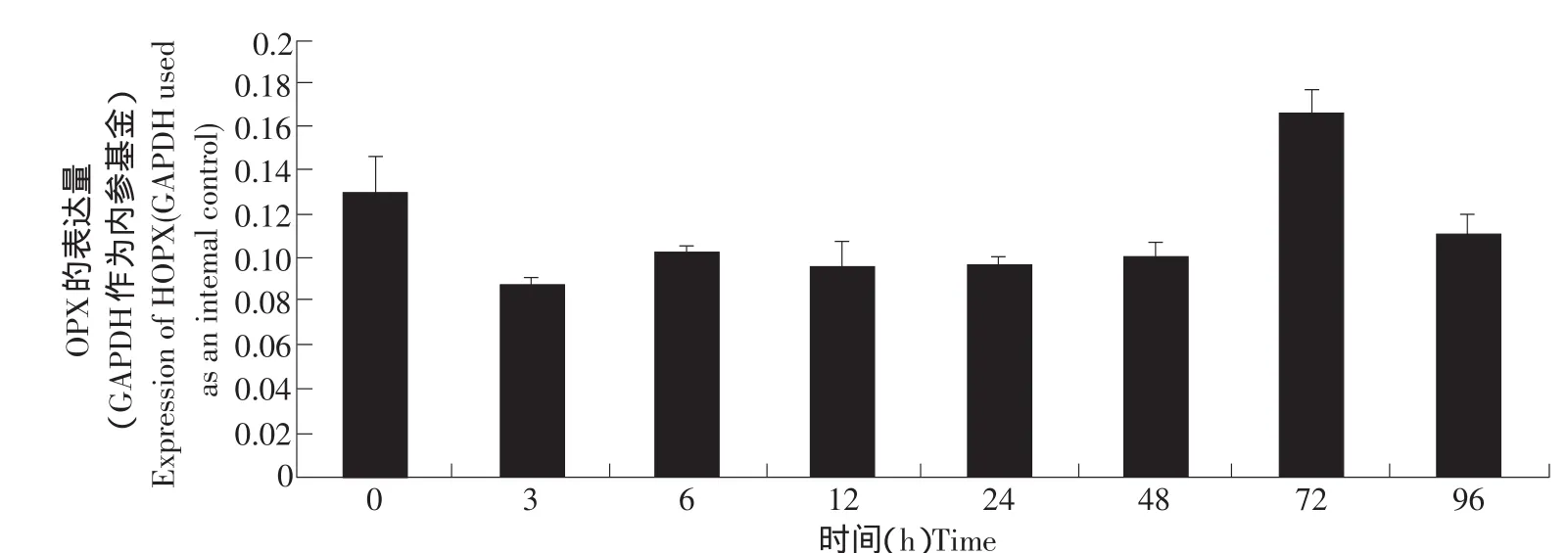
图6 HOPX基因在脂肪细胞分化过程中的表达规律(real-time RT-PCR)Fig.6 Expression characterization of the HOPX gene in adipocyte differentiation(real-time RT-PCR)
3 讨论与结论
本研究成功地克隆了鸡HOPX基因的全长CDS区,所得序列与NCBI数据库中已有的mRNA序列一致。鸡HOPX基因与其他物种HOPX基因的同源性很高,其中,与火鸡的同源性达100%,与鼠和人HOPX基因的相似度达75%以上,预示在不同物种中HOPX基因的作用相似。结构域分析显示,与人和鼠等其他动物的HOPX相似,鸡HOPX蛋白序列仅含有一个非典型HD结构域,不能结合DNA,这表明HOPX作用机制相似,通过蛋白间的互作参与调控基因表达。
本实验室早期组织表达谱芯片分析和Northern blot分析发现,HOPX基因在鸡脂肪组织中的表达量远远高于其它组织[23],本研究的HOPX基因的组织表达分析显示,HOPX基因在脂肪组织中高表达,HOPX基因虽然在其他组织也有表达,但远低于脂肪组织。研究表明,机体不同部位的脂肪组织存在异质性,不同部位脂肪组织细胞的增殖能力、脂滴沉积能力、诱导凋亡的敏感性以及相关转录因子的表达水平都不同[24-26],这可能是肌胃周围脂肪组织和腹部脂肪组织HOPX基因表达量不同的原因。高、低脂鸡脂肪组织表达分析显示,高、低脂系鸡的脂肪组织中,HOPX基因的表达存在显著差异,表现为高脂系鸡脂肪组织中的表达高于低脂系鸡,提示HOPX可能参与脂肪的生长发育调控。HOPX基因在鸡脂肪细胞分化过程中的表达检测发现,随着细胞分化程度的升高,HOPX基因的表达量逐渐增加,即分化程度高的脂肪细胞其HOPX基因的表达水平高。与低脂系鸡相比,高脂系鸡脂肪组织脂肪细胞的分化程度高,成熟脂肪细胞数量多[27],这可能是高脂系鸡脂肪组织HOPX基因表达高于低脂系鸡的原因。这些表达数据提示,HOPX基因在脂肪组织生长发育过程中发挥作用。
对哺乳动物研究显示,HOPX基因参与心脏发育、心肌细胞分化、上皮细胞分化等的调控。目前尚未见HOPX基因在脂肪细胞分化中的研究报道,本研究首次报道了HOPX基因在脂肪组织中高表达;HOPX基因在高、低脂系肉鸡脂肪组织生长发育过程存在表达差异,且随着脂肪细胞分化程度的升高,其表达量逐渐增加。HOPX基因在脂肪细胞分化中的作用及作用机制还不清楚,有待深入研究。
[1] Adu J,Leong F T,Smith N R,et al.Expression of mOb1,a novel atypical 73 amino acid K50-homeodomain protein,during mouse development[J].Mech Dev,2002,119(Suppl 1):43-47.
[2] Kook H,Yung W W,Simpson R J,et al.Analysis of the structure and function of the transcriptional coregulator HOP[J].Biochemistry,2006,45(35):10584-10590.
[3] Zhang X,Azhar G,Zhong Y,et al.Identification of a novel serum response factor cofactor in cardiac gene regulation[J].J Biol Chem,2004,279(53):55626-55632.
[4] Wang D,Chang P S,Wang Z,et al.Activation of cardiac gene expression by myocardin,a transcriptional cofactor for serum response factor[J].Cell,2001,105(7):851-862.
[5] Trivedi C M,Zhu W,Wang Q,et al.HopxandHdac2 interact to modulate Gata4 acetylation and embryonic cardiac myocyte proliferation[J].Dev Cell,2010,19(3):450-459.
[6] Asanoma K,Kato H,Inoue T,et al.Analysis of a candidate gene associated with growth suppression of choriocarcinoma and differentiation of trophoblasts[J].J Reprod Med,2004,49(8):617-626.
[7] Kook H,Epstein J A.Hopping to the beat.Hop regulation of cardiac gene expression[J].Trends Cardiovasc Med,2003,13(7):261-264.
[8] Chen F,Kook H,Milewski R,et al.Hop is an unusual homeobox gene that modulates cardiac development[J].Cell,2002,110(6):713-723.
[9] Shin C H,Liu Z P,Passier R,et al.Modulation of cardiac growth and development by HOP,an unusual homeodomain protein[J].Cell,2002,110(6):725-735.
[10] Du KL,Ip H S,Li J,et al.Myocardin is a critical serum response factor cofactor in the transcriptional program regulating smooth muscle cell differentiation[J].Mol Cell Biol,2003,23(7):2425-2437.
[11] Wang Z,Wang D Z,Pipes G C,et al.Myocardin is a master regulator of smooth muscle gene expression[J].Proc Natl Acad Sci U S A,2003,100(12):7129-7134.
[12] Chen J,Kitchen C M,Streb J W,et al.Myocardin:a component of a molecular switch for smooth muscle differentiation[J].J Mol Cell Cardiol,2002,34(10):1345-1356.
[13] Kee H J,Kim J R,Nam K I,et al.Enhancer of polycomb1,a novel homeodomain only protein-binding partner,induces skeletal muscle differentiation[J].J Biol Chem,2007,282(10):7700-7709.
[14] Yang J M,Sim S M,Kim H Y,et al.Expression of the homeobox gene,HOPX,is modulated by cell differentiation in human keratinocytes and is involved in the expression of differentiation markers[J].Eur J Cell Biol,2010,89(7):537-546.
[15] Obarzanek-Fojt M,Favre B,Kypriotou M,et al.Homeodo-mainonly proteinHOPis a novel modulator of late differentiation in keratinocytes[J].Eur J Cell Biol,2011,90(4):279-290.
[16] Asanoma K,Kato H,Yamaguchi S,et al.HOP/NECC1,a novel regulator of mouse trophoblast differentiation[J].J Biol Chem,2007,282(33):24065-24074.
[17] Yamashita K,Kim M S,Park H L,et al.HOP/OB1/NECC1 promoter DNA is frequently hypermethylated and involved in tumorigenic ability in esophageal squamous cell carcinoma[J].Mol Cancer Res,2008,6(1):31-41.
[18] Yamaguchi S,Asanoma K,Takao T,et al.Homeobox geneHOPXis epigenetically silenced in human uterine endometrial cancer and suppresses estrogen-stimulated proliferation of cancer cells by inhibiting serum response factor[J].Int J Cancer,2009,124(11):2577-2588.
[19] Ooki A,Yamashita K,Kikuchi S,et al.Potential utility ofHOPhomeobox gene promoter methylation as a marker of tumor aggressiveness in gastric cancer[J].Oncogene,2010,29(22):3263-3275.
[20] Chen Y,Pacyna-Gengelbach M,Deutschmann N,et al.Homeobox gene HOP has a potential tumor suppressive activity in human lung cancer[J].Int J Cancer,2007,121(5):1021-1027.
[21] Chen Y,Petersen S,Pacyna-Gengelbach M,et al.Identification of a novel homeobox-containing gene,LAGY,which is downregulated in lung cancer[J].Oncology,2003,64(4):450-458.
[22] Asanoma K,Matsuda T,Kondo H,et al.NECC1,a candidate choriocarcinoma suppressor gene that encodes a homeodomain consensus motif[J].Genomics,2003,81(1):15-25.
[23] 王洪宝.影响鸡脂类代谢重要基因的筛选及调控通路分析[D].哈尔滨:东北农业大学,2008:79,96-97.
[24] van Harmelen V,Skurk T,Rohrig K,et al.Effect of BMI and age on adipose tissue cellularity and differentiation capacity in women[J].Int J Obes Relat Metab Disord,2003,27(8):889-895.
[25] Tchkonia T,Giorgadze N,Pirtskhalava T,et al.Fat depot-specific characteristics are retained in strains derived from single human preadipocytes[J].Diabetes,2006,55(9):2571-2578.
[26] Tchkonia T,Tchoukalova Y D,Giorgadze N,et al.Abundance of two human preadipocyte subtypes with distinct capacities for replication,adipogenesis,and apoptosis varies among fat depots[J].Am J Physiol Endocrinol Metab,2005,288(1):E267-E277.
[27] Guo L,Sun B,Shang Z,et al.Comparison of adipose tissue cellularity in chicken lines divergently selected for fatness[J].Poult Sci,2011,90(9):2024-2034.
