水稻重要农艺性状的QTL定位
2012-08-08刁林林赵宏伟王敬国刘化龙邹德堂
刁林林,赵宏伟,王敬国,刘化龙,赵 雪,孙 健,邹德堂
(1.东北农业大学水稻研究所,哈尔滨 150030;2.东北农业大学大豆研究所,哈尔滨 150030)
水稻是世界上最重要的粮食作物之一,养活全世界近一半的人口。然而水稻的许多重要农艺性状都是多基因控制的数量性状,受环境条件影响较大。尽管目前国际上遗传育种工作者的大部分研究都围绕数量性状的改良,但要精确利用数量性状育出优质多抗的超高产品种还比较困难,其原因主要是数量性状的遗传基础研究得不够透彻。20世纪80年代以来,分子标记的兴起和QTL定位方法的改进,为精细研究数量性状提供了有效手段,使研究水稻各种农艺性状的遗传基础成为了可能,可以使育种家们在作物的遗传机理上提高水稻的产量与品质,为实现水稻的高产高质提供了大量的理论依据。在先前的研究中,已经对水稻的数量性状进行了大量的定位研究。包括:产量、株高、抽穗期等重要性状。Yu等用250个F2∶3家系,共检测到32个影响产量及其构成因子的QTLs,并检测到大量互作位点对产量及其构成因子有显著作用[1]。郑景生等用区间定位法分别检测到3个控制水稻生育期、株高的QTL,还检测到2个影响结实率和千粒重的QTLs[2]。马大鹏等利用水稻重组自交系群体对产量相关性状进行了QTL定位,共检测到38个QTLs,各性状QTL的累积表现贡献率达21.3%~79.5%[3]。叶少平等在第12条染色体上检测到了控制千粒重的QTL[4]。Zhuang等使用F2和F3群体对每穗实粒数,每穗颖花数等8个性状进行了QTL定位,共检测到44个QTLs,并讨论了不同环境对QTL定位的影响[5]。Xing等利用重组自交系群体,对单株产量及其构成因子进行了QTL定位,共检测到了29个主效QTLs[6]。但是,由于全球物种遗传多样性和数量性状基因QTLs的特殊性,这方面的研究还需要不断加强。传统的研究主要是籼粳稻杂交为试验材料,而籼粳稻杂交不适合与北方的种植条件,根据实际的生产要求,应更主要的是研究粳粳稻杂交育种。
本试验以粳粳稻东农422与东农427杂交,所产生的F2∶3群体为试验材料,利用在亲本间表现明显多态性的76对SSR引物对该群体进行多态性信息分析,QTL定位结果是最终在水稻的12条连锁群上,共定位到28个控制水稻株高、千粒重、穗长、有效穗数、一次枝梗数、二次枝梗数及抽穗期的QTLs,这些试验结果为后续的粳粳稻定位QTL提供了一定的理论基础。
1 材料与方法
1.1 试验材料
本研究以遗传差别较大的生产推广的优质水稻品种东农422和东农427作为亲本,双亲杂交所衍生的F2∶3群体共180份株系作为研究对象。
1.2 农艺性状的调查
于2010年将供试材料种植于东北农业大学实验实习基地。4月18日播种,5月15号移栽。随机区组设计,单行区,每行种植40棵,常规栽培管理同一般田间生产。在每一行内随机取3株,3次重复,调查各农艺性状,取3次调查结果的平均值。
①株高(cm):自地面量至一株中最高植株的穗顶(不包括芒)的高度。
②有效穗数(个):有效穗标准为有10个灌浆籽粒以上视为有效分蘖,数单株的有效分蘖数。
③穗长(cm):单株所有有效穗穗颈节到顶花颖尖长度的平均值。
④千粒重(g):称量单株内1 000粒饱满谷粒重量。
⑤一次枝梗数(个):计算全株内每一个穗的枝梗数(有两粒谷粒以上的视为一次枝梗),再求其平均值。
⑥二次枝梗数(个):计算全株内每一个穗的第二次枝梗数,再求其平均值。
⑦抽穗期调查(d):从播种到抽穗的天数记为抽穗期。
1.3 分子标记分析及遗传连锁图谱的构建
苗期在每一家系内随机选取5株新鲜叶片,提取家系及亲本样品的总DNA[7],共筛选SSR引物600对。利用筛选出的引物进行PCR扩增,反应总体积为 20 μL,体系包括3 μL的模板 DNA(25 ng·μL-1),2 μL 10×PCR缓冲液,1.5 μL MgCl2(25 mmol·L-1),2 μL SSR 引物(12 ng·μL-1),0.2 μL dNTP(10 mmol·L-1),0.3 μLTaq酶(5 U·L-1),ddH2O补足至20 μL,最后加入液体石蜡覆盖体系。PCR扩增步骤包括94℃预变性6 min,94℃变性30 s,47℃退火30 s,72℃延伸30 s,72℃延伸5 min,35个循环,4℃保存。
本研究将来源于亲本东农422(父本)带型记为A,来源于东农427(母本)带型记为B,双亲杂合带型记为H,缺失记为“-”。运用Mapmaker/Exp 3.0作图软件进行连锁图谱的构建,应用Group命令进行连锁分析和分组(LOD=3.0),连锁标记少于8个的用Compare命令进行优化排序,多于8个的用Ripple命令排序,错误检测水平设为1%,利用Kosambi函数将重组率转换成遗传图距(cM),采用Mapchart2.1进行遗传连锁图谱的绘制。
2 结果与分析
2.1 表型值分析
所考察的7个性状的表型统计参数值和表型分布见表1。参照亲本的各性状表现,后代群体的各性状表现多种多样,具有两亲本的各种重组类型,并表现出许多超亲现象,并呈连续分布,因此可以推测各性状受多基因控制。这符合数量性状的特点,适合于QTL作图分析。
2.2 引物的筛选及多态率
根据网上公布的水稻分子遗传图谱,选覆盖水稻12条染色体的600对SSR引物在东农422与东农427间进行多态性检测,有76对引物在双亲间表现明显多态性,平均多态性引物比率为12.8%,大多数引物对不能扩增出特异性条带,或扩增条带的重复性差,未纳入多态性信息分析中,标记在连锁群上的分布是不同的,其中分子标记最多的染色体为第6号染色体,其上有12个标记;最少的是12号染色体,其上有2个标记。其中筛选出多态性引物最多的染色体是Chr6和Chr7,每条染色体上分别有12和10对特异性引物。其中第7条染色体上筛选出来特异性引物的多态性引物比率最大为18.5%,而第12条染色体上筛选出来特异性引物的多态性标记比率最小,仅为4.7%。分子标记间的平均遗传距离为31.36 cM,最远的为88 cM,最近的为2.9 cM。标记间距离很大的区段还是普遍存在的,所以还需要更多的分子标记来加密遗传图谱,以减少图距。

表1 7个性状在双亲间的差异以及在F2∶3群体中的变异Table 1 Difference of seven traits between parents and among the F2∶3population from the cross of Dongnong422×Dongnong427
2.3 主要农艺性状的QTL分析
对所考察的株高、千粒重、有效穗数、穗长、一次枝梗数、二次枝梗数及抽穗期进行QTL定位分析。
本研究在水稻的12个连锁群上共检测到28个QTLs,在第1、4、5、6、7、8、10、11和12号染色体上都有分布,单个表型贡献率从3.13%~38.03%。其中主要集中在第6和7号染色上,其上分别检测到8个QTLs和5个QTLs,且在这两条染色体的相应区段上存在着同时控制多个性状的QTL密集区。
由图1、表2可知,共检测到5个控制株高的QTLs,分别位于第1、4、5和10条染色体上,其单个贡献率从5.71%~23.13%,其加性效应从-2.50到1.10。
共检测到2个控制有效穗数的QTLs,都是位于第6条染色体上,分别位于第6条染色体的RM494-RM345与RM162-RM217的区间上,表型贡献率分别为10.12%~9.63%。
共检测到4个控制千粒重的QTLs,分别位于第6、第7、第8、第12条染色体上,其单个贡献率从9.87%~27.88%,其加性效应从-3.02到1.87。
共检测到6个控制穗长的QTLs,分别位于第5、第7、第8条染色体上,且在第8条染色体上的3个区段RM25-RM458,RM44-RM1345,RM1345-RM264检测到了3个QTLs。
共检测到2个控制一次枝梗数的QTLs,都是位于第6条染色体上,分别位于第6条染色体上的RM494-RM345与RM217-RM528的两个区段内。其贡献率分别为8.01%与23.03%。
本研究中分别在第1、第3、第6、第7、第11条染色体上定位出了影响水稻抽穗期的QTLs,表型贡献率从3.13%~30.10%,加性效应从-0.02到0.43。

图1 水稻农艺性状的QTL定位Fig.1 Location of agronomic traits in rice
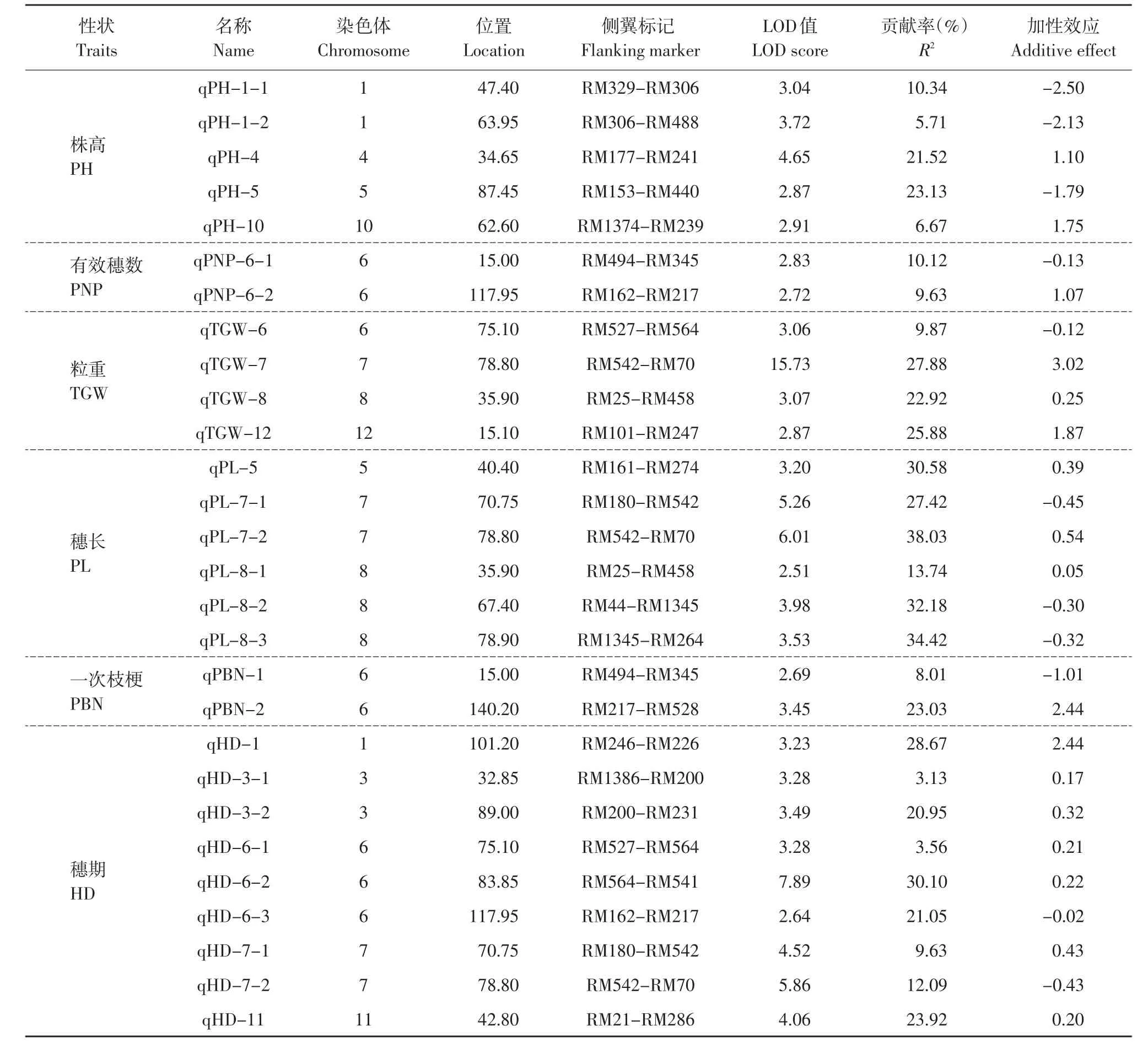
表2 水稻农艺性状的QTL定位和效应分析Table 2 Effect analysis and QTL location of agronomic traits in rice
3 讨论
水稻的株高是重要的农艺性状之一,直接关系到水稻品种的株型,抗倒伏性,区域布局与产量构成。祝莉莉等利用水稻品系B50与籼稻品种明恢630为亲本得到的重组自交系群体在第1与第7号染色体上检测到控制株高的QTLs,总表型变异率达到74.9%[8]。Liu等利用IR64/Azucena的DH群体检测到控制株高的15个QTLs,其中8个具有加性效应,1个QTL具有加性与环境的互作效应[9]。Jiang等利用珍汕97/武育粳2号的DH群体,定位了控制株高的12个QTLs,分别位于1、2、3、9号染色体上各1个QTLs,6、7、8、12号染色体上各2个QTLs,总共解释53.9%的表形变异[10]。目前,已定位的水稻株高QTL已有900多个(http://www.gramene.org.cn),在12条染色体上都有分布,但主要集中在第1、2、3、4和5条染色体上。本试验所得到的控制株高的QTLs主要分布在1、4、5、10号染色体上有相同的染色体分布。虽然能检测到相同的染色体,但并没有找到相同的分子标记,这说明了不同品系间的基因型差异。
利用分子标记进行水稻千粒重的QTL定位有不少的报道。Li等利用CSSLs群体在水稻的第3条染色体上检测到影响千粒重的QTL[11]。Xie等在水稻的第8与第9条染色体上检测到影响千粒重的QTL[12]。徐建龙等在9条染色体的l7个区域检测到影响粒重及相关性状的主效QTLs 48个[13]。李泽福等用Nipponbare Kasalath/nipponbare回交重组自交系检测到的5个控制千粒重的QTLs,共解释性状变异的66.9%,分布在3条染色体上,单个QTL的贡献率在6.6%~31.1%之间[14]。从以上对比结果来看,很多控制产量性状QTL在不同的群体和环境中检测的结果在各个染色体上都有分布,大不相同,但有交叉的部分。本研究在第4、第6、第7、第8、第12号染色体上检测到影响千粒重的QTLs,前人的报道几乎都可以检测到。
穗长是水稻产量的重要构成因子之一,利用分子标记对穗长的QTL定位也有许多报道,但结果存在较大差异。Zhuang等利用F2和F3群体在第2和第8号染色体上检测到2个影响穗长的QTLs基因。Lu等利用DH系群体在第6号染色体上检测到1个影响穗长的QTL基因[15]。本研究中我们通过SSR标记进行穗长基因QTL定位,在第5、第7、第8号染色体上检测到影响穗长的QTLs,在先前的报道中都有检测到,也进一步丰富了穗长性状QTL研究的成果,为穗长基因的精细定位提供了有力的佐证。
关于有效穗数的QTL报道较少,封功能等共检测到12个QTLs,分布于第2、3、4、5、6、7、8、9、10号染色体上,其中qPN4-3既有加性效应,并且加性效应显著[16]。Xiao等用9024/LH422重组自交系检测到位于第4条染色体区段上的控制有效穗数的一个主效QTL(qPN-4)[17]。Liao等利用一个重组自交系群体,在两种不同环境下共检测到9个控制有效穗数的QTLs,其中有3个在不同环境中同时表达[18]。刘桂富等利用DH群体在水稻的第1、4、10、12条染色体上检测到了影响穗数的4个QTLs[19]。可见,几乎在各条染色体上都有关于控制有效穗数的QTL存在。本试验中,只在第6条染色体上检测到两个影响水稻有效穗数的QTLs。
很多国内外研究者对一次枝梗数、二次枝梗数也有部分研究,Lin等在F2群体上检测到在第8条染色体上1个对一次枝梗数贡献率为20.9%的QTL[20]。陈顺强等利用DH群体在第1、8及第10条染色体上的相应区段检测到了3个控制一次枝梗数的QTLs,在第1和10两条染色体检测到了两个控制二次枝梗数的QTLs[21]。本研究中只在第6条染色体上检测到两个控制一次枝梗数的QTLs,而且并没有检测到控制二次枝梗数的QTLs。这可能与试验所用的材料、构建的群体,试验环境不同有关。
水稻的抽穗期是重要的农艺性状之一,对水稻抽穗期进行遗传性分析有利于了解短日植株的开花习性和对水稻品种的改良。利用分子标记进行水稻抽穗期QTL定位已有不少研究报道,所定位出的控制抽穗期的QTLs在各个染色体上都有报道,但主要集中在第6、7和8条染色条上[22]。李仕贵等认为迄今已报道了28个控制水稻抽穗期的主效基因,则集中分布在水稻第6、第7、第10条染色体上[23]。Li等利用Lement/Teqing组合的F4群体定位了3个抽穗期QTL[24]。Yu等利用Zhanshan 97/Minghui 63的F2∶3代的240个家系检测到6个抽穗期QTL和许多对抽穗期有显著影响的互作QTL[1]。Zhou利用1个籼粳交组合的DH群体定位了19个抽穗期QTL[25]。本试验是在第1、第3、第6、第7、第11号染色体上检测到影响抽穗期的QTLs,这与前人报道的有交叉的染色体分布结果大体一致。
4 结论
本研究所得出的结果是在水稻的12条连锁群上,共检测到28个控制水稻株高、千粒重、穗长、有效穗数、一次枝梗数、二次枝梗数及抽穗期的QTLs,具体的定位结果如下:
①共检测到5个控制水稻株高的QTLs,分别位于第1、第4、第5、第10条染色体上,其单个贡献率5.71%~23.13%。
②共检测到2个控制有效穗数的QTLs,都是位于第6条染色体上,贡献率分别为10.12%与9.63%,其中位于RM494-RM345区段的QTL为主效QTL。
③共检测到4个位于第6、第7、第8、第12条染色体上控制千粒重的QTLs,其单个贡献率9.87%~57.88%。
④共检测到6个分别位于第5、第7、第8条染色体上,控制穗长的QTLs,其中位于第8条染色体RM1345-RM264区段所检测到的贡献率达到34.42%。
⑤共检测到2个都是位于第6条染色体上控制一次枝梗数的QTLs,分别位于第6条染色体上的RM494-RM345与RM217-RM276两个区段内。其贡献率分别为8.01%与23.03%。
⑥共检测到9个位于第1、第3、第6、第7、第11条染色体影响水稻抽穗期的QTLs,表型贡献率3.13%~50.10%。
[1] Yu S B,Li J X,Zhang Q F.Importance of epistasis as the eneticbasis of heterosis in an elite rihybrid[J]Proc Natl Sci USA,1997,94:9226-9231.
[2] 郑景生,江良荣,曾建敏,等.应用明恢86和佳辐占得F2群体定位水稻部分重要农业性状和产量构成的QTL[J].分子植物育种,2003,1(5):633-639.
[3] 马大鹏,罗利军,汪朝阳,等.利用重组自交系群体对水稻产量相关性状的QTL分析[J].分子植物育种,2004,2(4):507-522.
[4] 叶少平,张启军.用培矮64S与日本晴F2群体对水稻6个农艺性状的QTL定位[J].中国水稻科学,2007,21(1):39-43.
[5] Zhang J Y,Lin H X,Lu J.Analysis of QTL×environment interaction for yield components and plant height in rice[J].Theor Appl Genet,1997,95(5-6):799-808.
[6] Xing Y Z,Tan Y F,Hua J P,et al.Characterization of the main effects,epistatic effects and their environmental interactions of QTLs on the genetic basis of yield traits in rice[J].Theoretical and Applied Genetics,2002,105(2-3):248-257.
[7] 王关林,方宏筠.植物基因工程[M].北京:科学出版社,2009:438.
[8] 祝莉莉,谭光轩,任翔,等.5种重要农艺性状基因在水稻重组自交系群体中的定位[J].武汉大学学报:理学版,2003,49(6):787-792.
[9] Liu H X,Zhuang Y J,Qian R H.Mapping QTL for plant height and its components by molecular markers in rice(Orya sativaL.)[J].Acta Agronconica Sinica,1996,22:257-263.
[10] Jiang G H,Liang G H,Zhai W X,et al.Genetic mapping of a new semi-dwarf gene,sd-t(t),in indica rice and estimating of the physical distance of the mapping region[J].Science in China Series C-Life Sciences,2002,45(4):388-396.
[11] Li S G,Ma Y Q,Wang W M,et al.Molecular tagging of a new recessive gene for late heading in a rice cultivar 8987[J].Acta Genetica Sinica,2000,27(2):133-138.
[12] Xie X,Song M H,Jin F,et al.Fine mapping of a grain weight quantitative trait locus on rice chromosome 8 using near-isogenic lines derived from a cross betweenOryza sativaandOryza rufipogon[J].Tag Theoretical and Applied Genetics Theoretische and Angewandte Genetik,2006,113(5):885-894.
[13] 徐建龙,薛庆中,罗利军,等.水稻粒重及其相关性状的遗传解析[J].中国水稻科学,2002,16(1):6-10.
[14] 李泽福,夏加发,苏泽胜,等.水稻产量及其相关性状的数量性状基因座分析[J].南京农业大学学报,2002,25(2):1-6.
[15] Lu C,Shen L,He P,et al.Comparative mapping of QTLs for agronomic traits ofrice acrossenvironments by using a doubled-haploid population[J].Tag Theoretical and Applied Genetics Theoretische and Angewandte Genetik,1997,94(1):145-150.
[16] 封功能.水稻釉粳交DH群体产量相关性状的QTL定位和上位性分析[J].扬州大学学报,2004,25(2):24-26.
[17] Xiao J,Yuan L,Tanksleys.Identification of QTL affecting traits of agronomic importance in a recombinant inbred population derived from a subspecific rice cross[J].Theor Appl Genet,1996,92:230-244.
[18] Liao C Y,Wu P,Hu B,et al.Effects of genetic background and environment on QTLs and epistasis for rice(Oryza sativaL.)panicle number[J].Theoretical and Applied Genetics,2001,103(1):104-111.
[19] 刘桂富,卢永根.水稻产量,株高及其相关性状的QTLs定位[J].华南农业大学学报,1998,19(3):5-9.
[20] Lin H X,Qian H R,Zhuang J Y,et al.RFLP mapping of QTLs for yield and related characters in rice(Oryza sativaL.)[J].Theor Appl Genet,1996,92:920-927.
[21] 陈顺强,汪洋,章志宏,等.用RFLP标记剖析水稻穗颈维管束及穗部性状的遗传基础[J].武汉植物学研究,2004,22(1):15-21.
[22] 李泽福,周彤,郑天清,等.水稻抽穗期QTL与环境互作分析[J].作物学报,2002,28(6):771-776.
[23] 李仕贵,马玉清,何平,等.不同环境条件下水稻生育期和株高的QTL分析[J].作物学报,2002,28(4):546-550.
[24] Li J,Thomson M,Mccouch S R.Fine mapping of a grain-weight quantitative trait locus in the pericentromeric region of rice chromosome 3[J].Genetics,2004,168(4):2187-2195.
[25] Zhou L Q.Genetica dissection of heading time and its components in rice[J].Theor Appl Genetica,2001,102:1236-1242.
