红菇子实体多糖的提取及其抗氧化活性研究
2012-08-08李碧婵王贺祥
李碧婵 ,李 淼,王贺祥*
(1.武夷学院茶学与生物系,福建 武夷山 354300;2.中国农业大学生物学院农业生物技术国家重点实验室,北京 100193)
多糖又称多聚糖(Polysaccharide),是由醛糖或酮糖通过脱水形成糖苷键,并以糖苷键线性或分枝连接而成的链状聚合物。一般聚合度大于10,分子量为数万至数百万[1]。多糖是构成生命活动的四大基本物质之一,广泛存在于生物体中,与生命的多种生理功能密切相关,具有重要的保健和临床应用价值。目前已有不少关于食用菌如猪苓、香菇、灵芝、云芝等多糖的研究。
红菇(Russula)是一类大型菌根真菌,属担子菌门、担子菌纲、红菇目、红菇科、红菇属[2]。红菇中含有丰富的碳水化合物、蛋白质、氨基酸、维生素以及人体必需的微量元素,具有极高的营养保健价值。近年来的研究发现,红菇有抗癌、降血糖、降血脂、提高机体免疫力、抑菌、清除自由基、修复甲醛所致的氧化损伤等功效[3-10]。闽北是正红菇(Russula vinosa Lindlad)的著名产区[11]。本文对闽北正红菇中的主要活性物质红菇多糖的提取方法和体外抗氧化活性进行了研究,为进一步开发利用闽北红菇提供了理论依据。
1 实验材料
1.1 材料
正红菇子实体,购自武夷山。
1.2 试剂
DEAE-cellulose购自美国Sigma公司;蒽酮、乙酸乙酯、蔗糖、铁氰化钾、邻二氮菲、硫酸亚铁、过氧化氢、亚硝酸钠、对氨基苯磺酸、盐酸萘乙二胺、乙醇等试剂均为分析纯(AR);水为重蒸水。
2 实验方法
2.1 红菇多糖的提取
红菇子实体流水冲洗去泥沙,60℃烘干至恒重,粉碎;然后称取一定量菇粉于锥形瓶中,加水浸提,重复2次,减压过滤后用旋转蒸发仪浓缩;再加入3倍体积乙醇,封口,静置过夜,离心分离,沉淀物经真空干燥即为粗多糖。
2.2 红菇多糖的纯化
将粗多糖溶于水,Sevage法除去蛋白质,再乙醇沉淀,沉淀物抽滤干燥,依次用丙酮、乙醚洗涤,真空干燥得到红菇多糖半纯品。将该多糖溶于水,抽滤,滤液上DEAE-纤维素层析柱(2.5 cm×20 cm),用 0~1.0 mol·L-1NaCl缓冲液梯度洗脱,测定各管洗脱液在波长280 nm的吸光度,合并各分段洗脱液。
2.3 多糖含量及得率的测定
多糖含量测定:采用蒽酮-硫酸法测定,多糖得率(%)为粗多糖重量与子实体干粉重量的百分比值。
2.4 红菇多糖还原力的测定
用Oyaizu等提出的还原三价铁离子法测定正红菇多糖的还原能力[12]。具体步骤如下:取pH 6.6的磷酸缓冲液和质量分数为0.1%的铁氰化钾溶液各2.0 mL,分别加入不同质量浓度的多糖溶液2.0 mL,混匀后50℃水浴20 min,速冷,然后加入质量分数为10%的三氯乙酸溶液2 mL,混匀,3000 r·min-1离心10 min,取上清液2.0 mL,再加入质量分数为0.3%的氯化铁0.4 mL,混匀,然后加入2.0 mL蒸馏水,混匀,以蒸馏水调零,在波长700 nm处测定吸光度。以抗坏血酸作为阳性对照,平行测定3次。
2.5 红菇多糖清除·OH能力的测定
用Fenton反应法产生羟基自由基(·OH),H2O2/Fe2+体系可以通过Fenton反应产生羟基自由基(·OH),其反应式如下:
H2O2+Fe2+→·OH+OH-+Fe3+
溶液中的邻二氮菲-Fe2+水溶液(红色)氧化为邻二氮菲-Fe3+(褪色),以此测定·OH数量的变化,实现抗氧化剂清除自由基能力的测定[13]。
精密量取pH7.4 PBS缓冲液2.0 mL和8.0 mL重蒸水,混匀做空白参比管。
依次精密量取邻二氮菲溶液(5 mmol·L-1)1.0 mL,PBS缓冲液2.0 mL, 硫酸亚铁溶液(7.5 mmol·L-1)1.5 mL和重蒸水5.5 mL,混匀做未损伤管;依次精密量取邻二氮菲溶液(5 mmol·L-1) 1.0 mL,PBS缓冲液 2.0 mL,硫酸亚铁溶液(7.5 mmol·L-1) 1.5 mL,H2O2(0.1%) 1.0 mL 和重蒸水4.5 mL,混匀做损伤管。
依次精密量取邻二氮菲溶液(5 mmol·L-1)1.0 mL,PBS缓冲液 2.0 mL, 硫酸亚铁溶液(7.5 mmol·L-1)1.5 mL,H2O2(0.1%)1.0 mL,分别加入不同浓度的多糖溶液和重蒸水共4.5 mL,混匀做样品管,以抗坏血酸作为标准抗氧化剂,将上述试管同时置于37℃恒温水浴中,60 min,以空白参比管调零,在536 nm处测定吸光度,计算羟自由基清除率(d)。平行测定3次。式中:A1为加样管在536 nm处吸光度;A2为损伤管在536 nm处吸光度;A3为未损伤管在536 nm处吸光度。

2.6 红菇多糖在体外模拟胃液条件下清除NO2-的反应
准确量取不同浓度多糖溶液5.0 mL于25 mL的比色管中,加入pH为3.0的柠檬酸-磷酸氢二钠缓冲液5.0 mL,5 mg·L-1NaNO2溶液2.0 mL,于37℃恒温水浴锅中恒温反应1 h,加入0.4%对氨基苯磺酸2.0 mL,摇匀静置5 min,再加入0.2%盐酸萘乙二胺1.0 mL,用蒸馏水稀释至刻度,摇匀静置15 min。在540 nm处测其吸光度。以抗坏血酸为对照。清除率计算公式如下:

式中:E为清除率;A0为未加多糖时测定的NaNO2的吸光度;A为加多糖时测定的NaNO2的吸光度。
3 结果与分析
3.1 提取红菇多糖的正交实验
选取水料比、浸提时间、浸提温度3个对多糖提取影响较大的因素,按L9(34)设计三因素三水平试验 (表1)。试验结果如表2所示。
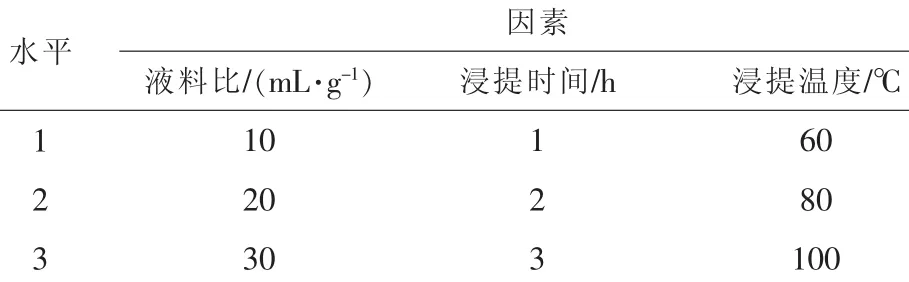
表1 试验因子和水平表L9(34)

表2 红菇多糖提取正交试验设计与结果
由表2中极差分析结果可知,各因素对红菇多糖得率影响的主次顺序为:A>C>B,即水料比对多糖得率的影响最大,浸提时间比水料比的影响稍小,浸提温度的影响最小。各极差结果有A因素列为K3>K2>Kl,B因素列为K1>K3>K2,C因素列为K3>K2>Kl。从实验结果分析得出较优方案为:A3B1C3,即水料比为30,浸提温度60℃,浸提时间3 h。在此提取条件下,多糖得率为4.326%。从水料比因素中最好的水平是A3,温度最好的水平是B1,浸提时间最好的水平是C3,这三个水平组合起来即A3B1C3,这正好是实验号7的实验条件,所以可以确定A3B1C3是最优方案。在这个条件下做验证实验得到的实验结果是多糖得率为4.335%,因此取平均值红菇多糖得率为4.33%。
3.2 粗多糖的糖含量分析
以蒽酮-硫酸法测定,得到糖浓度含量x(g)与吸光度y之间的线性方程 y=0.0065x+0.0014,相关系数R2=0.9994,由此计算出粗多糖的糖含量为(45.83±0.54)%。
3.3 红菇多糖的纯化
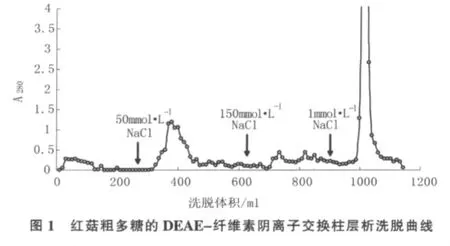
粗多糖经Sevage法去蛋白、DEAE-纤维素阴离子交换柱层析,分段洗脱后得到4个吸收峰D1、D2、D3和D4,经蒽酮-硫酸法检测均为多糖。其中D1组分多糖含量最高,其次为D4、D3,D2组分多糖含量最少。洗脱曲线如图1所示。
3.4 红菇多糖还原力的测定
红菇多糖的还原力测定结果见表3和表4。
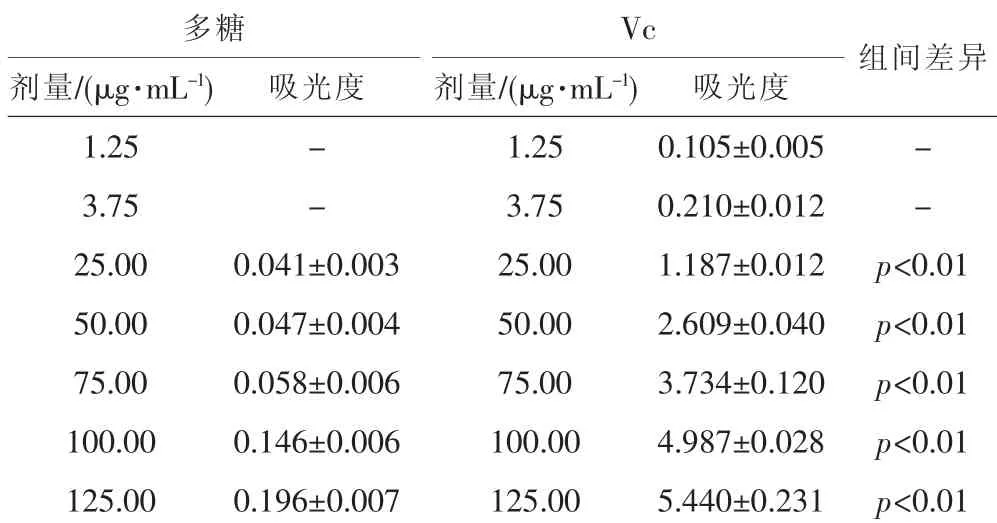
表3 红菇粗多糖的还原力测定
从表3测定结果可以看出,红菇多糖具有一定的还原力,且随着剂量的增加,还原力逐渐增强。但与Vc相比,其还原力较弱,红菇多糖剂量为125 μg·mL-1时的还原能力才与 3.75 μg·mL-1的 Vc 相当(p>0.05)。
由表4可知,不同剂量的红菇多糖组分具有一定的还原力,且随着红菇多糖组分剂量的增加,其还原力逐渐增强。在相同剂量下,不同红菇多糖组分的还原力大小依次为D4、D3、D2、D1。其中D1组分还原力较红菇粗多糖弱。D4、D3、D2组分的还原力优于红菇粗多糖,在剂量为12.5 μg·mL-1时,超过粗多糖 75 μg·mL-1时的还原力。 但与 Vc相比,其还原力较弱。D4、D3、D2、D1组分的还原力分别为同剂量Vc的27.62%、17.62%、12.38%、1.35%。
3.5 红菇多糖清除羟基自由基(·OH)的能力测定
红菇多糖清除·OH试验结果见表5、表6。
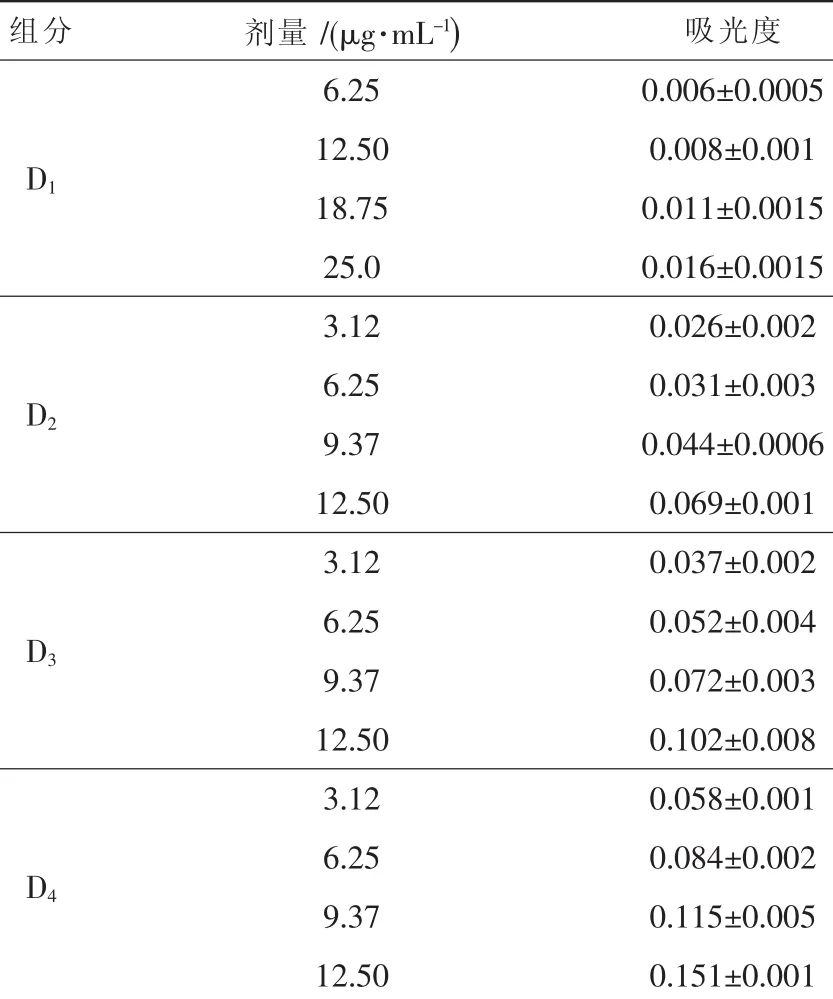
表4 红菇多糖不同组分还原力测定
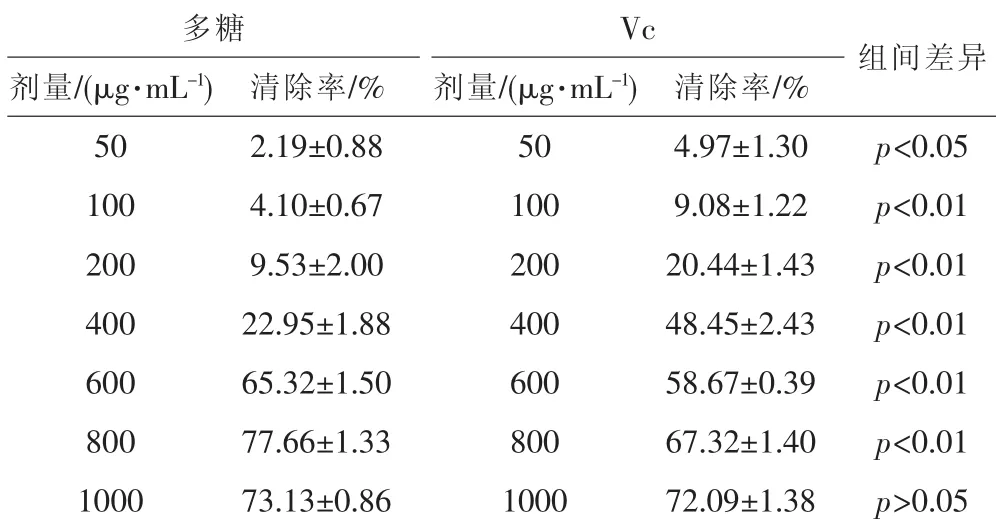
表5 红菇粗多糖对·OH的清除效果
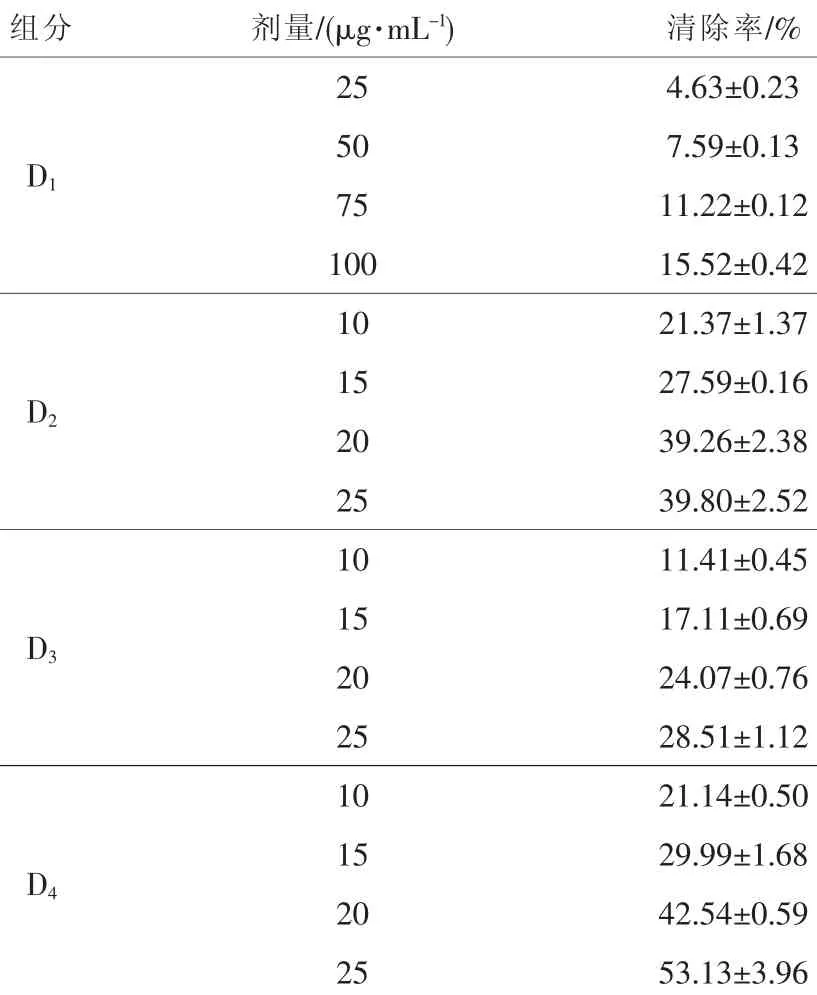
表6 红菇多糖不同组分对·OH的清除效果
从表5可以看出,红菇多糖和Vc对·OH均有清除作用,在 50 μg·mL-1~800 μg·mL-1之间随着剂量增加,清除率明显上升,特别是剂量从 400 μg·mL-1增到 600 μg·mL-1时,清除率从22.95%跃升到65.32%;此后随着剂量的增加,清除率缓慢上升,当剂量增加到800 μg·mL-1时,清除率达到最大,为77.66%。而Vc溶液在该剂量范围内清除率在4.97%~72.06%之间,也随着剂量增加而增加。
当红菇多糖剂量增加到 600 μg·mL-1和 800 μg·mL-1时,清除率优于 Vc(p<0.01),剂量增加到 1000 μg·mL-1时清除率与同剂量Vc相当,无显著差异(p>0.05),说明红菇多糖对·OH具有良好的清除作用。
不同红菇多糖组分对·OH的清除效果如表6所示,不同剂量的红菇多糖组分对芬顿体系产生的·OH自由基均有一定的清除作用,且随着红菇多糖组分剂量的增加,其清除效果逐渐增强。 在剂量为 25 μg·mL-1时,D1、 D2、 D3、D4对·OH的清除率分别是 4.63%、39.80%、28.51%和53.13%,以D4对·OH的清除效果最佳。在低剂量时,纯化后的多糖对·OH的清除效果优于粗多糖及Vc。其中D1组分在剂量为100 μg·mL-1时对·OH的清除率分别是同剂量粗多糖的3.78倍,Vc的1.71倍;而D2、D3、D4组分在使用剂量为25 μg·mL-1时,对·OH的清除率均超过粗多糖 400 μg·mL-1时的清除率; 在该使用剂量下,D2、 D3组分对·OH的清除率超过 Vc为 200 μg·mL-1时的清除率(20.44%),D4组分对·OH的清除率超过 50%,超过 Vc 400 μg·mL-1时的清除率(48.45%)。 由此可知 D4具有很强的清除·OH的活性。
3.6 红菇多糖在体外模拟胃液的NO2-清除反应
亚硝酸盐(NO2-)是亚硝胺的前体物,亚硝胺是人和动物的强致癌物,它能引起人体和动物的肝脏等多种器官的恶性肿瘤。通过消除体内的NO2-,可以明显减少患癌的比率[14]。实验结果如表7所示。
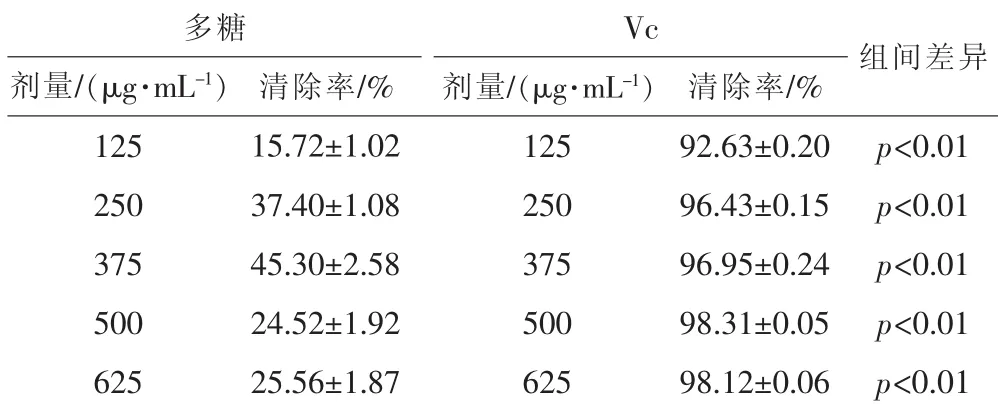
表7 红菇粗多糖在体外模拟胃液条件下对NO2-的清除效果
由表7测定结果可见,红菇粗多糖和Vc均能有效清除NO2-,且随着剂量的增加,清除率呈现出明显的梯度变化。 红菇多糖剂量从 125 μg·mL-1增至 375 μg·mL-1时,清除率显著增加,当用量达到375 μg·mL-1时,清除率达到最大45.3%,再增加多糖的剂量时,清除率反而下降。而Vc剂量为125 μg·mL-1时,清除率即超过 50%,能显著清除NO2-,且随着Vc剂量增加,清除率增大;Vc的清除率显著高于同剂量的红菇粗多糖(p<0.01)。
不同红菇多糖组分在体外模拟胃液条件下对NO2-的清除效果不同,D4组分在体外模拟胃液条件下对NO2-有一定的清除作用,且随着多糖剂量的增加,清除率呈现出明显的梯度变化;在剂量为100 μg·mL-1时,D4组分对NO2-的清除率超过粗多糖在125 μg·mL-1时的清除率。但较Vc弱。其余各组分对NO2-均无清除作用。
4 讨论
许多研究表明食用菌类的多糖对ROS具有清除作用,能减少脂质过氧化产物的生成量,增加超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶 (GSH-Px)活性,具有良好的抗氧化性能,且毒副作用小,是具有清除自由基和代谢调节作用的天然物质。从正红菇子实体中提取得到红菇粗多糖,经脱蛋白、DEAE-纤维素阴离子交换柱层析分离得到 D1、 D2、 D3和 D4四个组分。
实验结果表明,红菇粗多糖及其各组分具有一定的还原能力,对芬顿体系产生的·OH有较好的清除作用,在体外模拟胃液条件下对NO2-有一定的清除效果,说明红菇多糖具有一定的抗氧化作用。与Vc相比,红菇多糖在还原能力和清除NO2-的能力要弱很多,而在清除·OH方面却显示了极强的能力。尤其是D4组分,在极低的浓度下(25 g·mL-1)对·OH的清除率超过50%,超过Vc浓度400 μg·mL-1时的清除率(48.45%)。
上述实验表明,红菇多糖的开发利用为真菌多糖提供了新的材料和数据,为筛选抗氧化药物提供了理论依据,并可为红菇的进一步研究和开发利用提供依据。
[1]王庭欣,王庭祥,庞佳宏.植物多糖生物活性研究进展[J].食品研究与开发,2005,26(6):200-202.
[2]王青云,石木标.中国红菇的研究现状与展望[J].中国食用菌,2004,23(4): 10-12.
[3]邱龙新.正红菇子实体多糖的提取技术及抗癌活性研究[J].中国食用菌,2004,23(16):48-50.
[4]余萍,刘艳如,林曦.红菇子实体多糖的理化性质及抗癌活性[J].天然产物研究与开发,2006(18):30-34.
[5]娄小华,甘耀坤,王黎明,等.红菇提取液对甲醛所致氧化损伤的保护作用[J].毒理学杂志,2007,21(3):225-226.
[6]甘耀坤,娄小华,李岩,等.红菇子实体抗氧化性能的初步研究[J].食用菌,2007(1):57-59.
[7]陈旭健,杨振德,阮家兴.红菇对高糖高脂大鼠肝功能的影响[J].山东医药,2007,47(35):21-22.
[8]陈旭健,甘耀坤,吴慧慧,等.红菇子实体对小鼠血糖、血脂的影响[J].食品科技,2008(4):237-239.
[9]陈旭健,甘耀坤,罗应棉.红菇子实体提取液的抑菌作用研究[J].安徽农业科学,2008,36(10):4138-4139.
[10]曾诗媛,甘耀坤,叶楚芳.红菇提取液对大龄小鼠抗氧化作用的研究[J].安徽农业科学,2009,37(16):7464-7466.
[11]范俐.福建省红菇的地理分布及其依存的植被类型[J].食用菌,2006(4): 4-6.
[12]Oyaizu M.Antioxidative activity of browning products of glucosamine fractionated by organic solvent and thin layer Chromatography[J].Nippon Sho Kuhin Kogyo Gakkaishi,1986(35):771-775.
[13]周波,王晓红,陈丽丽,等.玉米紫色植株色素体外抗氧化活性实验研究[J].现代食品科技,2007,23(4):23-25.
[14]林桂兰,许学书,连文思.食用菇多糖提取物体外抗氧化性能研究[J].华东理工大学学报:自然科学版,2006,32(3):278-280.
