对碱性磷酸酶试剂盒特征吸收峰的分析
2012-08-07何乐春重庆医疗器械质量检验中心重庆401147
何乐春 重庆医疗器械质量检验中心 (重庆 401147)
0.前言
碱性磷酸酶(ALP)广泛分布于人体各脏器官中,主要存在于肝脏、骨骼成骨细胞、胎盘、肾脏、肠壁等。其中以肝脏为最多,其次为肾脏、骨骼、肠和胎盘等组织。血清中的ALP主要来自肝脏和骨骼。生长期儿童血清内的大多数来自成骨细胞和生长中的骨软骨细胞,少量来自肝。ALP也是目前免疫诊断试剂产品最常用的标记酶之一,临床上测定ALP主要用于骨骼、肝胆系统疾病的诊断和鉴别诊断,尤其是黄疸的鉴别诊断。对于不明原因的高ALP血清水平,可测定同工酶以协助明确其器官来源。ALP测定试剂盒则用于体外定量检测人血清或血浆中碱性磷酸酶的活性,在临床上作辅助诊断用。
1.试验过程
1.1 碱性磷酸酶试剂盒说明
试剂盒里试剂为双试剂,即分别由R1(缓冲液,主要成分为2-氨基-2-甲基-1-丙醇)、R2(底物,主要成分为对硝基苯磷酸盐)组成。
1.2 试验原理
对硝基磷酸盐在PH10.4且有镁离子存在的环境下,可以被ALP水解成p-NP,p-NP在405nm处有特异性吸收,且由p-NP引起的吸光度上升的速率与ALP的活力成正比。
(1)试验依据:采用企业注册标准《碱性磷酸酶试剂盒》中对“试剂空白吸光度”的试验方法,同时结合产品说明书进行试验。
试剂空白吸光度:将R1试剂与R2试剂以5:1混合配制成应用试剂,用蒸馏水调整分光光度仪的零点后,测定试剂在波长405nm、1cm比色池、37℃条件下稳定30s后的吸光度,测定3次,取其平均值作为应用试剂的空白吸光度,吸光度值应≤0.6。
(2)试验试剂:严格按照产品说明书中对ALP的检验方法要求,即R1:R2:质控血=25:5:1配制成试验试剂。
(3)试验仪器:半自动生化分析仪(Secomam Basic)、全自动生化分析仪(迈瑞BS-800)、紫外分光光度仪(TU-1901)。
(4)试验步骤。
(a)用半/全自动生化分析仪和紫外分光光度仪分别连续3次检测应用试剂空白吸光度(检测波长为405nm、412nm、415nm);
(b)用紫外分光光度仪对应用试剂进行扫描(以蒸馏水调整分光光度仪零点);
(c)用紫外分光光度仪对试验试剂进行扫描,检出特征吸收峰(以应用试剂调整分光光度仪零点)。
2.试验结果
(1)用不同仪器检测得出试剂空白吸光度的值(见表1)。
(2)以蒸馏水调零,得出应用试剂的光谱图(见图1)。
(3)以应用试剂调零,得出试验试剂光谱图,检出特征吸收峰(见图2)。
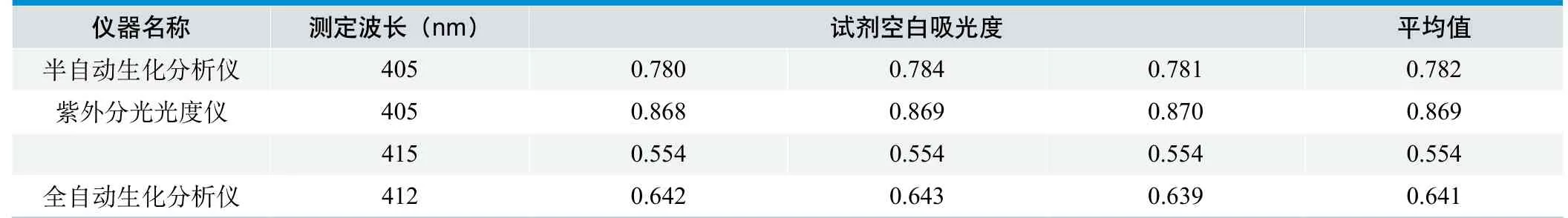
表1.
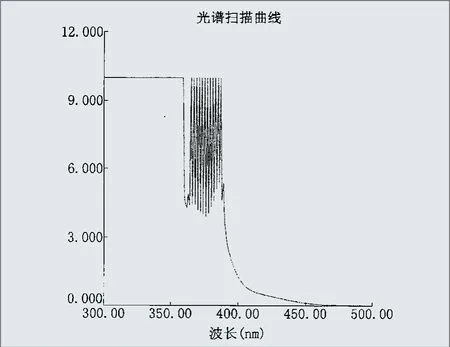
图1.
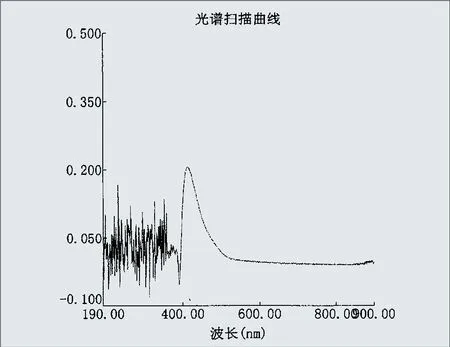
图2.
3.对试验结果的分析
3.1 企业的产品注册标准中要求试剂空白吸光度应≤0.6,从表1中数据得出:第一,在测定波长为405nm时,用半自动生化分析仪和紫外分光光度仪所测得吸光度均大于0.6,不符合标准要求,且两台仪器所测得的值有一定差异,差值近0.1。
3.2 从图1可看出,以蒸馏水调零后,应用试剂的吸光度在400nm~450nm波长范围呈下降趋势,其下降趋势与表1中用不同仪器分别在412nm、415nm这两个波长所测得的具体数据相吻合。
3.3 从图2得出,试验试剂的特征吸收峰为415nm,与试验原理中所提及到的“p-NP在405nm处有特异性吸收”不相吻合。
4.结束语
ALP试剂盒的试验原理为ALP将硝基磷酸盐水解成对硝基酚(p-NP),即是以最终反应生成物p-NP吸光度的变化率来检测出ALP的活力。根据相关文献报道:不同的酸碱度对p-NP的呈色反应有影响,酸性时P-NP最大吸收峰为295~340nm;碱性时P-NP最大吸收峰为375~420nm。该厂家生产的试剂盒的试验原理中特别注解试验环境“在PH10.4”(即为碱性环境),特征吸收峰为405nm,与试验所得特征吸收峰为415nm虽都在文献报道的吸收峰范围内,但两个吸收峰相差10nm。查阅目前市场上几大厂家生产的碱性磷酸酶试剂盒(试验原理相同)的说明书,说明书上皆标注在405nm处有特征吸收峰,这与紫外分光光度仪的特性不相吻合(注:从紫外分光光度仪的特性来讲,任一物质通过仪器扫描所得的特征吸收峰和理论吸收峰之差都应在±2nm内)。
在此,笔者对该厂家企业注册标准中对空白吸光度的要求(≤0.6)理解是:第一,注册标准没有根据空白吸光度的具体试验数据结果来制定,标准的可行性不强;第二,按照试验的平行操作原理,如空白吸光度是在415nm处检测,做准确性这一项目时,所得准确性的结果也应是在415nm处测得,这与标准中要求的检测波长405nm不相吻合,即标准的制定缺乏可操作性;第三,目前不论是全自动生化分析仪还是半自动生化分析仪,其检测波长都为固有化,即只有相应的几个波长可供选择,如半自动生化分析仪(Secomam Basic)的检测波长只有8个,全自动生化分析仪(迈瑞BS-800)的检测波长只有12个。企业在制定产品注册标准及试验方法时只能选择与真实特征吸收峰相隔最近的波长为检测波长,或许由此原因,让企业在拟定产品注册标准时会考虑到相关问题,从而使得产品的注册标准有一定的缺陷。但不论是何原因,产品的注册标准应与产品的出厂检验结果相一致,即应通过具体的试验来验证标准的可行性和可操作性,且企业也应通过出厂检验的结果来严格把握好产品的质量关。
[1]叶应妩,王毓三,申子瑜.全国临床检验手册[M].3版.南京.东南大学出版社 2006452-456
[2]中华人民共和国卫生部.WS/T 124-1999临床化学体外诊断试剂盒质量检验总则[S].1999。
[3]李研,张孝山,李瑞兰,潘彤.酸碱度对对硝基酚呈色反应研究及应用[J].天津医药[2003](05)
[4]陆永绥,李清华,张伟民.临床检验自动化分析标准操作规程[M].浙江大学出版社.2006.9。