去甲基斑蝥素N-乳糖酰壳聚糖纳米粒的吸收机制及小鼠抑瘤作用研究
2012-08-07贝永燕管敏周奕许静玉薛成文胡展红张学农苏州大学药学院江苏苏州2523苏州利元医药科技有限公司江苏苏州25002
贝永燕,管敏,周奕,许静玉,薛成文,胡展红,张学农,2#(.苏州大学药学院,江苏苏州2523;2.苏州利元医药科技有限公司,江苏苏州 25002)
去甲基斑蝥素(Norcantharidin,NCTD)是由我国首先开发的治疗肝癌及肝炎的新药,主要用于原发性肝癌的治疗,但其口服剂量过大时会出现消化道刺激症状和泌尿系统毒性,使其在临床的使用受到很大限制。纳米粒是当前药剂学研究中的一种新型亚微粒给药系统,具有调节释药速度、改善药物口服吸收、提高生物利用度、改变药物体内分布、降低药物毒副作用等优点,已成为国内外药剂学研究的热点领域[1]。本文制备了去甲基斑蝥素N-乳糖酰壳聚糖纳米粒(NCTD-GCNPs),利用纳米粒可被网状内皮系统吞噬达到被动靶向的特点;同时以N-乳糖酰壳聚糖作为载体,而肝细胞表面的去唾液酸糖蛋白受体可与半乳糖残基特异性地识别,从而达到主动/被动双重主动靶向作用。再利用结肠癌Caco-2细胞和肝癌模型小鼠分别研究药物及制剂的吸收机制和体内抑瘤作用,为NCTD开发新型给药系统提供重要依据。
1 仪器与材料
1.1 仪器
XDS-1A倒置生物显微镜(深圳市赛亚泰科仪器设备有限公司);Model ELx 808全自动定量绘图酶标仪(美国Bio-Tek公司);LC-10A高效液相色谱系统(日本岛津公司);M illicellTM底膜培养皿(美国M illipore公司)。
1.2 试药
N-乳糖酰壳聚糖(苏州大学药剂实验室合成);NCTD对照品(苏州苏瑞医药化工有限公司,批号:20060508,纯度:99.21%);氧化苯胂(北京华威锐科化工有限公司);叠氮化钠(浙江省东阳市天宇化工有限公司);环孢素A(福建科瑞药业有限公司,批号:060801,含量:99.3%);去氧胆酸钠(上海中国医药集团上海化学试剂公司,批号:F20070521);乙腈为色谱纯,其余试剂均为分析纯。
1.3 动物与细胞
C57BL/6小鼠,♀♂各半,体重(20±2)g,由苏州大学实验动物中心提供,许可证号:SYXK(苏)2007-0035;小鼠肝癌细胞H22和结肠癌Caco-2细胞(复旦大学生物细胞库)。
2 方法与结果
2.1 NCTD-GC-NPs的制备[2,3]
称取N-乳糖酰壳聚糖0.1 g,溶解于0.2%的乙酸水溶液中,制得2mg·m L-1的壳聚糖高分子溶液,加入适量NCTD后,置于 35 ℃水浴中,500 r·m in-1搅拌溶解,逐滴加入 1.2mg·m L-1的三聚磷酸钠溶液,继续搅拌30min,经0.45μm滤膜过滤,得乳白色纳米粒溶液,并进行相关质量评价,结果纳米粒粒径分布为单峰分布,平均粒径为(118.70±8.84)nm,包封率为(57.92±0.40)%,载药量为(10.38±0.06)%,回收率为(98.31±0.35)%。
2.2 细胞样品NCTD含量分析方法[4]
2.2.1 色谱条件。色谱柱:Hypersil ODS-C18(250 mm×4.6 mm,5μm);流动相:乙腈-pH3.1磷酸水溶液(10∶90,V/V);流速:0.8m L·m in-1;柱温:25 ℃;检测波长:210 nm;进样量:20 μL。
2.2.2 样品处理及方法学考察。取细胞样品100μL,置于EP管中,超声粉碎,13 000 r·min-1离心10min,取上清液20 μL进样。以峰面积(A)为横坐标,浓度(c)为纵坐标,得标准曲线方程:A=645.19c+528.38(r=0.998 8,n=5),NCTD检测浓度在2~80μg·m L-1范围内线性关系良好,回收率为(100.63±1.25)%,RSD为1.03%。
2.3 吸收机制研究[5]
2.3.1 细胞培养。应用DMEM培养液(高糖):包括10%胎牛血清、1%非必需氨基酸、1%丙酮酸钠、1%谷氨酰胺和1%青-链霉素。细胞培养在75 cm2卡氏培养瓶,置于37℃培养箱中,通入5%CO2(相对湿度90%)。
2.3.2 Caco-2细胞形态与酶表达。用倒置显微镜观察Caco-2细胞接种到35mm2培养皿中培养15 d时细胞单分子层的形态。细胞经碱性磷酸酶染色观察细胞的标志酶活性,结果显示,Caco-2细胞经过一定时间培养分化后,具有较高的碱性磷酸酶活性,说明细胞在M illicell膜上生长完全。Caco-2细胞及其经碱性磷酸酶染色的显微镜图见图1。
2.3.3 跨膜电阻值的测定。Caco-2细胞以50 000个/cm2密度种植于M illicell膜上,分别于接种后第0、3、7、13、21天测定M illicell膜上细胞膜的跨膜电阻值,扣除本底值,测定结果见表1。
表1结果表明,13 d以后跨膜电阻值趋向于平稳,说明细胞已形成完整、致密的单层膜,可用于转运试验的研究。

图1 显微镜图(×10)A.Caco-2细胞;B.经碱性磷酸酶染色后的Caco-2细胞Fig 1 m icroscopic grap(h×10)A.Caco-2 cell;B.Caco-2 cellafter staining of alkaline phosphatase

表1 不同时间Caco-2细胞膜的跨膜电阻值比较(n=3)Tab 1 Comparison of transmembrane resistance value of Caco-2 cellm embrane at different tim e(n=3)
2.3.4 酚红转运。于Caco-2细胞种植后的第3、7、13、21天分别在膜上层吸去原培养液,在原培养液的上层加入含有一定浓度(100μg·m L-1)酚红的培养液0.5m L,下层加入1.5m L空白pH 7.4磷酸盐缓冲液(PBS)。2 h后取下层液体0.3m L加入10倍量的氢氧化钠显色,紫外分光光度计(波长为559 nm)测定其酚红吸光度(A),按公式计算酚红透过率(P)。P/%=(ABL×VBL)/(AAP×VAP×t)×100%(式中,ABL为下层透过液体测得的吸光度;VBL为下层透过液体的体积;AAP为上层酚红培养液的吸光度;VAP为上层酚红培养液的体积;t为转运时间)。不同时间Caco-2细胞膜的酚红透过率比较见表2。
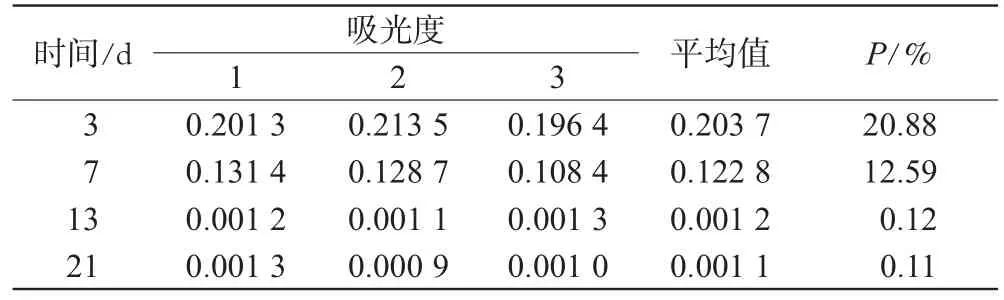
表2 不同时间Caco-2细胞膜的酚红透过率比较(n=3)Fig 2 Com parison of transport amount of phenol red in Caco-2 cellmembraneat different time(n=3)
表2结果表明,13 d以后P<0.5%,说明细胞已形成完整、致密的单层膜,可用于转运试验的研究。
2.3.5 不同转运抑制剂对NCTD-GC-NPs转运的影响。用pH 7.4 PBS溶液稀释制备以NCTD计浓度为80μg·m L-1的NCTD-GC-NPs水溶液,经过滤除菌。取细胞生长完全的M illicell膜,加入NCTD-GC-NPs(80 μg·m L-1,参照组)及其分别与P糖蛋白外排抑制剂环孢素A(50μmol·L-1,环孢素A组)、细胞旁路转运促进剂去氧胆酸钠(100mmol·L-1,去氧胆酸钠组)、能量抑制剂叠氮化钠(25mmol·L-1,叠氮化钠组)、内吞抑制剂氧化苯胂(25mmol·L-1,氧化苯胂组)混合后的等渗溶液,培养20min后取细胞超声粉碎,转速离心10min,取上清液20 μL注入进样测定药物浓度,按下式计算表观透过系数(Papp):Papp=(dQ/dt)/(A×c0),其中dQ/dt表示单位时间的累积透过量,A表示膜表面积(≈1.1 cm2),c0表示药物的初始浓度,结果详见表3。

表3 各组Caco-2细胞转运时的表观透过系数比较(x ±s,n=3)Tab 3 P app of differentgroups in Caco-2 ce(llx ±s,n=3)
表3结果表明,与参照组比较,环孢素A组、叠氮化钠组和去氧胆酸钠组的表观透过系数均明显升高(P<0.05或P<0.01),说明促进药物主动转运的作用比较明显。氧化苯胂组与参照组比较无明显变化,说明其对转运无明显影响。
2.4 抑瘤作用研究
将接种肝癌细胞H22后的小鼠随机分为空白组、对照组(NCTD原料药2mg·kg-1)和NCTD-GC-NPs低、中、高剂量组(0.5、2、4mg·kg-1),每组10只,每日灌胃给药1次,连续给药8 d。每日记录各组小鼠体重变化,测量腋下肿瘤的长和宽,并计算肿瘤的体积=(长×宽×高)/2。8 d后处死各组小鼠,完整剥离肿瘤,称重,以抑瘤率(抑瘤率/%=(1-实验组平均瘤重/空白组平均瘤重)×100%)的大小判断对肿瘤的抑制作用。称重后用10%中性甲醛溶液固定,石蜡包埋,制片,苏木素-伊红(HE)染色,以配有电子成像技术的生物显微镜观察各组小鼠肿瘤的病理学变化,并对典型区域进行拍照。各组小鼠的体重和抑瘤率比较见表4,肿瘤的病理学观察见图2(A、B、C、D为扩大4倍,E为扩大40倍)。

表4 各组小鼠的体重和抑瘤率比较(n=10)Tab 4 Bodyweightofm iceand anti-tumor rate(n=10)
表4结果表明,与空白组比较,其余各组小鼠瘤重均明显减轻(P<0.05或P<0.01);与对照组比较,NCTD-GC-NPs中、高剂量组抑瘤率明显升高(P<0.05或P<0.01)。可见,经半乳糖修饰及纳米粒化后可提高NCTD对小鼠的抑瘤作用。

图2 各组小鼠肿瘤的病理学观察A.空白组;B.对照组;C.NCTD-GC-NPs低剂量组;D.NCTD-GC-NPs中剂量组;E.NCTD-GC-NPs高剂量组Fig 2 Pathologicalobservation of tumor in each group A.blank group;B.control group;C.NCTD-GC-NPs low-dose group;D.NCTD-GC-NPs medium-dose group;E.NCTD-GC-NPs high-dose group
由图2可知,空白组和对照组多见大片肿瘤组织和少量肿瘤坏死组织,NCTD-GC-NPs低、中剂量组多见大片肿瘤坏死组织,直观反映出纳米粒增强了NCTD对肿瘤的杀伤作用。NCTD-GC-NPs高剂量组肿瘤坏死组织的放大图,可见有大量炎症细胞浸润,左上角为肿瘤细胞,图中央大片为炎症细胞,间接反映了机体的免疫功能状况及对肿瘤细胞增殖的抑制作用。
3 讨论
本文以N-乳糖酰壳聚糖为载体,通过离子交联法,制备得NCTD-GC-NPs。采用Caco-2细胞模型研究了NCTD及其肝靶向纳米粒制剂的细胞转运,研究了药物的转运受外排、内吞和旁路转运作用的影响因素。研究了NCTD和NCTD-GCNPs在肝癌模型小鼠体内的抑瘤作用,证实药物经半乳糖修饰及纳米粒化后可提高其抑瘤作用。另外由于Caco-2细胞与小肠上皮细胞结构类似,笔者认为NCTD-GC-NPs主要是穿过小肠上皮细胞。综上所述,NCTD-GC-NPs主要通过主动转运穿过小肠上皮细胞,能明显抑制肝癌肿瘤细胞H22的生长。
[1]马满玲,杨丽杰,陈 岩.肝靶向水溶性药物纳米化的研究进展[J].中国药房,2009,20(1):68.
[2]高艳丽,刘 赛,王科科,等.人结肠癌Caco-2细胞对自组装海藻酸钠纳米粒摄取的体外研究[J].中国药房,2009,20(1):25.
[3]ZhangW,Liu Y,Chen XY,etal.Twomodelling data analytical methods applied to optimise the preparation of norcantharidin chitosan nanoparticles[J].J Experil Nanoscl,2010,5(3):271.
[4]Wang Q,Zhang L,HuW,etal.Norcantharidin-associated galactosylated chitosan nanoparticles for hepatocyte-targeted delivery[J].Nanomedicine,2010,6(2):371.
[5]杨海涛,王广基.Caco-2单层细胞模型及其在药学中的应用[J].药学学报,2000,35(10):790.
